Na2O2和H2O反应后溶液中滴入酚酞试液红色褪色原因探究
2016-12-15段开锐
段开锐
[摘 要]针对Na2O2和H2O反应后溶液中滴入酚酞试液红色褪色现象的不同解释设计对照实验进行探究,通过实验发现,出现“先变红后变无色”的主要因素是生成的氢氧化钠溶液浓度太大,强碱性使酚酞结构被破坏而褪色,碱溶液浓度越大,褪色越快。
[关键词]Na2O2和H2O反应 酚酞 褪色
[中图分类号] G633.8[文献标识码] A[文章编号] 16746058(2016)260089
人教版必修2第三章第三节实验3-5:把水滴入盛有少量过氧化钠的试管中,向反应后的溶液中滴入酚酞溶液,有什么现象发生?为什么?教师教学用书上只说“滴入酚酞溶液后溶液颜色变红”,未说明红色褪去这一明显现象是不妥的。事实上这一现象太过于明显,是高中化学教师授课过程中无法绕过的,因此必须给学生作进一步的解释。
通常教师或者资料所给的解释是:过氧化钠与水反应的方程式为:
①Na2O2+2H2O=2NaOH+H2O2;②2H2O2=2H2O+O2↑。
总反应为2Na2O2+2H2O=4NaOH+O2↑。
所以溶液变红色后立即又变无色,是因为反应后有氢氧化钠生成使溶液显碱性,又因为过氧化氢并未完全分解,将红色物质漂白为无色物质。
酚酞是一种有机弱酸,在pH<8.2的溶液里为无色的内酯式结构,当pH>8.2时为红色的醌式结构。酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式,遇到较浓的碱液,则会立即转变成无色的羧酸盐式。所以,酚酞试剂滴入浓碱液时,酚酞开始变红,很快红色褪去变成无色。
那么Na2O2和H2O反应后溶液中滴入酚酞试液,红色褪去的主要原因究竟是什么呢?设计如下三组对照实验进行探究。
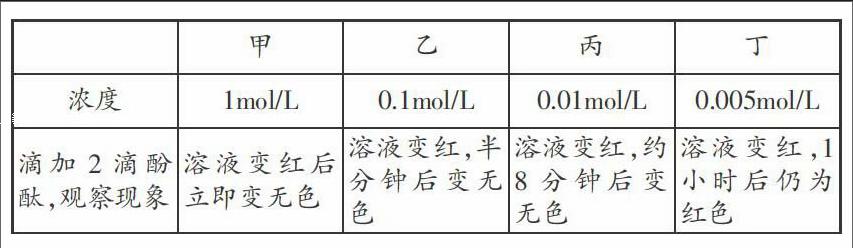
实验1:称取0.78克Na2O2放置于50mL的小烧杯中,加10mL蒸馏水使之充分反应,待冷却至室温时转移到试剂瓶中备用。经计算,此溶液浓度相当于c(NaOH)=1mol/L,别取该溶液2mL,由该溶液稀释配制成的0.1mol/L、0.01mol/L、0.005mol/L溶液2mL依次分盛于甲乙丙丁四支试管中,做如下实验:
结论:Na2O2和H2O反应后的碱溶液浓度越大,褪色越快。
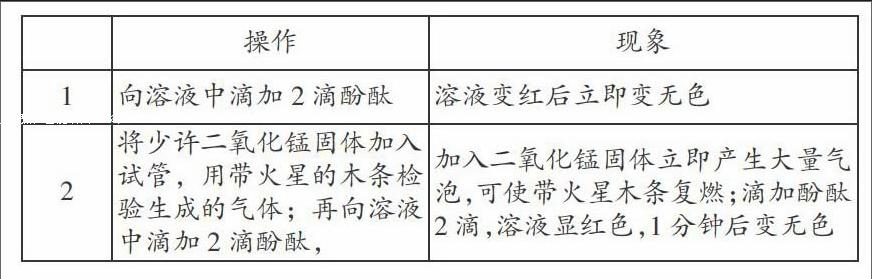
实验2:取过氧化钠反应后的1mol/L溶液3mL分别盛试管1、2中,做如下实验:
结论:Na2O2与H2O生成的H2O2部分分解放出O2,部分存在于溶液中;加二氧化锰使H2O2完全分解后滴加酚酞还是很快褪色,说明红色褪去不是由H2O2的氧化性引起的漂白。
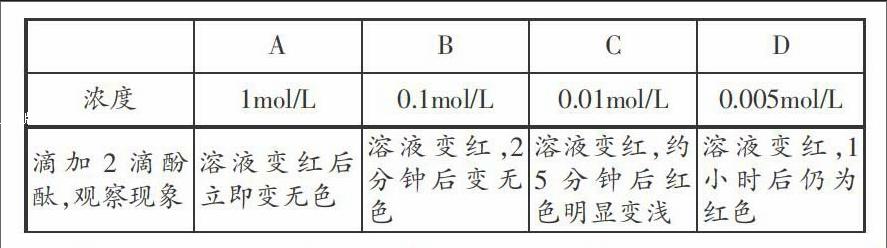
实验3:称取0.4克NaOH固体放置于50mL的小烧杯中,加10mL蒸馏水配制成浓度约1mol/L的NaOH,待冷却至室温时转移到试剂瓶中备用。取该溶液2mL,由该溶液稀释配制成的0.1mol/L、0.01mol/L、0.005mol/L溶液2mL依次分盛于A、B、C、D四支试管中,做如下实验:
在滴加酚酞变红色后的D试管中再加入30%过氧化氢1mL,充分振荡试管,10分钟后红色稍微变浅了一点,1小时后颜色基本未变。
结论:NaOH溶液浓度越大,褪色越快。
通过以上三组实验发现,出现“先变红后变无色”的主要因素是生成的氢氧化钠溶液浓度太大,强碱性使酚酞结构被破坏而褪色,而不是H2O2的氧化性引起的漂白。在前面的实验中氢氧化钠溶液浓度为0.005mol/L时,直接加入1mL30%的双氧水都不能使溶液立即褪色。
在定性实验中,固体取用量以刚好铺满试管底为宜。在做Na2O2和H2O反应的演示实验时,为了生成更多的氧气,有效完成带火星木条复燃的实验,实验时取用的过氧化钠固体往往比1克要多,这样导致最后生成的氢氧化钠溶液浓度至少大于1mol/L,故滴入酚酞试液,溶液显红色后又立即变无色。
(责任编辑 罗 艳)
