芦荟大黄素对体外胶质瘤细胞生物学行为的影响
2016-12-15陕西省商洛市镇安县医院神经外科镇安711500李向忠吴德文
陕西省商洛市镇安县医院神经外科(镇安711500) 李向忠 李 银 吴德文
芦荟大黄素对体外胶质瘤细胞生物学行为的影响
陕西省商洛市镇安县医院神经外科(镇安711500) 李向忠 李 银 吴德文△
目的:探讨芦荟大黄素(Aloe emodin,AE)在体外对胶质瘤SHG44细胞增殖、细胞周期、黏附、迁移和侵袭能力的影响。 方法:将体外人脑胶质瘤细胞分为两组,实验组经AE处理(AE浓度分别为20μmol/L、40μmol/L、80μmol/L和160μmol/L),同时设对照组(未经药物处理)。采用CCK-8法检测AE处理后SHG44细胞的增殖情况;流式细胞仪分析细胞周期变化;细胞黏附实验检测细胞黏附能力,通过Transwell小室方法检测AE对SHG44细胞迁移和侵袭能力的影响。 结果:与对照组相比,AE处理胶质瘤SHG44细胞后,CCK-8法及流式细胞仪分析结果显示AE能抑制SHG44细胞增殖,并呈剂量依赖和时间依赖效应关系;对于细胞周期的影响主要变现为引起细胞发生S期阻滞;AE处理后能降低SHG44细胞的粘附能力;Transwell小室实验表明AE处理后的SHG44细胞迁移和侵袭能力明显降低。 结论:AE能通过阻滞细胞周期于S期而抑制胶质瘤SHG44细胞的增殖,并且下调胶质瘤细胞的黏附能力,降低细胞体外迁移及侵袭能力。
脑胶质瘤作为难治性肿瘤之一,发病率在脑肿瘤中占40%~50%[1],具有侵袭性强和易复发等特点,手术难以完全切除,药物化疗和放射治疗也无法高度特异性地杀伤肿瘤细胞。因此,寻求新的治疗胶质瘤的方法具有极其重要的意义。芦荟大黄素(Aloe emodin,AE)作为传统中药中的一种生物活性成分,具有多方面作用[2],对肿瘤也有一定的抑制作用[3-4]。但目前有关AE对胶质瘤细胞生物学行为方面的研究鲜见文献报道。本研究在体外通过细胞培养,观察AE对体外人胶质瘤细胞株SHG44生物学行为的影响,为使用AE治疗胶质瘤提供实验依据。
材料与方法
1 细胞株及试剂 人脑胶质瘤SHG44细胞由西安医学院第一附属医院中心实验室提供。芦荟大黄素(纯度>95%)、DMSO试剂购自美国Sigma公司,CCK-8试剂盒购自北京索莱宝生物科技有限公司,DMEM培养基与胎牛血清购自美国Hyclone公司,细胞周期检测试剂盒购自Becton Dickinson(BD)公司,Matrigel购自BD Biosciences公司,Transwell培养小室购自Millipore公司。
2 细胞培养 将胶质瘤SHG44细胞应用加入10%胎牛血清及100μg/ml青、链霉素的DMEM培养液培养,培养条件:37℃、5%CO2及饱和湿度。取对数生长期细胞进行实验。
3 CCK-8法检测胶质瘤细胞的增殖 选取对数期生长的SHG44细胞,经胰酶消化、计数,调整细胞浓度后以1×105个/ml浓度接种于96孔培养板内,每孔100μl,每组设5个复孔,24h后,加入不同浓度药物,使AE终浓度为20、40、80、160μmol/L,以等体积的DMSO溶液代替药物设置对照组,继续孵育。用CCK-8分别测定0、24、48和72h时细胞的增殖活性。检测前2 h,向每孔加入10μl CCK-8溶液,再在培养箱内37℃孵育2 h,用酶标仪测定450nm处各孔的吸光度值A值。计算细胞增殖抑制率。
细胞增殖抑制率=(1-实验组平均A值/对照组平均A值)×100%
4 流式细胞仪检测细胞周期 按照上述培养处理方法,将对照组及AE处理组培养48 h的细胞收集,2000 r/min离心5 min,弃上清液,加冰浴预冷的70%乙醇溶液并振荡,4℃固定,12h后用PBS洗去残留的乙醇,每管细胞样品中各加入15μl碘化丙啶(PI)染色液,室温条件下反应20 min,上机进行细胞周期检测。
5 细胞黏附实验 将Matrigel(50μg/ml)均匀铺于6孔板底部(100μl/孔),对照孔加等体积1% BSA,于37℃孵育2h,弃去上清,4℃保存备用。收集预先经不同浓度AE处理24 h的SHG44细胞,制成单细胞悬液,以1×106个/孔的剂量接种于6孔板中,培养2 h后弃去培养液,PBS洗脱3次,用胰蛋白酶消化后重新收集细胞。计数细胞,以3个平行复孔的平均数作为黏附细胞数,计算黏附率:黏附率(%)=黏附细胞总数/总细胞数×100%。
6 细胞迁移实验 将胶质瘤细胞接种于6孔板,用不同浓度AE培养48h,分别收集各组细胞,调整细胞密度为1×105个/ml,将200μl细胞悬液接种于Transwell小室上室,下室加入含10%胎牛血清的DMEM培养基,孵箱中继续培养24h,取出Transwell小室,洗涤,用多聚甲醛固定30 min,结晶紫染色15min,PBS漂洗3次,倒置光学显微镜下选取5个视野观察计算小室膜下的细胞数目,计算每个视野的平均细胞数,即表示细胞的迁移能力。
7 细胞侵袭实验 采用8μm孔径、6.5mm直径的Transwell小室,上室和下室之间以Matrigel胶和聚偏二氟乙烯(PVPF)膜模拟体内的基质和基底膜,其它步骤同迁移实验,最后计数5个视野穿膜细胞数,计算平均细胞数,表示肿瘤细胞的侵袭能力。
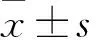
结 果
1AE对胶质瘤细胞增殖的抑制 经酶标仪检测各组的吸光度值并计算细胞增殖抑制率,表明AE在20~160μmol/L范围内能够抑制SHG44细胞的增殖,呈现一定的剂量依赖和时间依赖效应关系(图1)。

图1 不同浓度AE对SHG44胶质瘤细胞增殖抑制率
2AE对胶质瘤细胞周期的影响 经AE处理48h后,流式细胞术检测细胞周期,结果显示20、40、80、160μmol/LAE处理组被阻滞于S期的细胞数量分别为(9.93±0.38)%、(15.13±0.67)%、(21.59±0.94)%和(28.69±0.59)%,均较对照组(5.24±0.48)%明显增加(P<0.05),各组实验组G0/G1期比例也略微增加,而G2/M期细胞比例则明显减少,差别具有统计学意义(P<0.05)(图2)。说明AE作用后可以影响胶质瘤SHG44细胞周期的进程,阻断胶质瘤细胞增殖周期于S期。
3AE对SHG44细胞粘附能力的影响 细胞粘附实验结果显示,20、40、80、160μmol/L的黏附率分别为(38.24±5.16)%、(31.82±4.02)%、(23. 21±3.27)%、(14.03±3.15)%,与对照组(46.39±5.54)%比较,有统计学差异(P均<0.05),说明AE处理后能抑制SHG44细胞的粘附(图3)。

图2 流式细胞仪检测不同浓度AE处理后细胞周期的变化(1:对照组;2:20μmol/L组;3:40μmol/L组;4:80μmol/L组;5:160μmol/L组)

图3 各组胶质瘤细胞黏附率比较(*P<0.05)
4AE对SHG44 细胞迁移及侵袭能力的影响 各处理组在AE作用48h后进行Transwell实验,结果如附表所示,AE各浓度均能减少迁移及侵袭实验中的穿膜细胞数,差异均具有统计学意义(P<0.05),说明AE可以降低胶质瘤细胞的迁移、侵袭能力。

附表 不同浓度AE对胶质瘤SHG44细胞迁移及侵袭的影响
讨 论
脑胶质瘤是原发性中枢神经系统肿瘤中最常见的类型,尽管临床上有手术、药物及放化疗等各种治疗手段,但其病死率、复发率仍居高不下。AE是蓼科大黄属植物中的活性成分,属于蒽醌类物质,目前国内外已经报道了AE在体外对胃癌[5]、甲状腺癌[6]、乳腺癌[7]、黑色素瘤[8]和口腔癌[9]等多种肿瘤细胞的增殖都有抑制作用,但是对不同的细胞系, 抗扩增的机制并不相同[4]。杨大庆[10]报道,芦荟大黄素通过抑制肿瘤细胞蛋白质合成所需的肽链延长因子eFF-2和肽转移酶的活性,抵制肿瘤细胞的增殖。
本实验使用体外细胞模型研究了AE对SHG44细胞增殖、细胞周期、转移及侵袭能力等生物学行为的影响。研究结果显示,AE作用于SHG44细胞后,细胞增殖速度减慢,生长受到抑制,S期细胞所占比例增高,证实AE通过阻滞细胞周期于S期,减慢细胞周期进程,从而抑制胶质瘤细胞的增殖。
对于不同的肿瘤类型,AE产生细胞周期阻滞的阶段并不完全一样。在胃癌SGC-7901细胞[11]及鼻咽癌细胞[12]中,AE使得细胞周期阻滞于G2/M期,其机制可能涉及cyclinB1和周期蛋白依赖性激酶1(cdk1)的升高。而在人胶质瘤U87株细胞[13]及U-373MG细胞[14]中AE阻滞细胞周期于S期,其机制则可能与蛋白激酶C(PKC)活性的抑制有关。本研究在胶质瘤SHG44细胞中的关于细胞周期进程的研究结果与文献基本一致,但其具体机制尚需进一步研究。
侵袭与转移是恶性肿瘤的特征,癌细胞通过粘附、局部蛋白酶水解、运动3个步骤的反复进行,导致肿瘤向深部组织侵袭及转移。本文黏附实验结果表明AE作用后能降低胶质瘤细胞黏附基底膜的能力,既往HeTP等在高转移人卵巢癌细胞系HO-8910PM中也发现AE可以显著性抑制肿瘤细胞的黏附能力[15]。关于粘附特性在肿瘤行为中的作用,一方面,肿瘤细胞必须与原来的肿瘤组织脱粘附,才能开始侵袭,故粘附在肿瘤细胞侵袭中起抑制作用;另一方面,肿瘤细胞需要依靠粘附才能在新的部位与基底膜成分结合,形成新的转移灶,故粘附在肿瘤细胞转移中起促进作用。本研究显示AE抑制SHG44细胞粘附Matrigel基质胶,然而这种作用究竟是促进还是抑制胶质瘤细胞的侵袭和转移,尚需进一步研究。
有研究报道,用鼻咽癌[12]和乳腺癌[7]、膀胱癌[16]和卵巢癌[15]等细胞研究AE的抗肿瘤作用,结果表明AE能抑制肿瘤细胞侵袭和转移。但是,在结肠癌SW620细胞中的研究与上述情况则刚好相反,即AE的作用能增强肿瘤细胞侵袭能力[17]。以上情况表明AE在不同的肿瘤细胞中的作用不全相同,这提示我们必须进一步研究以明确AE在各种类型肿瘤细胞中的实际效果。
本实验中,笔者通过Transwell小室的实验方法利用细胞模型在体外证实AE具有降低胶质瘤SHG44细胞侵袭及迁移能力的作用。有研究证实,在鼻咽癌[12]、黑色素瘤[17]、舌癌[18]及结肠癌[19]中AE可以通过下调MMP-2及MMP-9等的表达来抑制肿瘤的迁移和侵袭。MMP-2与MMP-9是与肿瘤浸润及转移关系最为密切的MMPs家族[20]。MMP-2 主要通过特异性降解基膜的主要成分Ⅳ、Ⅴ型胶原,对肿瘤的侵袭转移有重要作用[21]。MMP-9 可降解多种基质成分,破坏基膜,导致肿瘤细胞的浸润转移[22]。
本文实验结果表明,AE能通过抑制细胞增殖、阻滞细胞周期、降低迁移及侵袭能力等多种途径发挥抗胶质瘤作用,提示AE有望成为抗胶质瘤药物。当然,体外实验与体内肿瘤组织的生物学行为存在很大差异,还需在肿瘤动物模型上进一步探讨和验证,并对其作用机制进行深入研究,从而为临床应用AE治疗胶质瘤提供实验依据。
[1]HessKR,KristineRB,BondyML.AdultgliomaincidencetrendsintheUnitedStates, 1977-2000[J].Cancer, 2004,101(10):2293-2299.
[2] 黄伟锋. 大黄素的药理作用研究进展[J]. 柳州医学, 2013 (4):241-244.
[3]ChenR,ZhangJ,HuY, et al.PotentialantineoplasticeffectsofAloe-emodin:Acomprehensivereview[J].AmericanJournalofChineseMedicine, 2014,42(2):275-288.
[4] 刘贵忠, 杨文修, 王新宇, 等. 大黄素、芦荟大黄素、大黄酸诱导肿瘤细胞凋亡的信号转导通路[J]. 哈尔滨师范大学自然科学学报, 2004,20(4):95-98.
[5] 梁 军, 王俊林, 刘志新, 等. 芦荟大黄素诱导胃癌细胞株MGC-803细胞凋亡药效学作用研究[J]. 现代肿瘤医学, 2010,10(18):1915-1919.
[6] 赵华栋, 张 静, 南 菁, 等. 芦荟大黄素对人甲状腺癌细胞K1的促凋亡作用[J]. 现代生物医学进展, 2010,17(10):3225-3227.
[7] 何振辉, 何太平, 翁闪凡, 等. 芦荟大黄素对高转移乳腺癌细胞MDA-MB-231体外转移潜能的影响[J]. 中国药理学通报, 2013,29(8):1114-1118.
[8]TabolacciC,CordellaM,TurcanoL, et al.Aloe-emodinexertsapotentanticancerandimmunomodulatoryactivityonBRAF-mutatedhumanmelanomacells[J].EuropeanJournalofPharmacology, 2015,762:283-292.
[9] 肖丙秀, 郭俊明. 芦荟大黄素抑制人口腔癌KB细胞增殖和迁移的双重效应及其机制研究[J].ChineseJournalofStomatology, 2009,44(1):50-52.
[10] 杨大庆.芦荟的药用机理研究[J].陕西中医,2004,25(7):641-642.
[11]GuoJ,XiaoB,LiuQ, et al.SuppressionofC-mycexpressionassociateswithanti-proliferationofaloe-emodinongastriccancercells[J].CancerInvestigation, 2008,26(4):369-374.
[12]LinML,LuYJ,WangSG, et al.Down-regulationofMMP-2throughthep38MAPK-NF-kappaB-dependentpathwaybyaloe-emodinleadstoinhibitionofnasopharyngealcarcinomacellinvasion[J].MolecularCarcinogenesis, 2010,49(9):783-797.
[13]IsmailS,HarisK,AbdulGhaniAR, et al.EnhancedinductionofcellcyclearrestandapoptosisviathemitochondrialmembranepotentialdisruptioninhumanU87malignantgliomacellsbyaloeemodin[J].JournalofAsianNaturalProductsResearch, 2013,9(15):1003-1012.
[14]Acevedo-DuncanM,RussellC,PatelS, et al.Aloe-emodinmodulatesPKCisozymes,inhibitsproliferation,andinducesapoptosisinU-373MGgliomacells[J].InternationalImmunopharmacology, 2004,4(14):1775-1784.
[15]HeTP,YanWH,MoLE, et al.Inhibitoryeffectofaloe-emodinonmetastasispotentialinHO-8910PMcellline[J].JournalofAsianNaturalProductsResearch, 2008,10(5-6):383-390.
[16] 杨增悦, 付 强, 雷永华, 等. 芦荟大黄素对人膀胱癌细胞FasL基因表达和侵袭能力的影响[J]. 现代生物医学进展, 2009,9(21):4037-4039.
[17]TabolacciC,LentiniA,MattioliP, et al.Antitumorpropertiesofaloe-emodinandinductionoftransglutaminase2activityinB16-F10melanomacells[J].LifeSciences, 2010,87(9-10):316-324.
[18]ChenYY,ChiangSYLinJG,MaYS, et al.Emodin,aloe-emodinandrheininhibitmigrationandinvasioninhumantonguecancerSCC-4cellsthroughtheinhibitionofgeneexpressionofmatrixmetalloproteinase-9[J].InternationalJournalofOncology, 2010,36(5):1113-1120.
[19]SubojP,BabykuttyS,GopiDRV, et al.Aloeemodininhibitscoloncancercellmigration/angiogenesisbydownregulatingMMP-2/9,RhoBandVEGFviareducedDNAbindingactivityofNF-κB[J].EuropeanJournalofPharmaceuticalSciencesOfficialJournaloftheEuropeanFederationforPharmaceuticalSciences, 2012,45(5):581-591.
[20] 吴晓玲, 蔡东阁, 刘变利,等. 氧化苦参碱对子宫内膜癌细胞侵袭转移的抑制作用及其机制探讨[J]. 陕西医学杂志, 2015,44(10):1284-1285.
[21]CaoWH,LiuHM,LiuX, et al.Relaxinenhancesin-vitroinvasivenessofbreastcancercelllinesbyupregulationofS100A4/MMPssignaling[J].EuropeanReviewforMedical&PharmacologicalSciences, 2013,17(5):609-617.
[22] 曹 艳, 何利红, 孙 赟,等. 黄芪甲苷对胃癌细胞SGC7901侵袭能力的影响及其机制探讨[J]. 陕西医学杂志, 2015,44(6):656-659.
(收稿:2016-05-23)
芦荟大黄素/药理学 神经胶质瘤/病理生理学 细胞增殖抑制或刺激药(中药) 体外发生 细胞迁移 抑制
R915
A
10.3969/j.issn.1000-7377.2016.11.006
△西安医学院第一附属医院神经外科
