妇科肿瘤患者外周血中调节性T细胞和血清中TGF-β、IL-10的变化及相关性研究
2016-12-15于丹军曹丽艳
于丹军,樊 静,胡 月,姜 丽,曹丽艳,门 帅
(1.河北省秦皇岛市第一医院检验科,河北 秦皇岛 066000; 2.河北省秦皇岛市第四医院检验科,河北 秦皇岛 066000)
·论 著·
妇科肿瘤患者外周血中调节性T细胞和血清中TGF-β、IL-10的变化及相关性研究
于丹军1,樊 静2,胡 月1,姜 丽1,曹丽艳1,门 帅1
(1.河北省秦皇岛市第一医院检验科,河北 秦皇岛 066000; 2.河北省秦皇岛市第四医院检验科,河北 秦皇岛 066000)
目的探讨妇科肿瘤患者外周血调节性T细胞(regulatory T cells, Treg)、T细胞亚群表达和血清中转化生长因子β(transforming growth factor-β,TGF-β)、白细胞介素10(interleukin-10, IL-10)细胞因子的变化及相关性。方法选取97例妇科肿瘤患者(宫颈癌患者32例、子宫内膜癌患者35例、卵巢癌患者30例)和健康体检者30例为研究对象,应用流式细胞术检测所有研究对象外周血中CD4+CD25+Foxp3+、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞的比率及T细胞亚群分布;应用ELISA方法检测血清中细胞因子TGF-β1、TGF-β2、IL-10的含量。结果妇科肿瘤组外周血中CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞的比率明显高于对照组,差异有统计学意义(P<0.05);T细胞亚群分布与对照组差异无统计学意义(P>0.05);血清中TGF-β1、IL-10含量明显高于对照组,TGF-β2含量低于对照组,差异有统计学意义(P<0.05)。妇科肿瘤组手术1个月后、化疗4个周期后外周血中CD4+CD25+Foxp3+Treg占CD4+T淋巴细胞的比率,CD4+CD25+CD127lowTreg占CD4+T淋巴细胞的比率,血清中TGF-β1、TGF-β2、IL-10含量及手术1个月后CD4+T淋巴细胞、CD8+T淋巴细胞、CD4+/CD8+,化疗4个周期后CD4+、CD19+T细胞明显低于手术前,差异有统计学意义(P<0.05);CD4+CD25+Foxp3+Treg占CD4+T淋巴细胞的比率与血清TGF-β1含量之间存在正相关(rs=0.220,P=0.034);CD4+CD25+CD127lowTreg占CD4+T淋巴细胞的比率与血清中TGF-β1、TGF-β2、 IL-10含量之间均存在正相关(rs=0.284、0.385、0.336,P<0.01)。结论妇科肿瘤患者其免疫耐受机制可能与CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞的比率及细胞因子TGF-β1、TGF-β2、IL-10含量相关。
生殖器肿瘤,女(雌)性;T淋巴细胞,调节性;流式细胞术
调节性T细胞(regulatory T cell,Treg)是特殊的具有负调控作用的T淋巴细胞亚群,它能维持自身免疫稳定状态,预防自身免疫性疾病[1]。研究表明,Treg细胞可以通过抑制免疫系统对肿瘤抗原的识别和应答造成肿瘤细胞的逃逸,Treg对肿瘤的发生和发展可能起到重要作用[2]。它们在体外可以细胞-细胞接触的形式抑制CD4+和CD8+T细胞功能[3]。妇科恶性肿瘤是严重威胁女性生命和健康的疾病,如何提高患者生存质量,延长生存时间是目前对妇科肿瘤的研究热点。本研究应用流式细胞仪法和ELISA法检测卵巢癌、子宫内膜癌、宫颈癌患者及健康对照组外周血中Treg、T淋巴细胞亚群表达以及血清中转化生长因子β1(transforming growth factor-β1,TGF-β1)、TGF-β2、白细胞介素10(interleukin-10,IL-10)的变化和相关性,探讨其在妇科肿瘤发生发展中的作用,并进一步了解其在临床方面的价值,旨在为妇科肿瘤的早期诊断和免疫治疗提供理论基础。现报告如下。
1 资料与方法
1.1 一般资料 选取2014年11月—2015年11月于河北省秦皇岛市第一医院病理活组织检查确诊的妇科肿瘤患者(妇科肿瘤组)97例(宫颈癌患者32例、子宫内膜癌患者35例、卵巢癌患者30例),年龄28~65岁,平均(49.2±9.8)岁。且近3个月内未使用任何抗肿瘤治疗和免疫治疗,排除自身免疫性疾病、严重系统性疾病、感染性疾病和妊娠。另选取同一时期进行体检的健康女性(对照组)30例,年龄29~62岁,平均(49.5±8.5)岁。2组年龄差异无统计学意义(P>0.05),具有可比性。
本研究获医院伦理委员会批准,所有被检者均签署知情同意书。
1.2 试剂与仪器 流式细胞仪(Beckman Coulter EP-ICS XL)购自美国贝克曼公司。鼠抗人FITC-CD4、PE-CD8、PC5-CD3、FITC-CD3、PE-CD(16+56)、PC5-CD19、FITC-CD4、PE-CD25、PC5-CD127、同型对照鼠抗人IgG均购自美国贝克曼公司。Foxp3试剂盒购自美国Ebioscience公司。IL-10、TGF-β1、TGF-β2试剂盒均购自Rapibio公司。
1.3 标本采集 妇科肿瘤组患者的诊断均经病理学诊断证实,于手术前1 d、术后1个月、化疗4个周期后采集静脉血;对照组于体检时采静脉血。
1.4 方法
1.4.1 外周血T细胞亚群检测 妇科肿瘤组及对照组采静脉血2 mL,EDTA抗凝。分别依次加入鼠抗人FITC-CD4、PE-CD8、PC5-CD3、FITC-CD3、PE-CD(16+56)、PC5-CD19抗体和同型对照避光孵育15 min,加入溶血素后避光孵育10 min,离心弃上清加入PBS上机检测。
1.4.2 外周血 CD4+CD25+Foxp3+Treg占CD4+T淋巴细胞比率的检测 妇科肿瘤组及对照组采静脉血2mL,EDTA抗凝。分别依次加入FITC-CD4、PE-CD25 、PC5-Foxp3抗体和同型对照避光孵育20 min进行表面染色,固定破膜后加入Foxp3 荧光抗体,避光孵育40min。冲洗后上机检测。
1.4.3 外周血CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率的检测 妇科肿瘤组及对照组采静脉血2 mL,EDTA抗凝。分别依次加入鼠抗人FITC-CD4、PE-CD25、PC5-127抗体和同型对照避光孵育15 min,加入溶血素后避光孵育10 min,离心弃上清后加入PBS上机检测。
1.4.4 血清中TGF-β1、TGF-β2、IL-10的检测 采用ELISA方法进行血清中TGF-β1、TGF-β2、IL-10定量检测,操作步骤严格按照试剂盒说明书操作。

2 结 果
2.1 2组外周血CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率及T淋巴细胞亚群分布比较 妇科肿瘤组外周血CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率均明显高于对照组,差异有统计学意义(P<0.05);妇科肿瘤组外周血T淋巴细胞亚群与对照组差异无统计学意义(P>0.05)。见表1。
表1 外周血CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率及T淋巴细胞亚群比较
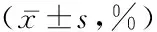
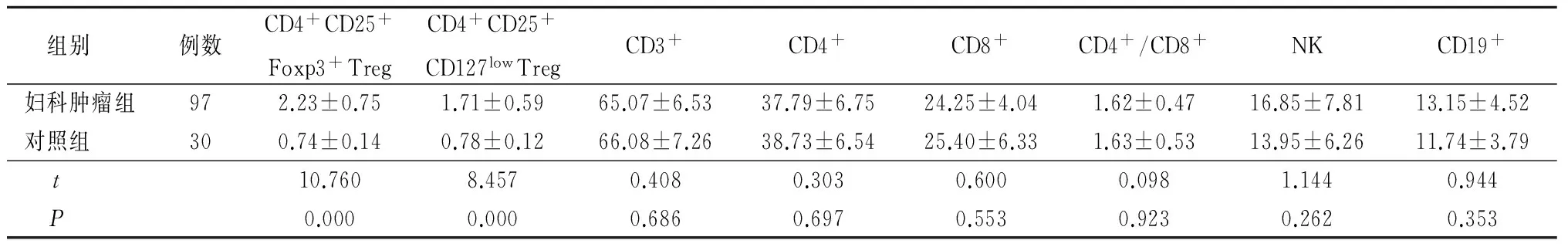
组别 例数CD4+CD25+Foxp3+TregCD4+CD25+CD127lowTregCD3+CD4+CD8+CD4+/CD8+NKCD19+妇科肿瘤组972.23±0.751.71±0.5965.07±6.5337.79±6.7524.25±4.041.62±0.4716.85±7.8113.15±4.52对照组 300.74±0.140.78±0.1266.08±7.2638.73±6.5425.40±6.331.63±0.5313.95±6.2611.74±3.79t 10.7608.4570.4080.3030.6000.0981.1440.944P 0.0000.0000.6860.6970.5530.9230.2620.353
2.2 妇科肿瘤组手术前后、化疗后外周血CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率及T淋巴细胞亚群比较 妇科肿瘤组手术1个月后、化疗4个周期后CD4+CD25+Foxp3+Treg占CD4+T淋巴细胞比率、CD4+CD25+CD127lowTreg占CD4+淋巴细胞比率明显低于手术前,化疗4个周期后低于手术1个月后,差异有统计学意义(P<0.05);妇科肿瘤组手术1个月后CD4+T淋巴细胞、CD8+T淋巴细胞、CD4+/CD8+明显低于手术前,化疗4个周期后CD4+、CD19+T淋巴细胞低于手术前,化疗4个周期后CD8+、CD19+T淋巴细胞低于手术1个月后,差异有统计学意义(P<0.05)。见表2。
表2 妇科肿瘤组手术前后、化疗后外周血CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率及T淋巴细胞亚群比较
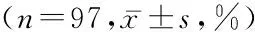
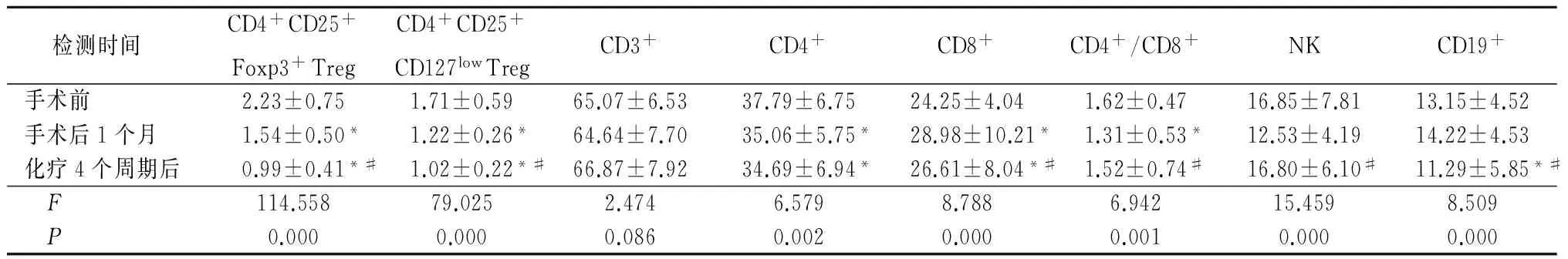
检测时间 CD4+CD25+Foxp3+TregCD4+CD25+CD127lowTregCD3+CD4+CD8+CD4+/CD8+NKCD19+手术前2.23±0.751.71±0.5965.07±6.5337.79±6.7524.25±4.041.62±0.4716.85±7.8113.15±4.52手术后1个月1.54±0.50*1.22±0.26*64.64±7.7035.06±5.75*28.98±10.21*1.31±0.53*12.53±4.1914.22±4.53化疗4个周期后0.99±0.41*#1.02±0.22*#66.87±7.9234.69±6.94*26.61±8.04*#1.52±0.74#16.80±6.10#11.29±5.85*# F114.55879.0252.4746.5798.7886.94215.4598.509 P0.0000.0000.0860.0020.0000.0010.0000.000
*P<0.05与手术前比较 #P<0.05与手术后1个月比较(q检验)
2.3 2组血清中TGF-β1、TGF-β2、 IL-10含量比较 妇科肿瘤组外周血血清TGF-β1、IL-10含量明显高于对照组,TGF-β2含量明显低于对照组,差异有统计学意义(P<0.05),见表3。

表3 血清TGF-β1、TGF-β2、 IL-10含量比较
2.4 妇科肿瘤组手术前后、化疗后血清TGF-β1、TGF-β2、 IL-10含量的比较 妇科肿瘤组手术1个月后、化疗4个周期后血清TGF-β1、TGF-β2、 IL-10含量明显低于手术前,化疗4个周期后低于手术1个月后,差异有统计学意义(P<0.05),见表4。
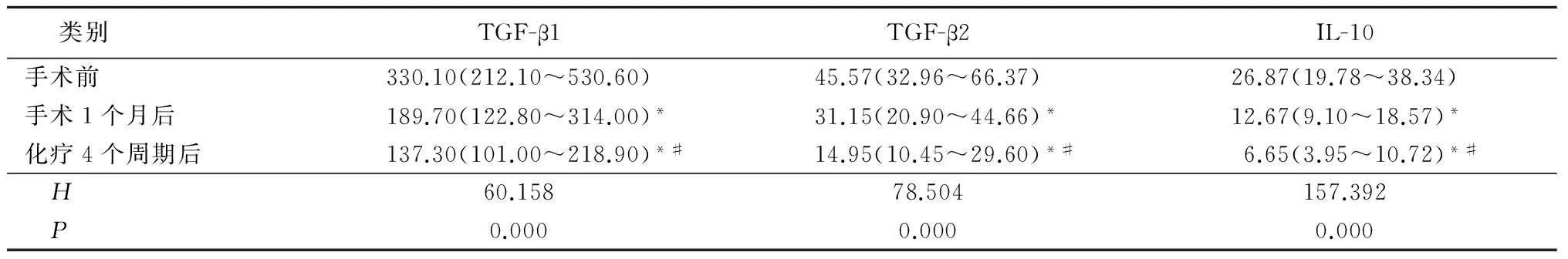
表4 妇科肿瘤组手术前后、化疗后血清TGF-β1、TGF-β2、IL-10含量比较
*P<0.05与手术前比较 #P<0.05与手术后1个月比较(秩和检验)
2.5 妇科肿瘤组CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率与血清TGF-β1、TGF-β2 、IL-10含量相关性分析 妇科肿瘤组CD4+CD25+Foxp3+Treg占CD4+T淋巴细胞比率与TGF-β1含量之间存在正相关(rs=0.220,P=0.034),与血清TGF-β2、IL-10之间无相关性(rs=0.001,P=0.990;rs=0.158,P=0.122);CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率与血清TGF-β1、TGF-β2 、IL-10含量之间均存在正相关(rs=0.284、0.385、0.336,P<0.01)。见图1。
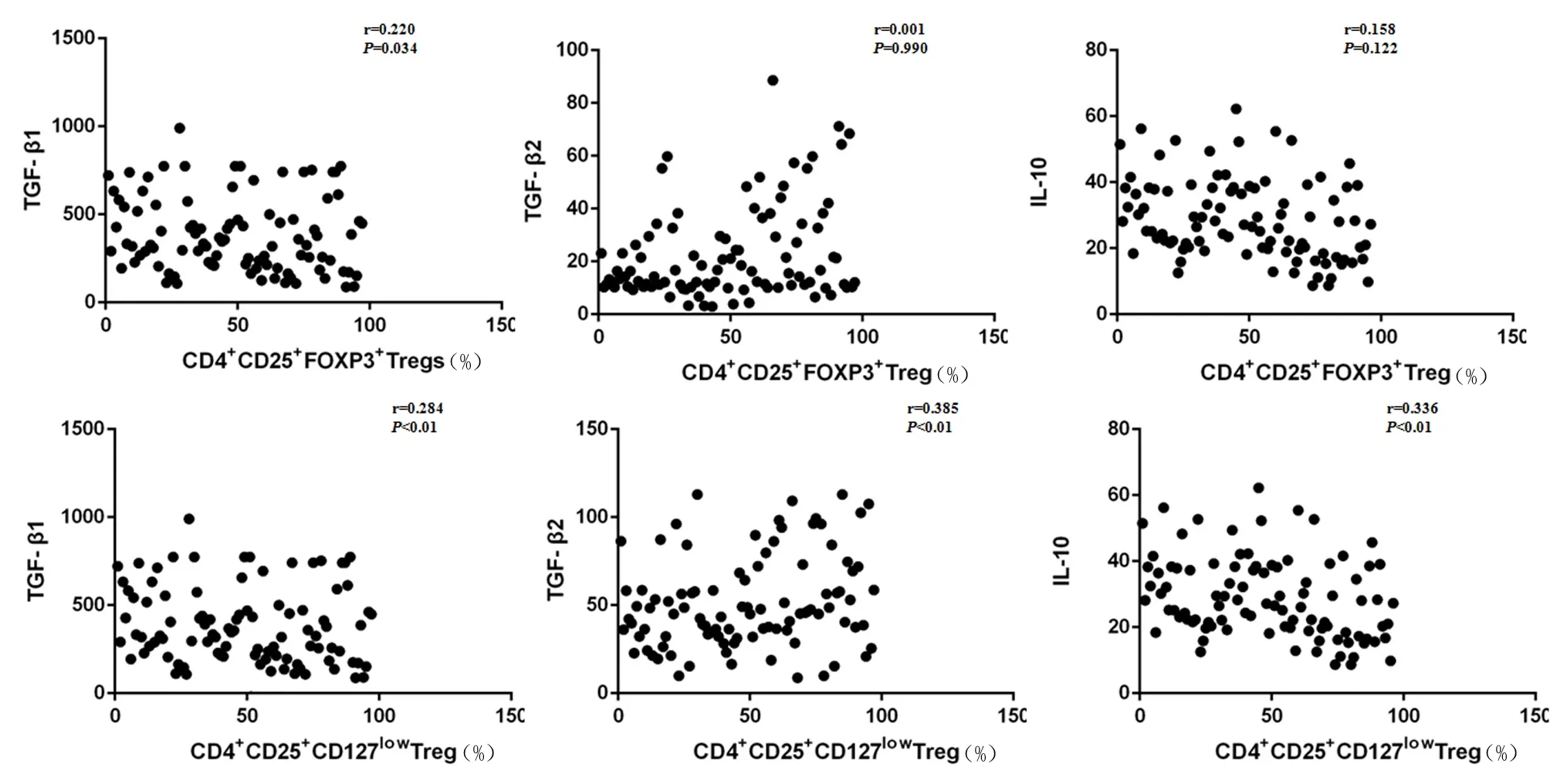
图1 妇科肿瘤组CD4+CD25+Foxp3+Treg、CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率与血清TGF-β1、TGF-β2、IL-10含量相关性
Figure 1 The correlation between CD4+CD25+Foxp3+,CD4+CD25+CD127lowregulatory T cells accounted to the proportion of CD4+T cells and the content of TGF-β1,TGF-β2 and IL-10 in serum with gynecology cancer group
3 讨 论
Treg细胞群包括CD4+Treg、CD8+Treg、自然杀伤 T 细胞( natural killer T cell, NKT)和双阴性Treg(double negative Treg,DN Treg)细胞等4大类。Treg在防止自身免疫的过程中起着至关重要的作用,其异常表达可导致肿瘤产生免疫耐受和免疫逃逸[4]。CD4+CD25+Treg是目前研究的热点,它是一类具有独特免疫调节功能的T淋巴细胞亚群,持续高表达于人类胸腺、淋巴组织及外周血,其分子标志主要包括:CD3、CD4、CD25、CD127、Foxp3、GITR(glucocorticoid-induced TNF receptor)、CTLA-4(cytotoxic T lymphocyte-associated antigen 4)[5]等,其中CD127、Foxp3是特异性最高的2个分子标志[6-8],叉头状螺旋转录因子-3(Forkhead /winged-helix transcription factorboxP3)(Foxp3)是forkhead/winged-helix家族中的一员,是在Treg细胞上特异表达的转录因子,Foxp3直接通过与核转录因子的交互作用激活T细胞,这种交互作用需要与体内IL-2因子结合,来调控T细胞相关的标记并抑制细胞因子的产生[9];CD127是IL-7 受体α链,在 T 细胞前体、B 细胞前体、成熟T细胞、成熟单核细胞、其他一些淋系和髓系细胞上表达[10]。有研究发现,在CD4+CD25+Treg纯化的细胞中Foxp3的表达与CD127低表达相关,通过CD4+CD127low纯化出CD4+CD25+T细胞与Foxp3纯化的CD4+CD25+T细胞数量相似,故本研究采用了这2种分子标志对Treg进行筛选。
周利敏等[11]的研究发现,宫颈癌患者外周血及肿瘤组织中CD4+CD25+CD127lowTreg阳性表达数量按照对照组、CIN分组、宫颈癌组顺序递增,且随着病变加重,表达率明显增加。提示CD4+CD25+CD127lowTreg细胞阻止了机体对自身同源性肿瘤的细胞免疫,为宫颈癌的发生和发展提供了逃避免疫监视的优势环境。有研究结果显示,卵巢癌患者CD4+CD25+CD127lowT细胞/CD4+T细胞比例明显高于正常对照组,这表明在卵巢癌进展过程中,CD4+CD25+T细胞可能起着重要作用。姜艳丽等[12]研究发现,肿瘤患者转录因子Foxp3表达与正常组相比均显著增高,可以作为一种良好的标记物辅助评估 CD4+CD25+Treg的比例和肿瘤的免疫功能。在乳腺癌、卵巢癌、肺癌等实体肿瘤和血液恶性肿瘤患者外周血、肿瘤局部微环境中,Treg比例增高,且数量与肿瘤进展程度和预后呈负相关,而去除Treg或封闭其抑制功能可使肿瘤免疫恢复[13]。本研究结果显示,妇科肿瘤组与对照组相比,T淋巴细胞亚群比例差异无统计学意义,与侯友翔等[14]研究结果相似;妇科肿瘤外周血中CD4+CD25+Foxp3+Treg占CD4+T细胞的比率、CD4+CD25+CD127lowTreg占CD4+T细胞的比率明显增高于对照组,且手术1个月后、化疗4个周期后比值明显下降,差异有统计学意义,与上述研究结果相符。
Treg细胞通过多种不同的方式发挥免疫抑制功能,维持机体免疫耐受:①释放GF-β、IL-10和IL-35等免疫抑制性细胞因子;②通过穿孔素途径及颗粒酶来杀伤其他细胞;③通过细胞毒 T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4) 间接影响树突状细胞的功能,从而影响其他T细胞的激活。大量研究数据表明,肿瘤微环境中,TGF-β、IL-6、IL-10、血管生成素、前列腺素E2均是其免疫抑制因子中的重要因子,其中TGF-β可由各种不同的肿瘤细胞产生,IL-10被认为是主要的免疫抑制因素,是抑制TH1免疫反应和T细胞细胞毒性反应的关键[15]。本研究结果显示,妇科肿瘤组血清中TGF-β1、IL-10的含量明显高于对照组, TGF-β2含量显示低于对照组,差异有统计学意义。TGF-β2含量降低可能受宫颈癌患者感染人类乳头瘤病毒(human papillomavirus,HPV)影响。据文献报道,HPV感染时可产生E6、E7 2种蛋白质[16],其可抑制TGF-β2的产生,而卵巢癌和子宫内膜癌与TGF-β2的关系尚有待进一步研究。TGF-β可以使活化的CD4+CD25+T细胞转化为表达Foxp3的Treg,IL-2、IL-10、TGF-β、血管内皮生长因子和环氧合酶2可直接或间接参与Treg的诱导与转化,使肿瘤微环境中Treg数量增多[17]。本研究结果显示,手术后、化疗后Treg与TGF-β、IL-10含量均下降,可能由于手术及化疗导致肿瘤及其微环境被破坏,进而抑制Treg与TGF-β、IL-10的产生。本研究中,妇科肿瘤组CD4+CD25+Foxp3+Treg占CD4+T淋巴细胞比率与TGF-β1含量之间存在正相关;CD4+CD25+CD127lowTreg占CD4+T淋巴细胞比率与血清TGF-β1、TGF-β2、IL-10含量之间均存在正相关。与张丽平等[18]研究结果相一致。表明Treg可能通过引起TGF-β、IL-10上调而发挥免疫抑制的作用。
总之,Treg对妇科肿瘤的进展有着十分重要的作用,其通过引起TGF-β、IL-10等因子的变化来进行免疫调控,导致妇科肿瘤产生免疫耐受,手术及化疗可降低其含量[19-24]。这一研究结论对妇科肿瘤的治疗具有重要的临床应用价值。
[1] Feng Y,van der Veeken J,Shugay M,et al. A mechanism for expansion of regulatory T-cell repertoire and its role in self-tolerance[J]. Nature,2015,528(7580):132-136.
[2] Joshi NS,Akama-Garren EH,Lu Y,et al. Regulatory T Cells in Tumor-Associated Tertiary Lymphoid Structures Suppress Anti-tumor T Cell Responses[J]. Immunity,2015,43(3):579-590.
[3] 解皓,李海涛,赵彩彦.CD4+CD25+FOXp3+调节性T细胞参与肿瘤免疫逃逸的研究进展[J].临床荟萃,2009,24(24):2177-2180.
[4] Hossain DM,Panda AK,Chakrabarty S,et al. MEK inhibition prevents tumour-shed transforming growth factor-β-induced T-regulatory cell augmentation in tumour milieu[J]. Immunology,2015,144(4):561-573.
[5] 谷伟伟,叶韵斌.调节性T细胞与肿瘤相互作用机制的研究进展[J].医学综述,2012,18(5):680-684.
[6] Oleinika K,Nibbs RJ,Graham GJ,et al. Suppression,subversion and escape:the role of regulatory T cells in cancer progression[J]. Clin Exp Immunol,2013,171(1):36-45.
[7] 吴德南,庄建良,许荣誉,等.肿瘤免疫中Treg细胞与趋化因子及受体的研究进展[J]. 中国肿瘤外科杂志,2014,6(2):112-115.
[8] 唐晓磊,章晓联.Treg细胞与临床疾病相关性研究进展[J].医学新知杂志,2012,22(6):441-447.
[9] Whiteside TL. Induced regulatory T cells in inhibitory microenvironments created by cancer[J]. Expert Opin Biol Ther,2014,14(10):1411-1425.
[10] 丁爱萍,张淑兰.调节性 T 细胞在妇科肿瘤发生发展中的作用及其研究进展[J].中国实用妇科与产科杂志,2012,28(9):718-720.
[11] 周利敏,李红英,张敦兰,等.调节性T细胞在宫颈癌外周血及肿瘤组织中的检测及其相关性研究[J].海南医学院学报,2014,20(7):899-901.
[12] 姜艳丽,刘磊,王雪野,等.外周血CD4+CD25+CDl27lowTreg调节性T细胞在恶性肿瘤患者免疫功能评估中的作用[J].中国实验诊断学,2015,19(7):1117-1120.
[13] 卢永刚,刘凌云,何沙.CD4+CD25+调节性T细胞与肿瘤免疫的研究进展[J].中国现代普通外科进展,2013,16(2):134-137.
[14] 侯友翔,张园,钟薇,等.宫颈癌人乳头瘤病毒感染与CD4+CD25+Foxp3+调节性T细胞的相关性研究[J].新疆医科大学学报,2013,36(12):1749-1752.
[15] Dennis KL,Blatner NR,Gounari F,et al. Current status of interleukin-10 and regulatory T-cells in cancer[J]. Curr Opin Oncol,2013,25(6):637-645.
[16] Murvai M,Borbély AA,Kónya J,et al. Effect of human papillomavirus type 16 E6 and E7 oncogenes on the activity of the transforming growth factor-β2(TGF-β2) promoter[J]. Arch Virol,2004,149(12):2379-2392.
[17] 强光亮,郭永庆.调节性T细胞参与肿瘤免疫的研究进展[J].国际免疫学杂志,2014,37(4):280-285.
[18] 张丽平,周智锋,李洁羽,等.调节性T细胞对NK细胞体外杀伤妇科恶性肿瘤细胞的影响[J].免疫学杂志,2010,26(1):58-62.
[19] Ohkura N,Hamaguchi M,Morikawa H,et al. T cell receptor stimulation-induced epigenetic changes and Foxp3 expression are independent and complementary events required for Treg cell development[J]. Immunity,2012,37(5):785-799.
[20] Liu HY,Ma LP,Wei J,et al. Analysis of CD4(+)CD25(+)CD127(low/-) Treg cells in mice[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi,2012,20(6):1469-1473.
[21] Niri NM,Hadjati J,Sadat M,et al. Inducing Humoral Immune Responses Against Regulatory T Cells by Foxp3-Fc(IgG)Fusion Protein[J]. Monoclon Antib Immunodiagn Immunother,2015,34(6):381-385.
[22] Nie J,Li YY,Zheng SG,et al. FOXP3(+) Treg Cells and Gender Bias in Autoimmune Diseases[J]. Front Immunol,2015,6:493.
[23] Barbi J,Pardoll D,Pan F.Treg functional stability and its responsiveness to the microenvironment[J]. Immunol Rev,2014,259(1):115-139.
[24] Walker LS. Treg and CTLA-4:two intertwining pathways to immune tolerance[J]. J Autoimmun,2013,45:49-57.
(本文编辑:赵丽洁)
Study on the variation and correlation of regulatory T cells in peripheral blood and serum TGF-β and IL-10 in patients with gynecological tumor
YU Dan-jun1, FAN Jing2, HU Yue1, JIANG Li1, CAO Li-yan1, MEN Shuai1
(1.Department of Clinical Laboratory, the First Hospital of Qinhuangdao City, Hebei Province, Qinhuangdao 066000, China; 2.Department of Clinical Laboratory, the Fourth Hospital of Qinhuangdao City, Hebei Province, Qinhuangdao 066000, China)
Objective To explore the expression of regulatory T cells(Treg) and T cell subgroup in peripheral blood and the variation and correlation of transforming growth factor-β(TGF-β) and interleukin-10(IL-10) cytokines in serum in patients with gynecological cancer. Methods Ninety-seven cases(32 cases with cervical cancer, 35 cases with endometrial cancer, 30 cases with ovarian cancer) of patients with gynecological cancer and 30 cases of healthy controls were obtained as research objects. Flow cytometry was used to detect CD4+CD25+Foxp3+and CD4+CD25+CD127lowregulatory T cells and the distribution of T cell subgroup in peripheral blood of all the subjects. ELISA was used to detect the content of TGF-β1、TGF-β2 and IL-10 cytokines in serum. Results Compared with healthy control group, CD4+CD25+Foxp3+and CD4+CD25+CD127lowregulatory T cells accounted for the proportion of CD4+T cells expression in patients with gynecological cancer group in peripheral blood were significantly higher(P<0.05). There was no statistical significant difference in T cell subgroup proportion(P>0.05). The contents of TGF-β1and IL-10 in serum were significantly higher(P<0.05), the content of TGF-β2 was significantly lower(P<0.05). The proportion of CD4+CD25+Foxp3+and CD4+CD25+CD127lowregulatory T cells accounted for CD4+T cells in peripheral blood and TGF-β1、TGF-β2 and IL-10 in serum expression in patients with gynecological cancer group were significantly lower in one month after the operation, and after four cycles of chemotherapy(P<0.05) , CD4+、CD8+T cells and CD4+/CD8+in one month after the operation、CD4+、CD19+T cells after four cycles of chemotherapy were significantly lower than that before the operation(P<0.05). There was positive correlation between CD4+CD25+Foxp3+Treg and TGF-β1(rs=0.220,P=0.034). There were positive correlation between CD4+CD25+CD127lowregulatory T cells and the content of TGF-β1、TGF-β2 and IL-10(rs=0.284, 0.385, 0.336,P<0.01). Conclusion The immune tolerance mechanism in patients with gynecology cancer might be related to the ratio of CD4+CD25+Foxp3+Treg and CD4+CD25+CD127lowTreg accounted to the proportion of CD4+T cells, and to the content of TGF-β1、TGF-β2 and IL-10 cytokines.
genital neoplasms, female; T-lymphocytes, regulatory; flow cytometry
2016-08-12;
2016-09-29
秦皇岛市科学技术研究与发展计划(20141A219)
于丹军(1973-),男,辽宁建昌人,河北省秦皇岛市
R737.3
A
1007-3205(2016)11-1307-06
10.3969/j.issn.1007-3205.2016.11.017
第一医院副主任技师,医学硕士,从事肿瘤免疫学研究。
