多种呼吸道病原体的多重实时荧光定量PCR检测方法的建立及应用
2016-12-15邸红芹杨永辉康丽菲安晓颖李晓霞
邸红芹,杨永辉,康丽菲,安晓颖,李晓霞,张 辉
(河北省胸科医院检验科,河北 石家庄 050041)
·论 著·
多种呼吸道病原体的多重实时荧光定量PCR检测方法的建立及应用
邸红芹,杨永辉,康丽菲,安晓颖,李晓霞,张 辉*
(河北省胸科医院检验科,河北 石家庄 050041)
目的建立多种呼吸道病原体的多重实时荧光定量聚合酶链反应(multiplex real-time-PCR, MRT-PCR)检测方法。方法根据生物信息学分析结果选定各种呼吸道病原体的靶序列,建立MRT-PCR检测体系。构建质粒标准品,检测建立体系的敏感度、特异度和重复性,并运用MRT-PCR和单荧光定量PCR检测临床样本进行对比分析。结果成功建立了多种呼吸道病原体的MRT-PCR检测体系;该方法特异度较好,最低检测限为10 copies/μL,重复性良好,变异系数为0.99%~2.50%,530例临床样本中,MRT-PCR检测的阳性率为59.2%(314/530),单荧光定量PCR检测的阳性率为61.1%(324/530),阳性检出率差异不大。结论建立快速、敏感、特异、稳定的MRT-PCR检测体系,具有良好的临床应用前景。
呼吸道感染;聚合酶链反应;敏感性与特异性
呼吸道感染是全球范围内的常见病和多发病,严重威胁着人类健康和生活质量。呼吸道病原体来源极为复杂,包括病毒、细菌、支原体、衣原体、军团菌等微生物,且传播迅速,临床表现相似,患者均表现为发热和呼吸道感染症状,单从临床表现很难区分感染病原体,以致某些患者病情加重错过最佳治疗时机[1]。传统的检测方法有病原体分离培养法和免疫检测法,由于其操作过程繁琐、敏感度低以及检测时间较长,无法满足快速诊断的要求[2]。近年来,随着分子生物学检测方法的介入,给临床疾病诊断和治疗提供了很大的帮助。荧光定量PCR技术具有高敏感度、高特异度且操作快速简便等优点,在呼吸道病原体诊断中有广阔的应用前景。然而,传统的荧光定量PCR每次只能扩增一种病原体核酸,要准确检测致病病原体费时费力,多重实时荧光定量聚合酶链反应(multiplex real-time-PCR, MRT-PCR)可以有效弥补这一缺陷,并且成本低廉。本研究建立并评价可同时检测多种呼吸道病原体的MRT-PCR,旨在实现呼吸道病原体的快速、特异检测,报告如下。
1 资料与方法
1.1 标本来源 选取2015年6月—2016年1月在我院就诊的呼吸道感染患者530例。呼吸道病原体来源于疾病控制中心以及我院检验科的分离培养,包括甲型流行性感冒病毒(influenza A,IFA)、乙型流感病毒(influenza B,IFB)、副流行性感昌病毒(parainfluenza,PIV)Ⅰ~Ⅳ型、呼吸道合胞病毒(respiratory syncytial virus,RSV)、冠状病毒(229E、OC43和NL63)、腺病毒(adenovirus,ADV)、肺炎支原体(mycoplasma pneumonia,MP)、肺炎衣原体(chlamydia pneumonia,CP)、铜绿假单胞菌(pseudomonas aeruginosa, PAE)、肺炎链球菌(streptococcus pneumoniae,SPN)、军团菌(legionella pneumophila,LPN)、金黄色葡萄球菌(staphylococcus aureus,SA)、肺炎克雷伯菌(klebsiella pneumoniae,KPN)、结核分枝杆菌(mycobacterium tuberculosis,MTB)、流感嗜血杆菌(haemophilus influenzae,HIN)。整个过程完成按照国家传染性病原体的安全操作规范进行。
1.2 呼吸道病原体核酸提取 根据DNA(QIAamp DNA Mini Kit,Qiagen,Germany)和RNA(QiaAmp Viral RNA Mini Kit,Qiagen,Germany)试剂盒说明书,提取呼吸道病原体DNA或RNA,并置于-80 ℃保存备用。
1.3 质粒标准品构建 从美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)下载各呼吸道病原体及亚型的全基因序列,采用MEGA 4.0 同源比对,进化树分析,筛选保守序列,采用PCR和TA克隆构建保守序列标准品。庆用核酸定量仪(Eppendorf)测定质粒浓度并根据公式计算其拷贝数,通过公式计算质粒原始拷贝数:拷贝数(copies/μL)=6.02×1 023×质粒浓度(ng/μL)/(碱基数×660),再用无核酸酶水(RNA-free ddH2O)按10倍系列稀释(106~10 copies/μL),作为各病原体的标准品,用于评价MRT-PCR检测体系。
1.4 呼吸道病原体检测引物及探针 根据各病原体的保守序列,首先采用Beacon designer 8.0设计MRT-PCR引物及探针,然后使用AutoDimer 和primer 5等软件分析引物之间的干扰、发卡结构和二聚体,最后在NCBI数据库进行同源性分析。各探针引物序列见表1,均送往上海生工生物合成。

表1 各种病原体检测引物及探针

表1 (续)
1.5 呼吸道病原体MRT-PCR检测体系建立 每一份样本进行7组MRT-PCR反应(A~G,表1),每组反应检测3种病原体,采用Taqman Fast Virus One-step Master Mix(Invitrogen)作为MRT-PCR的反应液(13.5 μL),其中含有预混的Taq DNA聚合酶、反转录酶、dNTP及RNase抑制剂;然后向反应中分别加入1.5 μL各引物/探针(终浓度为0.4 μmol/L)以及10 μL各种病原体样本或阴性对照(RNA-free ddH2O),最后将各反应管按以下程序在合适的实时荧光PCR仪(如Roche 480)上进行PCR反应:50 ℃,15 min(逆转录反应);95 ℃,10 min(热启动);95 ℃,15 s(变性),60 ℃,45 s(退火/延伸, 采集荧光信号),进行35个循环。使用荧光定量PCR仪自带软件进行结果分析,所有阴性样本的信号值都应低于阈值;环阈值(cycle threshold,Ct)值>35,样本低于检测阈值线,报告为阴性;Ct值<35,报告为阳性。
1.6 临床样本检测 采用MRT-PCR和单荧光定量PCR 2种方法对收集的临床样本进行检测,对检测结果进行统计,分析MRT-PCR和单荧光定量PCR阳性率,评估MRT-PCR临床检测效果。
2 结 果
2.1 MRT-PCR体系敏感度分析 为了方便评价MRT-PCR检测呼吸道病原体,以A组为研究对象,进行病原体检测并分析。将IFA、IFB和PIV1的梯度稀释标准品(106~1 copies/μL)1∶1∶1混合,作为A组敏感度标准品,同时单荧光定量PCR体系作为阳性对照,阴性对照为水。结果显示,A组PCR体系各通道(FAM、VIC和ROX)的扩增曲线都呈“S”形,随着质粒浓度的梯度递减,扩增的Ct值与其呈正相关关系,所建立的MRT-PCR体系的检测敏感度(最低检测限)为10 copies/μL,与单荧光定量PCR体系的敏感度相比差异不大(图1)。其他各组(F~G组)MRT-PCR体系各通道的扩增曲线“S”形,检测极限均达到10 copies/μL,各反应之间引物探针的交叉干扰较小,能够同时扩增不同病原体的靶序列,故能满足单一体系中多种病原体检测的要求。
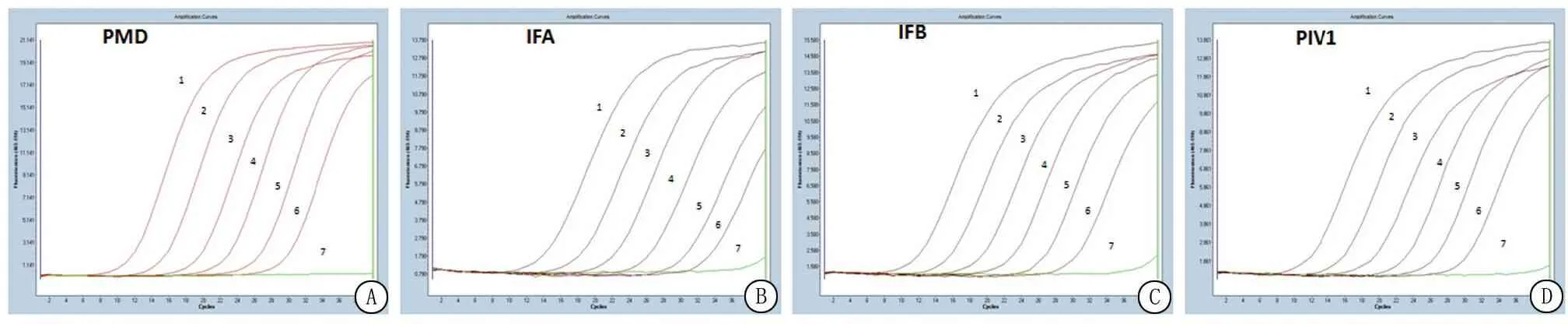
图1 MRT-PCR体系敏感度检测
A.单荧光定量PCR体系;B. IFA扩增曲线;C. IFB扩增曲线;D. PIV1扩增曲线
图中“1~7”代表106~1 copies/μL 质粒标准品
Figure 1 Sensitivity to detect of MRT-PCR system
2.2 MRT-PCR体系特异度分析 以MRT-PCR体系的A组为研究对象,向反应体系中分别加入浓度为105 copies/μL的18种呼吸道病原体(IFA、IFB和PIV1除外)质粒标准品。结果显示A组体系各通道均无扩增,其他各组的结果都与A组一致,表明各组引物探针的特异度良好。见表2。
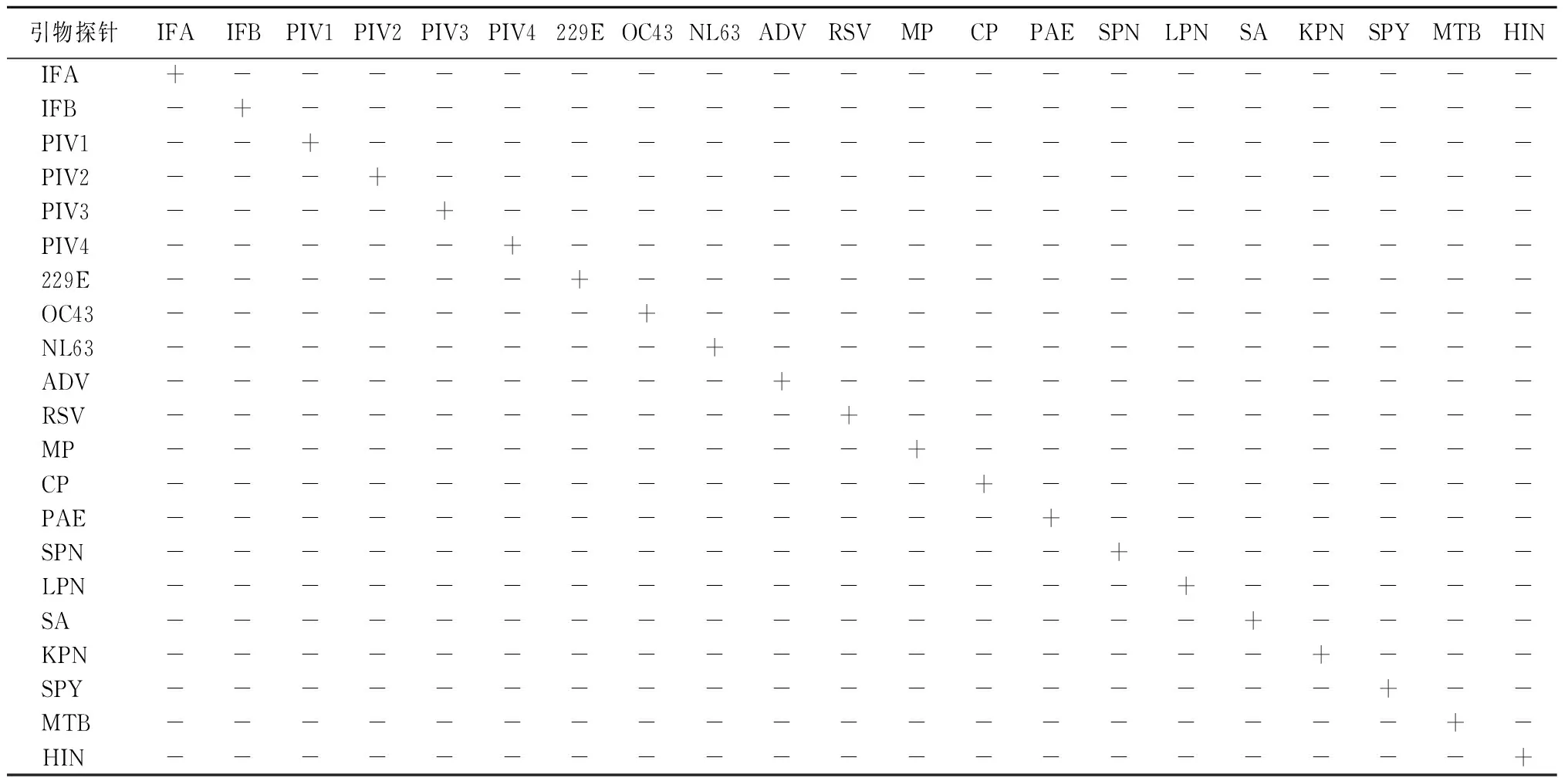
表2 呼吸道病原体MRT-PCR检测体系引物和探针特异度分析
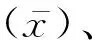
表3 呼吸道病原体MRT-PCR检测体系重复性分析
2.4 临床样本检测 对我院收集的530例呼吸道感染患者标本进行MRT-PCR检测,同时进行单重实时荧光定量PCR分析。结果显示,530例标本中,MRT-PCR检测的阳性率为59.2%(314/530),单重荧光定量PCR检测的阳性率为61.1%(324/530),阳性检出率差异不大,同时各类呼吸道病原体均检测到阳性。
3 讨 论
呼吸道感染是临床最常见的疾病,呼吸道病原体的来源非常复杂,且临床表现又极为相似,给临床医师的诊断带来极大的困难。因此,快速准确鉴定呼吸道病原体是临床治疗合理用药的依据。传统的检测方法如分离培养和血清学实验,耗时长且检测效率低。随着分子生物学的发展,多种新的诊断方法被用于呼吸道病原体的检测,如反转录酶-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)[3-5]、荧光定量PCR[6-8]、巢式PCR、恒温扩增技术[9-11]以及基因芯片[12-13]等。Kim等[14]采用巢式PCR和荧光定量PCR对199例石蜡包埋组织标本(包括137例结核分枝杆菌标本、17例非结核分枝杆菌标本以及45例其他疾病标本)中结核分枝杆菌及非结核分枝杆菌特异度基因进行检测,评估其检测组织标本的可行性,结果显示在结核分枝杆菌及非结核分枝杆菌标本中,抗酸染色的敏感度为34.3%和17.6%,巢式PCR检测的敏感度为70.1%和52.9%,荧光定量PCR的检测敏感度为70.8%和35.3%,2种PCR的检测敏感度要显著高于抗酸染色,且都具有很高的特异度。罗思思等[15]基于环介导等温扩增(loop-mediated isothermal amplification, LAMP)技术建立了禽流感病毒H7亚型和N9亚型的快速检测方法,结果显示该体系在63 ℃反应1 h就能特异地检测禽流感病毒H7亚型和N9亚型,对其他亚型禽流感均无扩增,且最低检测限为10 copies/μL。目前,基于扩增子拯救PCR技术(Arm-PCR)的iCubate检测系统已经上市(芯片技术),该技术克服了多个靶点扩增条件不兼容,并创新性设计了一次性全封闭卡盒,以及配套的卡盒处理仪、阅读仪及控制软件。iCubate全自动多重微生物核酸检测系统具有多重、自动、封闭、快速、随机、敏感等技术特点,适合应用于疾病预防控制机构、出入境检验检疫部门,用于开展病原体筛查、院内感染监测、环境监测、检验检疫工作、食品卫生检验工作。
本研究采用MRT-PCR体系快速、高通量地检测各种呼吸道病原体,经一系列方法学验证,MRT-PCR体系检测敏感度良好(最低检测阈值为10 copies/μL),与单荧光定量PCR相比无显著差异。这与Weltia等[16]的报道一致。本研究MRT-PCR反应体系特异度好,各引物探针无交叉反应,能够特异地检测靶序列,且MRT-PCR体系重复性分析得出CV为0.99%~2.50%,均<5%,重复性良好。向蕾等[17]根据4种呼吸道病毒(人腺病毒、人博卡病毒、人偏肺病毒及热呼吸道合胞体病毒)的保守序列建立MRT-PCR快速检测体系,体系优化后,检测敏感度为10 copies/μL,对临床样本检测的特异度为100%,表明MRT-PCR体系敏感、特异且重复性良好,可用于临床多种呼吸道病原体的检测。另外,本研究530例临床样本中,MRT-PCR检测的阳性率为59.2%(314/530),单荧光定量PCR检测的阳性率为61.1%(324/530),MRT-PCR与单荧光定量PCR的检测阳性检出率相比差异不大,同时各种病原体均检测到阳性。
总之,建立呼吸道病原体的MRT-PCR检测体系是十分必要的,具有良好的临床应用前景。
[1] Nair H,Nokes DJ,Gessner BD,et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis[J]. Lancet,2010,375(9725):1545-1555.
[2] 陈华根,刘小花,许颖.常见呼吸道病原体的实验室检测[J].检验医学与临床,2014,11(20):2920-2921.
[3] Beck ET,Henrickson KJ. Molecular diagnosis of respiratory viruses[J]. Future Microbiol,2010,5(6):901-916.
[4] 肖丽霞,刘涛,李健雄,等.双重荧光定量RT-PCR快速检测流感病毒H1、H3亚型的研究[J].热带医学杂志,2012,12(1):30-33.
[5] 李青凤,吴永亮,史孟婧,等.实时荧光定量PCR法在急性呼吸道传染病病原筛查中的应用[J].医学动物防制,2016,32(4):462-464.
[6] 李锐成,刘昕阳,阎琳,等.实时荧光定量聚合酶链反应技术在结核性脑膜炎中的诊断价值[J].临床荟萃,2014,29(1):31-34.
[7] 孙茜,吕志堂,孙雅堃.应用荧光定量聚合酶链反应技术快速筛查重症监护室耐甲氧西林金黄色葡萄球菌定植者[J].河北医科大学学报,2015,36(3):309-312.
[8] 王玉月,史伟峰,季云.多重实时荧光定量PCR对9种常见呼吸道病原体检测[J].标记免疫分析与临床,2015,22(11):1160-1164.
[9] Mori Y,Kanda H,Notomi T. Loop-mediated isothermal amplification (LAMP):recent progress in research and development[J]. J Infect Chemother,2013,19(3):404-411.
[10] 杨海鸥,叶星晨,傅启华.依赖核酸序列扩增技术检测呼吸道合胞病毒方法的建立[J].检验医学,2016,31(3):168-172.
[11] 刘毅,黄曙海,谭慧媚,等.环介导等温扩增技术检测肺结核患者痰标本中结核分枝杆菌[J].临床检验杂志,2014,30(1):24-26.
[12] Cannon GA, Carr MJ,Yandle Z,et al. A low density oligonucleotide microarray for the detection of viral and atypical bacterial respiratory pathogens[J]. J Virol Methods,2010,163(1):17-24.
[13] 陈炎添,熊燕,苏雪棠,等.呼吸重症监护病房多重耐药鲍曼不动杆菌耐药基因检测及耐药性分析[J].临床荟萃,2012,27(19):1684-1686,1690.
[14] Kim YN,Kim KM,Choi HN,et al. Chinical usefulness of PCR for differential diagnosis of tuberculsis and nontuberculsis Mycobacterial infection in paarffin-embedded lung tissues [J]. J Mol Diagn,2015,17(5):597-604.
[15] 罗思思,谢芝勋,谢丽基,等.H7亚型和N9亚型禽流感病毒RT-LAMP可视化检测方法建立[J].畜牧兽医学报,2015,46(7):1176-1183.
[16] Weltia M,Jatona K,Altweggb M,et al. Development of a multiplex real-time quantitative PCR assay to detect Chlamydia pneumoniae,Legionella pneumophila and Mycoplasma pneumoniae in respiratory tract secretions[J]. Diagn Microbiol and Infect Dis,2003,45(2):85-95.
[17] 向蕾,陈仕菊,王昕,等.实时荧光定量RT-PCR快速检测四种呼吸道病毒的研究[J].热带医学杂志,2014,14(4):461-465.
(本文编辑:许卓文)
Establishment and application of multiplex real-time fluorescence quantitative PCR assay for detecting various respiratory pathogens
DI Hong-qin, YANG Yong-hui, KANG Li-fei, AN Xiao-ying, LI Xiao-xia, ZHANG Hui*
(Department of Clinical Laboratory, the Chest Hospital of Heibei Province,Shijiazhuang 050041, China)
Objective To develop multiplex real-time fluorescence quantitative PCR(MRT-PCR) assay for detecting various respiratory pathogens. Methods MRT-PCR assay was established with kinds of respiratory pathogenic genes, selected based on their relevant
trains by bioinformatics analysis, as target genes. Standard products and quality control samples were built to testing and analysising the sensitivity, specificity and reproducibility of this system. Clinical samples were used to evaluating MRT-PCR and single fluorescence quantitative PCR. Results The MRT-PCR detection system were successfully established which showed fine specificity. The detection limit of the assays was 10 copies/μL. Coefficient of variation was from 0.99% to 2.50%, which conducted to assess the reproducibility of the assays. Among 530 clinical specimens, the detectable rates of MRT-PCR and single fluorescence quantitative PCR were 59.2%(314/530) and 61.1%(324/530), respectively. Conclusion We developed a fast, specific, sensitive and stable MRT-PCR detection assay, which possessed good clinical application prospect.
espiratory tract infections; polymerase chain reaction; sensitivity and specificity
2016-09-23;
2016-10-18
河北省医学科学研究重点课题(20150147)
邸红芹(1973-),女,河北深泽人,河北省胸科医院副主任检验师,医学硕士,从事临床检验学研究。
*通讯作者。E-mail:zhanghui_4081@sina.com
R517.6
A
1007-3205(2016)11-1302-05
10.3969/j.issn.1007-3205.2016.11.016
