管氏肿腿蜂寄生对黄粉甲硫氧还蛋白基因转录的影响
2016-12-15黄镜梅刘乃勇张祖兵朱家颖
黄镜梅 刘乃勇 张祖兵 杨 斌 朱家颖
(1. 西南林业大学云南省森林灾害预警与控制重点实验室,云南 昆明 650224;2. 云南省热带作物科学研究所,云南 景洪 666100)
管氏肿腿蜂寄生对黄粉甲硫氧还蛋白基因转录的影响
黄镜梅1刘乃勇1张祖兵2杨 斌1朱家颖1
(1. 西南林业大学云南省森林灾害预警与控制重点实验室,云南 昆明 650224;2. 云南省热带作物科学研究所,云南 景洪 666100)
硫氧还蛋白参与体内必要的抗氧化作用和氧化还原调控过程,在昆虫体内能维持稳定的氧化还原状态,为初步了解硫氧还蛋白在黄粉甲体内的作用以及管氏肿腿蜂寄生对该蛋白基因转录的影响,采用RACE技术,克隆获得黄粉甲硫氧还蛋白基因,并进行多序列比对及荧光定量PCR分析。结果表明:cDNA序列长531 bp,开放阅读框318 bp,其推导的氨基酸序列编码106个氨基酸,3′端非编码区序列为95 bp,5′端非编码区序列为119 bp;预测理论分子量为11.97 kDa,等电点为4.22,含有一个保守的氧化还原活性位点 CGPC。黄粉甲硫氧还蛋白基因编码的蛋白序列与其他昆虫的硫氧还蛋白相似性高于60%;硫氧还蛋白基因在黄粉甲各发育阶段中,在蛹期的表达水平最高,在成虫期表达水平最低,在蛹期时的脂肪体中高度表达。被管氏肿腿蜂寄生后,黄粉甲硫氧还蛋白基因转录水平明显受到上调诱导。
黄粉甲;硫氧还蛋白;基因克隆;序列分析;管氏肿腿蜂
硫氧还蛋白 (thioredoxin, Trx) 广泛地分布于从古生菌到哺乳动物中,蛋白质分子量在12 kDa左右,含有一个高度保守的催化活性位点,属于小分子还原酶家族成员[1]。它通过一对保守的半胱氨酸残基参与必要的抗氧化作用和氧化还原调控过程,对细胞增殖、抗氧化活性、DNA合成、调控基因表达和控制细胞调亡等有影响[1-3]。目前,关于硫氧还蛋白能维持昆虫体内稳定的氧化还原状态和抵抗逆境危害的研究已经有报道。如在黑腹果蝇 (Drosophilamelanogaster) 中证明了硫氧还蛋白-2基因的缺失能够促进其他抗氧化酶基因的表达[4]。在家蚕 (Bombyxmori) 中,硫氧还蛋白参与抵抗极端温度和病原微生物感染引起的氧化压力[5]。在中华蜜蜂 (Apisceranacerana) 中,硫氧还蛋白参与抗氧化防御[6-8]。但是,迄今有关硫氧还蛋白的研究仍较少。为此,本研究利用RACE技术,克隆获得黄粉甲 (Tenebriomolitor) 硫氧还蛋白基因的cDNA序列,并采用荧光定量PCR技术分析了硫氧还蛋白在黄粉甲不同发育间断、在蛹期不同组织中和被管氏肿腿蜂 (Sclerodermaguani) 寄生后的表达情况,为进一步深入研究昆虫中硫氧还蛋白家族基因的各种生理功能提供参考依据。
1 材料与方法
1.1 供试昆虫
管氏肿腿蜂为实验室饲养种群,参照Zhu等[9]的方法用黄粉甲蛹在人工气候培养箱中对管氏肿腿蜂进行繁殖,成蜂用蘸透20%蜂蜜水的脱脂棉球提供营养。在实验室自然光照和常温下,用饲料和洗净的蔬菜饲养黄粉甲幼虫。
1.2 主要试验试剂
总RNA提取试剂Trizol、RACE 试剂盒SMARTTMRACE cDNA amplification kit (Clontech) 和DNA Marker DL 2000购自宝生物工程 (大连) 有限公司,反转录试剂盒RevertAid First Strand cDNA Synthesis Kit和荧光定量试剂盒SYBR Primer Script RT-PCR Kit购自Thermo公司,其他试剂均为国产或分析纯。
1.3 总RNA 提取和cDNA合成
目的基因克隆的总RNA的提取:取2头黄粉甲蛹放入经DEPC处理过的Eppendorf 管中匀浆,加入1 mL Trizol,备用。
荧光定量总RNA的提取:参照Zhu等[10]的方法取黄粉甲不同发育阶段 (幼虫1~3龄、蛹和成虫)、黄粉甲蛹不同组织 (表皮、脂肪体和血淋巴) 及被管氏肿腿蜂寄生和未寄生 (6、12、24和48 h) 蛹,放入经DEPC处理过的Eppendorf 管中匀浆,加入1 mL Trizol,备用。其中1龄和2龄幼虫各4头,3龄幼虫2头,蛹2头,成虫2头;不同组织的样品则各取20头蛹解剖取样;寄生和未寄生的各时间段各取2头。
用Trizol试剂法分别提取上述收集好样品的总RNA,经紫外分光光度计检测纯度和浓度后,用SMARTTMRACE cDNA amplification kit (Clontech) 合成cDNA模板。
1.4 黄粉甲硫氧还蛋白基因克隆
根据实验室前期测定黄粉甲蛹cDNA文库获得的部分硫氧还蛋白基因片段序列,用Primer Premier 5.0软件设计5′ RACE和3′ RACE特异性引物 (5′-AGAAGTCGATCACGACGAGCTGATC-3′和5′-GAGTGCGAGGACATCGCCATGGA-3′),以合成的cDNA作为模板,参照RACE试剂盒说明书克隆该基因的5′端和3′端序列。PCR 反应条件为:94 ℃预变性2 min;94 ℃变性1 min,60 ℃退火30 s,72 ℃延伸1 min,39个循环;72 ℃延伸10 min。反应结束后,PCR产物经1%琼脂糖凝胶电泳进行验证,然后用凝胶回收试剂盒进行PCR产物纯化,再用TA克隆法,将目的片段与载体pGEM®-T-easy (Promega) 连接,重组质粒转化至大肠杆菌感受态细胞中,进行蓝白斑筛选,挑取阳性克隆,再通过双酶切进行重组质粒的验证后送至上海杰李生物技术有限公司进行测序。将获得的5′端和3′端序列用Lasergene 7.1软件拼接成全序列,并将基因序列提交到GenBank数据库中。
1.5 序列分析
序列同源比对和搜索采用Blastx,信号肽预测采用SignalP 4.1,多序列比对分析用ClustalX 1.83[11],理化性质的分析用ProtParam (http://web.expasy.org/protparam/) 软件,结构域的预测用Motif Scan (http://myhits.isb-sib.ch/cgi-bin/motif_scan)。
1.6 荧光定量PCR
根据克隆获得的黄粉甲硫氧还蛋白基因序列,设计特异性引物 (5′-GGTCACCCACATCAACGA-3′和5′-GATCATCTTGCAGGGGC-3′) 用于荧光定量PCR分析。以18S RNA基因作为内参 (5′-TTTCA-AATGTCTGCCTTATC-3′和5′-TGTGGTAGCCGTTT-CTC A-3′),以上述提取的总RNA合成的cDNA为模板,采用TakaRa公司的SYBR Premix Ex TaqTM试剂进行PCR,每个样品3个重复。PCR条件为:95 ℃预变性2 min;95 ℃变性20 s,60 ℃退火20 s,39个循环。荧光定量PCR结果采用2-ΔΔCT方法进行计算[12],数据用DPS软件进行统计分析,显著水平选择P< 0.05[13]。
2 结果与分析
2.1 基因克隆及序列分析
克隆得到黄粉甲硫氧还蛋白基因的cDNA序列为531 bp,ORF为318 bp,3′和5′端非编码序列分别为95 bp和119 bp,起始密码子位于119~121 bp,终止密码子位于434~436 bp (GenBank登录号为KU524899) (图1)。该基因编码106 aa,预测理论分子量为11.97 kDa,等电点为4.22,其N-末端发现了非常保守的氧化还原活性位点CGPC。SignalP分析结果表明,该蛋白质氨基酸序列中不存在信号肽序列。黄粉甲硫氧还蛋白基因编码的蛋白序列与其他昆虫的硫氧还蛋白具有较高的相似性,其中与赤拟谷盗 (Triboliumcastaneum)、亚洲玉米螟 (Ostriniafurnacalis)、家蚕 (Bombyxmori)、果蝇 (Drosophilagrimshawi) 的硫氧还蛋白一致性分别为95%、64%、63%和61% (图2)。

*表示终止子。
图1 黄粉甲硫氧还蛋白基因核酸序列及其推导的氨基酸序列
Fig.1 The nucleotide and deduced amino acid sequences of thioredoxin gene fromTenebriomolitor

家蚕Bombyxmori(ABJ97191);果蝇Drosophilagrimshawi(EDW03102);亚洲玉米螟Ostriniafurnacalis(KJ7440390);赤拟谷盗Triboliumcastaneum(EFA05230);黄粉甲Tenebriomolite(KU524899)。
图2 黄粉甲硫氧还蛋白和其它昆虫硫氧还蛋白序列比对
Fig.2 Multiple alignments of thioredoxin sequences ofTenebriomolitorand other insects
2.2 荧光定量PCR分析
黄粉甲硫氧还蛋白基因在蛹的脂肪体中高度表达 (P< 0.05),但是在表皮和血细胞中表达水平极低或几乎不表达 (图3)。在不同发育阶段中,该基因在蛹中的表达水平最高,在成虫中的表达水平最低,蛹中的表达量为成虫中的3.64倍 (P< 0.05) (图4)。被管氏肿腿蜂寄生6 h后,黄粉甲硫氧还蛋白基因的转录水平明显受到上调诱导。与对照相比,寄生6 h时,其表达量为对照的3.20倍 (P< 0.05);寄生48 h时,其表达量为对照的7.75倍 (P< 0.05) (图5)。
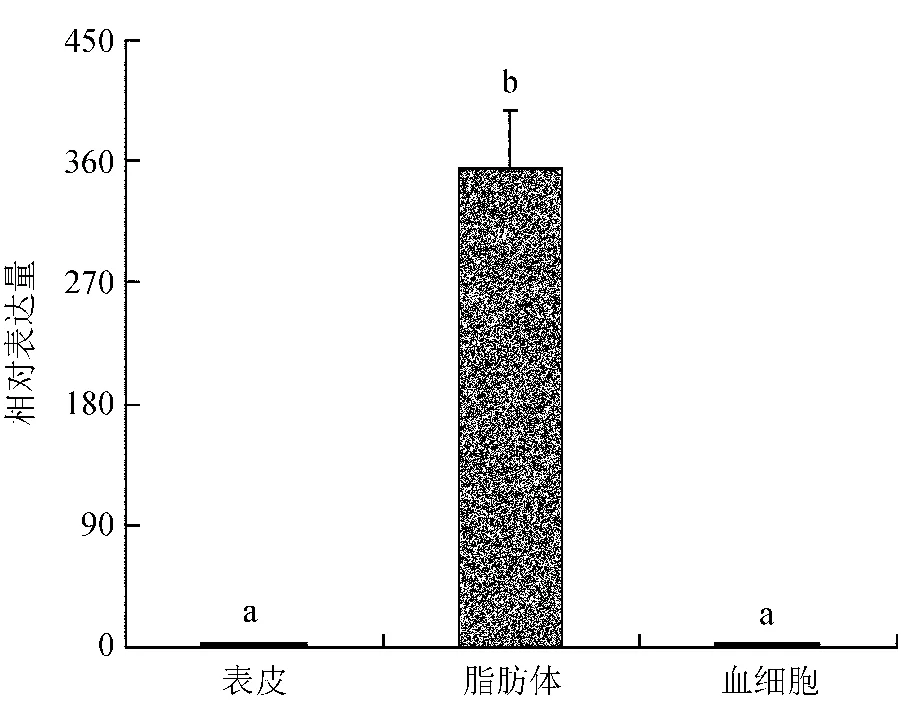
图3 黄粉甲硫氧还蛋白基因在蛹期不同组织中的表达量
Fig.3 Relative expression level of thioredoxin gene ofTenebriomolitorin different tissues of pupa

L1, 1龄幼虫first-instar larvae; L2, 2龄幼虫mid-instar larvae; L3, 3龄幼虫late-instar larvae; P, 蛹pupae; A, 成虫adult
图4 黄粉甲硫氧还蛋白基因在不同发育阶段的表达量
Fig.4 Relative expression level of thioredoxin gene ofTenebriomolitorat different developmental stages

图5 管氏肿腿蜂寄生后黄粉甲硫氧还蛋白基因的表达量
Fig.5 Relative expression level of thioredoxin gene ofTenebriomolitorafter parasitization bySclerodermaguani
3 结论与讨论
硫氧还蛋白是一类分布广泛的低分子量蛋白质,在进化上十分保守,均含有1个外露的由2个Cys残基组成而高度保守的活性中心 (CXXC)[14]。本研究克隆获得的黄粉甲硫氧还蛋白氨基酸中也含有1个保守的氧化还原活性催化位点 CGPC,表明其属于典型的硫氧还蛋白家族的成员。多序列比对结果显示黄粉甲硫氧还蛋白与同属于鞘翅目的赤拟谷盗氨基酸序列相似性高达95%,进一步证实了硫氧还蛋白在进化上的保守性。
在昆虫中,脂肪体是主要的代谢器官,对外源物质进行排毒并在抵抗氧化应激压力起着重要作用[15-16]。荧光定量表达分析结果表明,硫氧还蛋白在脂肪体中高度表达,家蚕硫氧还蛋白主要也是在脂肪体中表达[5],说明硫氧还蛋白在黄粉甲和家蚕脂肪体中发挥着抗氧化防御作用。黄粉虫发育过程中免疫活性具有明显的发育时期相关性[17],而荧光定量表达分析结果表明,硫氧还蛋白在黄粉甲不同发育阶段的表达量不同,在蛹中表达量最高,说明硫氧还蛋白在黄粉甲不同发育阶段所起的作用不一样。有研究发现,逆境因子能够导致生物体的氧化损伤[18-19],而细胞内过多的活性氧和氧化剂是由一系列抗氧化酶组成的初期防御体系来清除的[20]。已有研究表明,家蚕硫氧还蛋白基因的转录明显受到高低温和病原微生物等的诱导[5],中华蜜蜂硫氧还蛋白基因的表达也受到多种逆境条件的诱导[6-8]。昆虫在受到逆境压力时体内产生大量的活性氧,其接着作用于昆虫体内的一些生物大分子,硫氧还蛋白可能通过清除过量的活性氧来保护昆虫的正常生长发育[21-22]。荧光定量表达分析结果表明,在被寄生的黄粉甲蛹内硫氧还蛋白基因的表达量均明显高于未被寄生的,引起这种表达量变化的机理有可能是管氏肿腿蜂在寄生黄粉甲蛹时致使其氧化损伤,而硫氧还蛋白起了消弱此现象的作用,推测硫氧化蛋白参与了黄粉甲体内抗氧化防御,而具体的调控机制有待研究。
[1] Powis G, Montfort W R. Properties and biological activities of thioredoxins[J]. Annu Rev Pharmacol Toxicol, 2001, 41(1): 261-295.
[2] Wahl M C, Irmler A, Hecker B, et al. Comparative structural analysis of oxidized and reduced thioredoxin fromDrosophilamelanogaster[J]. J Mol Biol, 2005, 345(5): 1119-1130.
[3] Maulik N, Das D K. Emerging potential of thioredoxin and thioredoxin interacting proteins in various disease conditions[J]. Biochim Biophys Acta, 2008, 1780(11): 1368-1382.
[4] Tsuda M, Ootaka R, Ohkura C, et al. Loss of Trx-2 enhances oxidative stress-dependent phenotypes inDrosophilamelanogaster[J]. FEBS Lett, 2010, 584(15): 3398-3401.
[5] Kim Y J, Lee K S, Kim B Y, et al. Thioredoxin from the silkworm,Bombyxmori: cDNA sequence, expression, and functional characterization[J]. Comp Biochem Physiol, 2007, 147(3): 574-581.
[6] Lu W J, Kang M J, Liu X F, et al. Identification and antioxidant characterisation of thioredoxin-like1 fromApisceranacerana[J]. Apidologie, 2012, 43(3): 737-752.
[7] Yao P, Hao L, Wang F, et al. Molecular cloning, expression and antioxidant characterisation of a typical thioredoxin gene (AccTrx2) inApisceranacerana[J]. Gene, 2013, 527(1): 33-41.
[8] Yao P, Chen X, Yan Y, et al. Glutaredoxin 1, glutaredoxin 2, thioredoxin 1, and thioredoxin peroxidase 3 play important roles in antioxidant defense inApisceranacerana[J]. Free Radic Biol Med, 2014, 68(1): 335-346.
[9] Zhu J Y, Yang P, Zhang Z, et al. Transcriptomic immune response ofTenebriomolitorpupae to parasitization bySclerodermaguani[J]. PLoS One, 2013,8(1): e54411.
[10] Zhu J Y, Wu G X, Zhang Z. Upregulation of coleoptericin transcription inTenebriomolitorparasitized bySclerodermaguani[J]. J Asia-Pac Entomol, 2014, 17(3): 339-342.
[11] Thompson J D, Gibson T J, Plewniak F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Res, 1997, 25(24): 4876- 4882.
[12] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod[J]. Methods, 2001, 25(4): 402-408.[13] Tang Q Y, Zhang C X. Data Processing System (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research[J]. Insect Science, 2013, 20(2): 254-260.
[14] 张松斗, 张博宇, 申忠健, 等. 棉铃虫硫氧还蛋白类似基因HaTrx-like的分子鉴定和抗逆特征[J]. 应用昆虫学报, 2015, 52(3): 538-548.
[15] Arrese E L, Soulages J L. Insect fat body: energy, metabolism, and regulation[J]. Annual Review of Entomology, 2009, 55(1): 207-225.
[16] Enayati A A, Ranson H, Hemingway J. Insect glutathione transferases and insecticide resistance[J]. Insect Mol Biol, 2005, 14(1): 3-8.
[17] 吴必顺. 黄粉虫发育过程中免疫活性差异研究[D]. 苏州: 苏州大学, 2010.
[18] Lushchak V I. Environmentally induced oxidative stress in aquatic animals[J]. Aquat Toxicol, 2011, 101(1): 13-30.
[19] Kottuparambil S, Shin W, Brown M T, et al. UV-B affects photosynthesis, ROS production and motility of the freshwater flagellate,EuglenaagilisCarter[J]. Aquat Toxicol, 2012, 122/123(122/123): 206-213.
[20] Switala J, Loewen P C. Diversity of properties among catalases[J]. Arch Biochem Biophys, 2002, 401(2): 145-154.
[21] Grant C M. Role of the glutathione/glutaredoxin and thioredoxin systems in yeast growth and response to stress conditions[J]. Mol Microbiol, 2001, 39(3): 533-541.
[22] Radyuk S N, Klichko V I, Spinola B, et al. The peroxiredoxin gene family inDrosophilamelanogaster[J]. Free Radic Biol Med, 2001, 31(9): 1090-1100.
(责任编辑 张 坤)
Transcriptional Regulation ofTenebriomolitorThioredoxin Gene bySclerodermaguaniParasitization
Huang Jingmei1, Liu Naiyong1, Zhang Zubing2, Yang Bin1, Zhu Jiaying1
(1. Key Laboratory of Forest Disaster Warning and Control of Yunnan Province, College of Forestry, Southwest Forestry University,Kunming Yunnan 650224, China; 2. Institute of Tropical Crops Science Research of Yunnan Province, Jinghong Yunnan 666100, China)
Thioredoxin proteins maintain the stability of the redox state and are involved in essential antioxidation and oxidation reduction process regulation in insects. In order to reveal the functions of the thioredoxin proteins gene and its transcription regulated bySclerodermaguaniparasitization, this study cloned the full-length cDNA sequence of thioredoxin gene fromTenebriomolitorby rapid amplification of cDNA ends strategy. The full-length cDNA sequence of thioredoxin gene was 531 bp, and contained a 318 bp open reading frame encoding 106 amino acid residues, with 3′ and 5′ untranslated regions of 95 bp and 119 bp,respectively.Its predicted molecular weight and isoelectric point were 11.97 kDa and 4.22, respectively. Its deduced amino acid sequence contained a highly conserved CGPC active site at the N-terminus. Multiple sequence alignment analysis showed that thioredoxin ofT.molitorshared over 60% amino acid identities with those of other insects. qPCR analysis showed that thioredoxin gene was expressed at different developmental stages ofT.molitorwith the highest expression in the pupa and the lowest in the adult. This gene highly expressed in fat body of pupae. After 6 h parasitization byS.guani, the relative expression of thioredoxin gene was obviously up-regulated.
Tenebriomolitor, thioredoxin, gene cloning, sequence analysis,Sclerodermaguani

10. 11929/j. issn. 2095-1914. 2016. 06. 018
2016-04-19
国家自然科学基金项目 (31260449) 资助;云南省林学一级学科博士点建设项目 (林学学位授权学科项目经费) 资助;云南省中青年学术与技术带头人后备人才项目 (2013HB077) 资助;云南省高校森林有害生物科技创新团队项目资助。
朱家颖 (1984—),男,博士,教授。研究方向:昆虫生理生化与分子生物学。Email: jyzhu001@gmail.com。
S763.43; S767.3
A
2095-1914(2016)06-0112-05
第1作者:黄镜梅 (1992—),女,硕士生。研究方向:昆虫生理与分子生物学。Email: 1025682082@qq.com。
