HPLC法同时测定不同产地羊蹄药材中大黄素、大黄酚、大黄素甲醚的含量
2016-12-15何盛江焦豪妍杨燕军广东省中药研究所广州5050解放军第3医院浙江宁波35040
何盛江,聂 阳,陈 刚,焦豪妍,杨燕军(.广东省中药研究所,广州 5050;.解放军第3医院,浙江宁波 35040)
HPLC法同时测定不同产地羊蹄药材中大黄素、大黄酚、大黄素甲醚的含量
何盛江1*,聂 阳1#,陈 刚2,焦豪妍1,杨燕军1(1.广东省中药研究所,广州 510520;2.解放军第113医院,浙江宁波 315040)
目的:建立同时测定羊蹄药材中大黄素、大黄酚、大黄素甲醚含量的方法,并比较不同产地药材各成分含量差异。方法:采用高效液相色谱法。色谱柱为Agilent C18,流动相为甲醇-0.1%磷酸溶液(梯度洗脱),流速为1.0 ml/min,检测波长为254 nm,柱温为35℃,进样量为20 μl。结果:大黄素、大黄酚、大黄素甲醚检测质量浓度线性范围分别为2.04~24.48 μg/ml(r=0.999 7)、2.00~24.00 μg/ml(r=0.999 5)、1.02~12.24 μg/ml(r=0.999 8);精密度、稳定性、重复性试验的RSD<2.0%;加样回收率分别为97.09%~102.65%(RSD=1.79%,n=9)、97.10%~100.31%(RSD=0.97%,n=9)、95.45%~100.18%(RSD=1.45%,n=9)。结论:该方法检测简便,精密度、稳定性、重复性好,可用于羊蹄药材中大黄素、大黄酚、大黄素甲醚含量的同时测定;不同产地药材中各成分含量差异显著。
高效液相色谱法;羊蹄;大黄素;大黄酚;大黄素甲醚;含量测定
羊蹄为蓼科属植物皱叶酸模Rumex crispus L.或羊蹄Rumex japonicus Houtt.的果实,又名东方宿、败毒菜根、牛大黄等,以根或全草入药,具有杀虫、活血止血、清热解毒等功效,可外用于治疗外痔、急性乳腺炎、黄水疮、皮癣等症[1-2]。羊蹄主要含有大黄素、大黄酚、大黄素甲醚、酸模素、槲皮素等化学成分,其中大黄素、大黄酚、大黄素甲醚为主要药效成分[3-5]。目前,各地羊蹄药材质量标准无含量测定项,而文献报道仅以高效液相色谱法(HPLC)测定药材中大黄素或大黄酚单一成分的含量[6-7]。因此,笔者采用HPLC法同时测定不同产地羊蹄药材中大黄素、大黄酚、大黄素甲醚的含量,为更全面地控制药材质量提供可靠方法。
1 材料
1.1 仪器
1200型HPLC仪,包括DAD二极管阵列检测器(美国Agilent公司);KH-500DE型数控超声波清洗机(昆山禾创超声仪器有限公司,功率:200 W,频率:10 kHz)。
1.2 试剂
大黄素对照品(批号:0756-200110,纯度>98%)、大黄酚对照品(批号:110796-201017,纯度>98%)、大黄素甲醚对照品(批号:110758-200610,纯度>98%)均购自中国食品药品检定研究院;甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 药材
羊蹄药材购自广州清平中药材市场(见表1),经解放军第113医院陈刚副主任药师鉴定为蓼科植物羊蹄R.japonicus Houtt.的根。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent C18(200 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%磷酸溶液(B),梯度洗脱(洗脱程序见表2);流速:1.0 ml/min;检测波长:254 nm;柱温:35℃;进样量:20 μl。

表1 羊蹄药材来源Tab 1 Origin of R.japonicus
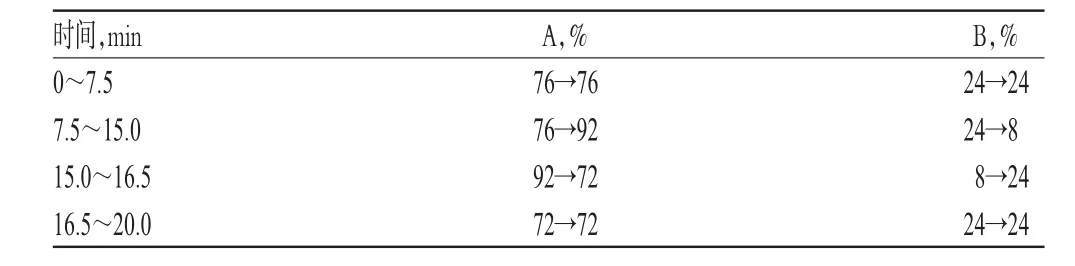
表2 梯度洗脱程序Tab 2 Gradient elution program
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取大黄素对照品10.2 mg、大黄酚对照品10.0 mg和大黄素甲醚对照品5.1 mg,分别置于50 ml量瓶中,加甲醇溶解并定容,摇匀,得大黄素、大黄酚、大黄素甲醚质量浓度分别为204、200、102 μg/ml的单一对照品贮备液。精密量取上述单一对照品贮备液适量,置于同一10 ml量瓶中,即得混合对照品溶液。
2.2.2 供试品溶液 将药材粉碎,过40目筛,精密称取0.20 g,置于具塞锥形瓶中,加甲醇25 ml,称定质量,加热回流30 min,放冷,再次称定质量,加甲醇补足减失的质量,摇匀,滤过,得续滤液。精密量取上述续滤液5 ml,置于圆底烧瓶中,挥去甲醇,加8%盐酸溶液10 ml,超声处理5 min,再加三氯甲烷10 ml,加热回流l h,冷却,移至分液漏斗中,用少量三氯甲烷洗涤容器,并入分液漏斗中,分取三氯甲烷层,酸液用三氯甲烷提取2次,每次10 ml。三氯甲烷液依次以铺有无水硫酸钠2 g的漏斗滤过,合并三氯甲烷液,回收溶剂至干,残渣加甲醇使溶解,转移至10 ml量瓶中,加甲醇定容,摇匀,滤过,取续滤液,即得。
2.3 系统适用性试验
取“2.2”项下混合对照品溶液、供试品溶液适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。结果,在此色谱条件下,对照品和样品中其他成分均可达到基线分离,与相邻色谱峰的分离度均>1.5;理论板数以大黄素峰计≥3 000。
2.4 线性关系考察
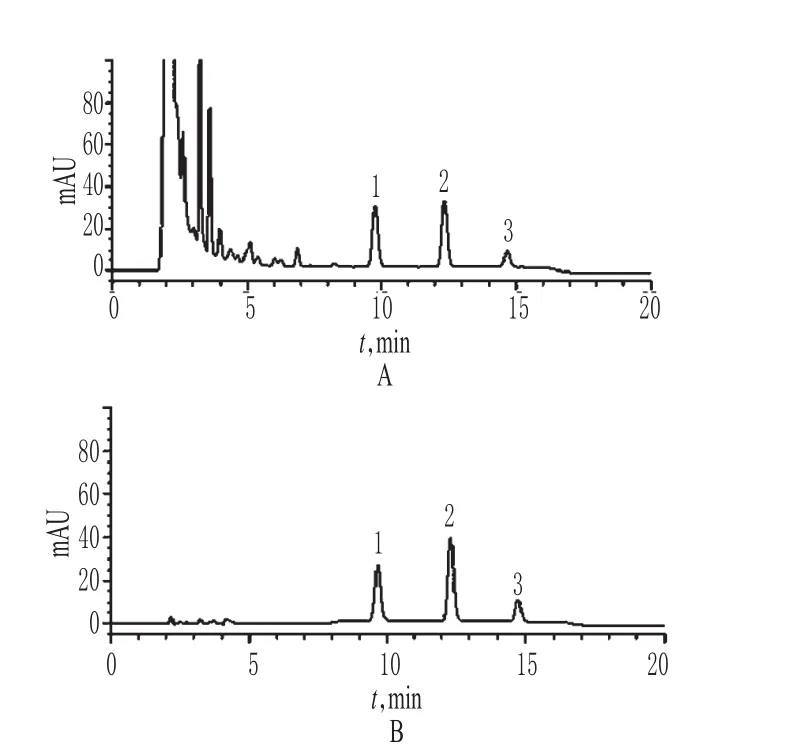
图1 高效液相色谱图A.供试品;B.混合对照品;1.大黄素;2.大黄酚;3.大黄素甲醚Fig 1 HPLC chromatogramA.test sample;B.mixed reference substance;1.emodin;2.chrysophanol;3. physcion
分别精密量取“2.2.1”项下大黄素、大黄酚、大黄素甲醚单一对照品贮备液各0.25、0.5、1.0、1.5、2.0、2.5、3.0 ml,分别置于10 ml量瓶中,加流动相定容,制成系列单一对照品溶液。精密量取上述系列单一对照品溶液各20 μl,按“2.1”项下色谱条件进样测定,记录峰面积。以大黄素、大黄酚、大黄素甲醚质量浓度(x,μg/ml)为横坐标、峰面积(y)为纵坐标进行线性回归,得大黄素、大黄酚、大黄素甲醚回归方程分别为y=44.737x-2.987 8(r=0.999 7)、y=66.738x-12.416(r=0.999 5)、y=34.554x-2.770 2(r=0.999 8)。结果表明,大黄素、大黄酚、大黄素甲醚检测质量浓度线性范围分别为2.04~24.48、2.00~24.00、1.02~12.24 μg/ml。
2.5 精密度试验
取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为0.17%、0.89%、1.02%(n=6),表明仪器精密度良好。
2.6 稳定性试验
取“2.2.2”项下供试品溶液(编号:1)适量,分别于室温下放置0、2、4、8、12、16、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为0.48%、0.27%、1.18%(n=7),表明供试品溶液在24 h内基本稳定。
2.7 重复性试验
精密称取同一批样品(编号:1)适量,按“2.2.2”项下方法制备供试品溶液,共6份,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量。结果,大黄素、大黄酚、大黄素甲醚的平均含量分别为1.711、1.102、0.456 mg/g,RSD分别为1.42%、1.55%、0.87%(n=6),表明本方法重复性良好。
2.8 加样回收率试验
取已知含量样品(编号:1)适量,共6份,分别加入低、中、高质量的大黄素、大黄酚、大黄素甲醚对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
2.9 样品含量测定
取7批样品各适量,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,结果见表4。
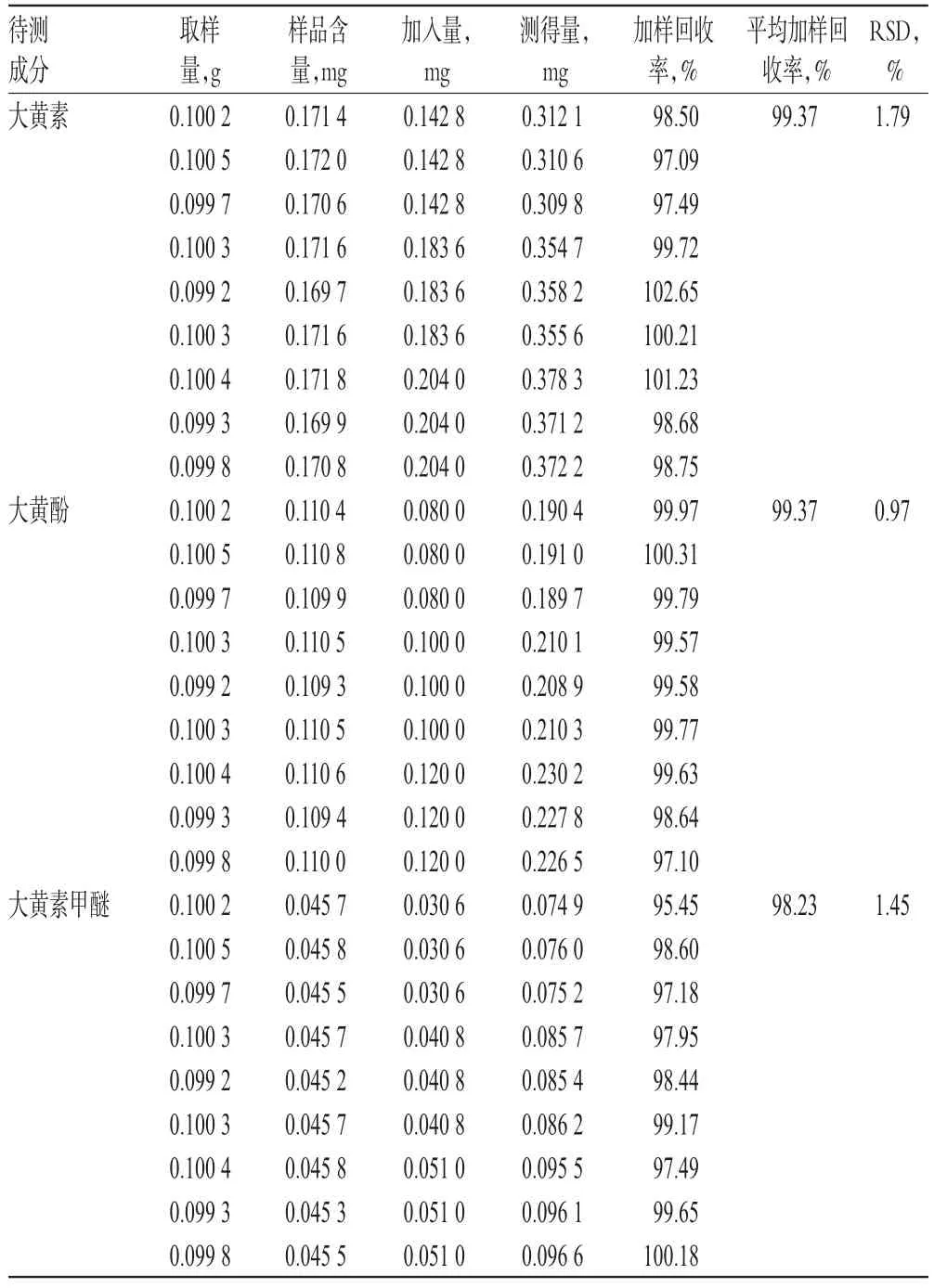
表3 加样回收试验结果(n=9)Tab 3 Results of recovery test(n=9)
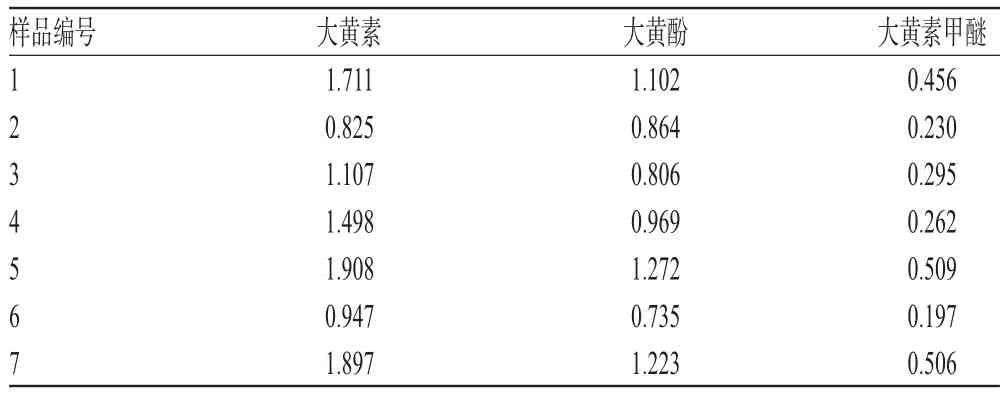
表4 样品含量测定结果(n=3,mg/g)Tab 4 Determination results of contents in samples(n=3,mg/g)
3 讨论
药材中的大黄素、大黄酚、大黄素甲醚以结合态、游离态形式存在[8],因此样品的前处理是保证含量测定结果准确的关键。本试验采用甲醇回流提取,酸性甲醇水解,水解温度比在酸水中低,酚类成分破坏少,加上去除了萃取和蒸干步骤,理论上测定的含量更接近其真实含量[9]。
参考药典[8]及文献[10]方法,HPLC法测定以甲醇-0.1%磷酸溶液为流动相,经过多次预试验优化,确定梯度洗脱程序。结果表明,本试验所建立的HPLC法在16 min内可完成测定,大黄素、大黄酚的保留时间约为9.8、12.3 min,两者分离效果良好,不仅耗时短、操作简便、重复性好,而且结果可靠。
本试验对全国7个产地羊蹄药材中大黄素、大黄酚和大黄素甲醚的含量进行测定,结果平均含量分别为1.41、1.00、0.35 mg/g,RSD分别为32.06%、20.96%、38.51%,表明不同产地羊蹄药材中各成分含量差异显著。笔者采购的全国7个产地羊蹄药材为其根部,而仔细观察药材却发现各地药材根部上部保留的茎长短不一,这可能导致含量差异,参考与羊蹄同属的大黄药材的根头、根身和根尾等部位所含的大黄素、大黄酚等成分的含量差别较大,含量顺序为依次递减[11],这可印证羊蹄药材不同部位含量存在差异。有研究发现,羊蹄的根中大黄素含量高于根茎中含量,酸性土壤条件下羊蹄根中大黄素的含量明显高于碱性土壤条件[6]。
综上所述,本方法检测简便,精密度、稳定性、重复性好,可用于羊蹄药材中大黄素、大黄酚、大黄素甲醚含量的同时测定。
[1] 中华本草编撰委员会.中华本草:第2册[M].上海:上海科学技术出版社,1999:729.
[2] 吴琪,黄璐,茹梦,等.羊蹄化学成分及其抗肿瘤活性研究[J].药学与临床研究,2013,21(3):227.
[3] 邱小梅,邹剑成,王定勇.羊蹄根的化学成分研究[J].中国药房,2009,20(9):681.
[4] 邓立华,刘丹,雷钧涛.羊蹄根有效部位的初步分离[J].吉林医药学院学报,2009,30(4):197.
[5] 林菲娟.正交试验法优选羊蹄中游离蒽醌的提取工艺[J].中药材,2012,35(9):1 521.
[6] 周子晔,林迦勒,林观样.不同土壤性质下羊蹄各部位大黄素含量的比较[J].中华中医药学刊,2012,30(2):428.
[7] 邹剑成,邱小梅,王定勇.RP-HPLC法测定羊蹄根中大黄酚的含量[J].中药材,2009,32(7):1 081.
[8] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:22、237.
[9] 张力,马静,欧洋,等.四川产亚大黄的鉴别及其大黄素、大黄酚的测定[J].华西药学杂志,2015,30(3):322.
[10] 卫莹芳,谢达温,万丽,等.HPLC梯度洗脱法同时测定决明子中樱黄决明素、大黄素、大黄酚和大黄素甲醚的含量[J].世界科学技术-中医药现代化,2009,11(6):868.
[11] 王荣,贾正平,张强,等.甘肃道地药材大黄不同部位的指纹图谱研究[J].中国药房,2012,23(1):39.
(编辑:张 静)
Simultaneous Determination of Emodin,Chrysophanol and Physcion in Rumex japonicus from Different ProducingAreas by HPLC
HE Shengjiang1,NIE Yang1,CHEN Gang2,JIAO Haoyan1,YANG Yanjun1(1.Guangdong Research Institute of Traditional Chinese Medicine,Guangzhou 510520,China;2.Chinese PLA 113 Hospital,Zhejiang Ningbo 315040,China)
OBJECTIVE:To establish a method for contents determination of emodin,chrysophanol and physcion in Rumex japonicus,and compared the differences of components in medicinal materials from different producing areas.METHODS:HPLC was performed on the column of Agilent C18with mobile phase of methanal-0.1%phosphoric acid solution(gradient elution)at a flow rate of 1.0 ml/min,detection wavelength was 254 nm,column temperature was 35℃,and injection volume was 20 μl.RESULTS:The linear range was 2.04-24.48 μg/ml for emodin(r=0.999 7),2.00-24.00 μg/ml for chrysophanol(r=0.999 5)and 1.02-12.24 μg/ml for physcion(r=0.999 8);RSDs of precision,stability and reproducibility tests were lower than 2.0%;recoveries were 97.09%-102.65%(RSD=1.79%,n=9),97.10%-100.31%(RSD=0.97%,n=9)and 95.45%-100.18%(RSD=1.45%,n=9).CONCLUSIONS:The method is simple with high precision,stability and reproducibility,and can be used for the simultaneous determination of emodin,chrysophanol and physcion in R.japonicas.There are obvious differences in medicinal materials from different producing areas.
HPLC;Rumex japonicus;Emodin;Chrysophanol;Physcion;Content determination
R927.2
A
1001-0408(2016)33-4719-03
2015-11-30
2016-01-14)
*副主任药师,博士。研究方向:中药新药与新剂型。电话:020-28854995。E-mail:hesj@gdyzy.edu.cn
#通信作者:副主任药师。研究方向:中药活性成分与新药。电话:020-28854883。E-mail:drugs999@163.com
DOI 10.6039/j.issn.1001-0408.2016.33.37
