多氯联苯暴露对食蚊鱼CYP19α和VTGα基因的表达及骨骼形态雄性化的影响
2016-12-12闫月明方展强
闫月明,方展强
华南师范大学生命科学学院 广东省高等学校生态与环境科学重点实验室,广州 510631
多氯联苯暴露对食蚊鱼CYP19α和VTGα基因的表达及骨骼形态雄性化的影响
闫月明,方展强*
华南师范大学生命科学学院 广东省高等学校生态与环境科学重点实验室,广州 510631
应用食蚊鱼细胞色素P450芳香化酶基因(CYP19α)和卵黄蛋白原基因(VTGα)mRNA转录水平为指标,研究微量多氯联苯(PCBs)长时间暴露对成年雌性食蚊鱼CYP19α基因和VTG α基因表达的影响,并评价其对雌性食蚊鱼产生的形态雄性化效应。采用静水暴露实验模式,分别设置0.08、0.4、2和10 μg·L-1PCBs浓度,并设置对照组和平行组,定量测定14 d和28 d性腺CYP19α和肝脏VTGα mRNA表达水平的变化,以及对椎体脉棘发育的影响。暴露实验结果显示:①各PCBs浓度组(0.08、0.4、2和10 μg·L-1PCBs)暴露均能抑制食蚊鱼CYP19α和VTG基因的表达,表明PCBs对食蚊鱼VTGα基因的抑制远大于对食蚊鱼CYP19α基因的抑制;②0.4 μg·L-1PCBs暴露显著地降低了食蚊鱼第15椎体脉棘的长度并降低第15、16椎体脉棘的L/D值,显示食蚊鱼出现骨骼形态雄性化,表明一定浓度的PCBs暴露会表现出抗雌激素效应。
多氯联苯(PCBs);食蚊鱼;CYP19α;VTGα;mRNA表达;椎体脉棘;形态雄性化
Received 24 November 2015 accepted 22 December 2015
由于工业的发展,大量的污染物被排放进入环境中,其中包含很多的环境激素类物质。珠江三角洲地区,作为华南地区工业分布的重点区域,每年都有众多的污水以及次级污水直接排放进入江河中,这些污染物中,多氯联苯(polychlorinated biphenyls, PCBs)的含量明显高于其他地区[1]。PCBs除了具有毒性外,还具有环境激素效应。杜克久等[2]以人乳腺癌细胞系MCF27细胞为实验材料,研究了2种国产PCBs的类雌激素效应,发现在低浓度范围内,2种PCBs与典型的雌激素物质17β-雌二醇(E2)一样,表现出雌激素效应。杨丽丽等[3]以唐鱼(Tanichthys albonubes)为研究材料,也发现PCBs与其他化合物的混合物也表现出雌激素效应。Armando Vega-López等[4]研究了PCBs混合物暴露对胎生吉鱂(Girardinichthys viviparus)的影响,结果表明胎生吉鱂的卵黄蛋白原含量发生了变化,说明PCBs具有激素效应。Calò等[5]研究了2种不同类型的PCBs暴露(苯环共平面和不共平面)对金头鲷(Sparus aurata)的影响,发现这2种不同类型的PCBs表现出不同的激素效应,且在不同时间点表现出不同效果的激素效应,结果显示,无论是PCB-126、PCB-153单独暴露,还是两者混合暴露,在暴露12 h之后,金头鲷体内的VTG都会增加,PCBs表现出雌激素效应;在暴露24 h之后,PCB-126单独暴露和与PCB-153联合暴露,金头鲷体内的VTG含量减少,PCBs表现出抗雌激素效应,这可能是PCBs对生物体内分泌有多个影响机制造成的。目前,关于PCBs毒性的研究较多,而关于其激素效应的研究还处于起步阶段。并且绝大多数的研究都集中在PCBs的急性激素效应的研究上,而关于PCBs的慢性激素效应的研究还不多。
在水生环境中,多种环境激素被排放进水体中,生长在水环境中的鱼类受到严重的影响。受环境污染影响的鱼类无论从形态方面还是基因表达方面都发生异常变化。目前较为被科学界认可的鱼类生物标志物有卵黄蛋白原(VTG),VTG mRNA的表达等。但是对于环境的检测,不能凭借单一的标志物或者手段来得到结论,必须寻找更多的生物标志物,发展不同的手段,通过多种方法从而得到较为合理的结论。硬骨鱼类(Osteichthyes)的CYP19基因与生物的性别分化和激素调节相关,所以成为近年来研究较热门的生物标志物。Sarah等[6]、Yukinori等[7]、Rodrigo等[8]的研究均表明:受到环境污染或毒害的生物体体内的CYP19基因表达都会发生异常。已有文献报道,雄性黑头呆鱼(Pimephales promelas)[9]、青鳉(Oryzias latipes)[10]和斑马鱼(Danio rerio)[11]等小型鱼类的CYP19基因的表达被作为生物标志物来探究与环境污染,尤其是环境激素(environmental hormone)污染的关系。
食蚊鱼(Gambusia affinis)隶属鳉形目(Cypriondontiformes),胎鳉科(Poeciliidae),食蚊鱼属(Gambusia),是一种原产自北美洲的热带性卵胎生小型鱼类,1927年从马尼拉引入我国,食蚊鱼具有广泛的环境适应性,生长迅速,卵胎生,高生殖率等特点,所以成为我国南方广泛分布的淡水小鱼。食蚊鱼具有明显的二态性,雌鱼第14、15、16椎体脉棘(vertebral ribs)与雄鱼不同,性成熟的雄性个体其变长并向前弯曲,这种结构可以在雄鱼交配时为生殖足摆动提供足够的支撑[12]。利用食蚊鱼第14、15、16椎体脉棘的骨骼形态变化可以检测环境激素类物质暴露致鱼类的雌/雄激素效应[13]。而利用食蚊鱼目标基因mRNA表达水平变化可更敏捷地检测到水体环境激素类物质暴露致鱼类的雌/雄激素效应[14-16]。本实验首先克隆食蚊鱼CYP19α基因片段;设定不同浓度的PCBs暴露成年雌性食蚊鱼,应用RT-qPCR(实时荧光定量PCR)技术,定量检测PCBs对食蚊鱼CYP19α基因和VTGα基因表达的影响,并比较食蚊鱼第14、15、16椎体脉棘的形态变化情况,以探究PCBs的激素效应。本研究成果填补食蚊鱼CYP19α基因研究的空白,为珠江三角洲地区环境保护提供有参考价值的数据和资料。
1 材料与方法(Materials and methods)
1.1 化学试剂
暴露试剂:多氯联苯(polychlorinated biphenyls, PCBs)(Aroclor 1248)(Supelco公司,美国),使用纯度99.8%的二甲基亚砜(dimethyl sulfoxide, sigma, DMSO)将PCBs进行溶解,配成保存液。DMSO在本实验中作为溶剂对照,在先前的预实验中证明其对实验结果没有影响。
分子试剂:RNAiso Plus (TAKARA, Dalian, China), PrimeScript RT reagent Kit With gDNA Eraser (Perfect Real Time) (TAKARA, Dalian, China), SYBR Premix Ex TaqⅡ(Tli RNaseH Plus) (TAKARA, Dalian, China)。其他生化试剂均为符合实验规格要求国产试剂。
1.2 实验动物
食蚊鱼购自广州市花鸟虫鱼市场。捕捞回实验室后,放入鱼缸进行饲养。在实验室水族箱内驯养2周,待死亡率小于2%后选取形态发育良好、反应灵敏、大小均一健康的成年雌性个体用于暴露实验。食蚊鱼正常的雌雄个体鉴别及其性成熟的鉴定参照Leusch等[17]的描述。实验鱼的使用及实验过程“参照实验动物使用的3R原则进行”[18]。
1.3 染毒与制样
将食蚊鱼转移到10 L的鱼缸中进行暴露实验,实验所用水10 L,为曝气24 h的自来水,硬度为2.4度(德国度),pH(6.8 ~ 7.2),水温控制在(26 ± 1) ℃,光周期控制在约14 h : 10 h(light : dark),采用静水更新的实验模式。实验设置DMSO溶剂对照组,多氯联苯(PCBs)设置0.08、0.4、2和10 μg·L-14个浓度组,每个浓度组投入食蚊鱼数量为35条,并设置平行组。由于激素类物质会降解,加之鱼类的自身排泄物释放到鱼缸中会对鱼类活动造成影响,每隔2天将鱼缸中的水换掉,并清理鱼缸,然后重新加激素。每天喂食红虫一次,并在相同的时间段(早上10点)进行。在第14天和28天进行实验取样,每个浓度每次至少取4条食蚊鱼的性腺和肝组织,并迅速装入离心管中,然后快速投入液氮中进行速冻,进行食蚊鱼CYP19α基因和VTGα基因的实时荧光定量PCR检测。
1.4 骨骼处理及形态参数计算
骨骼处理:冰浴将鱼处死后拍照,然后将食蚊鱼样品浸泡在纯水中1 d,以通过逆渗透的方式来水化组织,再用1%的KOH处理4 d ~ 5 d,每天换液,然后在体视显微镜下小心地剥去鱼皮及肉质部,分使其只剩下骨骼,用1%的茜素红S染色30 min左右,再放入KOH中浸泡10 min,小心去除剩余的肉和杂质,清理好骨骼标本,在甘油中保存,待标本处理完全后在显微镜上用数码相机(Canon EOS 500D)进行拍照。
骨骼形态参数计算:骨骼照片采用图像处理软件Adobe Photoshop CS4中的距离测量工具进行相关指标的测定。参照Rawson等[19]描述的测量方法,所测量的指标包括第14、15、16椎体脉棘总长,记录为14L、15L、16L(图1a);第14、15、16椎体脉棘尾部尖端到脊柱的深度,记录为14D、15D、16D(图1b)。根据测量的指标分别计算第14、15、16椎体脉棘总长与椎体脉棘尾部尖端到脊柱深度之比值,即14L/D、15L/D、16L/D。
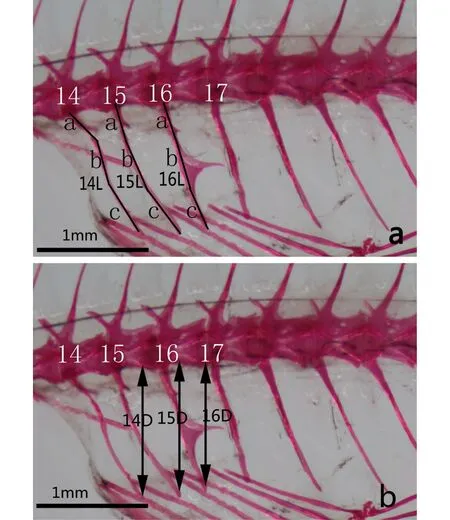
图1 食蚊鱼的骨骼测量注:a. 椎体脉棘的总长L(L = a + b + c);b. D是指从椎体脉棘尾部尖端到脊柱的深度;14、15、16、17. 表示第14、15、16、17椎体脉棘。Fig.1 The skeletal morphology of mosquitofishNote: a. Total length of hemal spine L (L = a + b + c); b. Depth (D) measured from the distal tip of the hemal spine to the vertebral column; 14, 15, 16, 17. Show the 14th, 15th, 16th hemal spine.
1.5 分子生物学测定方法
引物设计:登录NCBI网站,找到西部食蚊鱼(Gambusia affinis)的VTGα cDNA的序列,并克隆了食蚊鱼性腺CYP19α cDNA部分序列,利用Primer 3软件(http://frodo.-wit.Edu/),由生物工程(上海)公司合成需要的引物。本研究相关基因扩增引物名称及其序列见表1。
RNA制备:总RNA提取:分别将性腺和肝脏组织匀浆,分别加入1 mL的Isoplus RNA (RNAiso Plus)提取液(TakaRa)进行总RNA提取。RNA提取后进行基因组DNA的去除,并检测RNA浓度及其完整性,保证A260/A280的比值在1.8 ~ 2.0(TakaRa)。
RNA反转录成cDNA:使用TakaRa Code:DRR037 PrimScriptTMRT reagents Kit (Perfect Real Tome)产品。RT反应液配制如下:5PrimeScript Buffer (2 μL), PrimeScript PT Enzyme Mix I (0.5 μL), Random 6 mers (100 μmol·L-1, 0.5 μL), Oligo dT Primer (50 μmol·L-1, 0.5 μL), Total RNA (1 μL), Rnase Free dH2O (5.5 μL),总共10 μL。反转录反应条件如下:37 °C 15 min (cDNA合成),85 ℃ 5 s(酶失活)。
实时荧光定量:使用TakaRa Code:DRR081A SYBRPremix Ex TaqTMII (2) 10.0 μL,正反向引物(10 μmol·L-1)各0.8 μL,ROX References Dye I (50) or ROX References Dye II (50) 0.4 μL,cDNA模板2.0 μL,H2O(灭菌)6.0 μL,总共20.0 μL。按照两步法PCR扩增标准程序进行RT-PCR反应。两步法PCR扩增标准程序:95 ℃预变性15 min;95 ℃变性10 s、60 ℃退火32 s共40个循环。
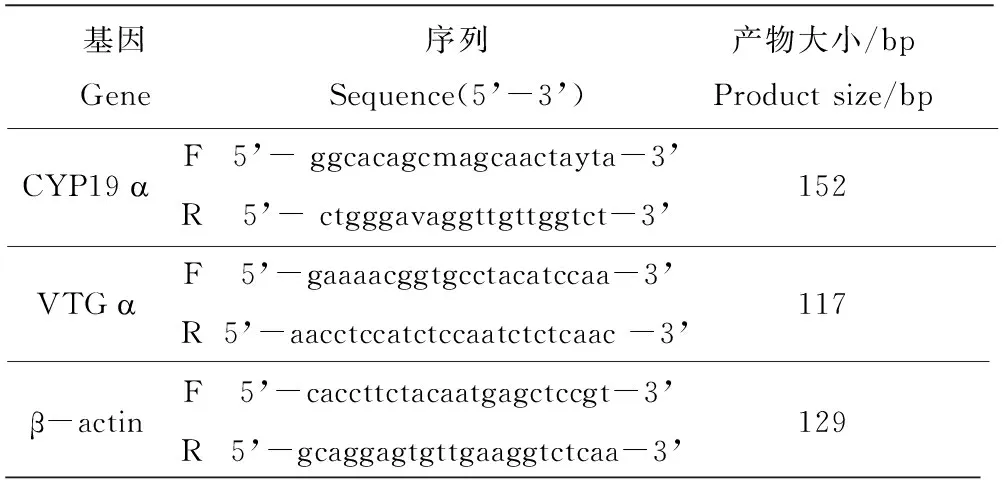
表1 相关基因扩增引物名称及其序列
注:所有DNA序列为5'到3'端。
Note: All DNA sequences are presented in the 5’to 3’direction.
RT-PCR扩增结果数据的处理采用相对定量法,内参基因选用β-actin。经荧光定量PCR分析仪分析,得出精确的Ct值后,然后根据计算公式求得相对值即为相对表达量。
校正值=目的基因定量结果/管家基因定量结果
相对值=待测样品的校正值/对照样品的校正值
即倍数(Folds)= 2-△△Ct= 2- ((Ct A-Ct A actin)-(Ct B-Ct B actin))
其中,A为对照组样品;B为各实验组样品;Ct值为阈值循环数。
1.6 数据统计与处理
使用SPSS 19.0统计软件对所得数据进行统计学分析,采用单因素方差分析(One wey-ANOVA)法对数据进行差异性分析。用Excel 2013做柱形图。设置P < 0.05时,表示差异显著;当P < 0.01时,表示差异极其显著。
2 结果(Results)
2.1 食蚊鱼CYP19α基因片段的克隆
本实验克隆了食蚊鱼性腺CYP19α基因片段,其测序工作由生工(上海)公司完成。克隆获得的食蚊鱼性腺芳香化酶基因CYP19α基因总长为1 080 bp,将此基因片段与其他硬骨鱼类的性腺CYP19α基因做同源性比较,发现其与底鳉(Fundulus heteroclitus)、青鳉(Oryzias latipes)、罗非鱼(Tilapia nilotica)、鲫鱼(Carassius auratus)、斑马鱼(Danio rerio)、鲤鱼(Cyprinus carpio)基因内片段的相似度分别达到了91.2%、83.8%、83%、70.3%、70.2%、69.3%,表明克隆得到的基因即为食蚊鱼CYP19α基因。
2.2 PCBs暴露对食蚊鱼CYP19α和VTGα mRNA的表达水平
如图2所示,与对照组相比,各个实验组(0.08、0.4、2和10 μg·L-1PCBs)连续暴露14 d,食蚊鱼性腺CYP19α基因的表达均受到抑制,其差异显著或十分显著(分别P < 0.05或P < 0.01),并且随着PCBs暴露浓度的升高,对食蚊鱼CYP19α基因的表达抑制越强烈。连续暴露至第28天,各浓度组食蚊鱼CYP19α基因的表达仍然显示受到持续地抑制,但与对照组相比,只有2个相对较高浓度组(2 μg·L-1和10 μg·L-1PCBs)食蚊鱼CYP19α基因的表达呈显著性地下降(分别P < 0.05),但2个相对较低浓度组与对照组相比差异不明显(分别P > 0.05)。结果显示,PCBs能够抑制CYP19α基因的表达,并且随着浓度的增加抑制作用增强;但随着时间增加,其抑制作用将逐渐减弱。
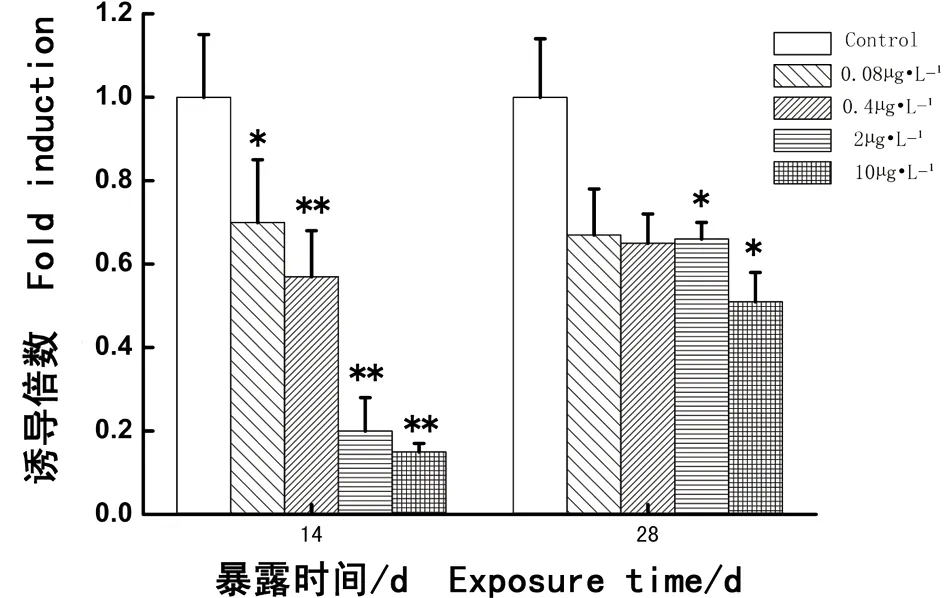
图2 多氯联苯暴露食蚊鱼CYP19α基因表达的水平注:Control. 对照组;0.08 μg·L-1. 0.08 μg·L-1 PCBs暴露组;0.4 μg·L-1. 0.4 μg·L-1 PCBs暴露组;2 μg·L-1. 2 μg·L-1 PCBs暴露组;10 μg·L-1. 10 μg·L-1 PCBs暴露组;误差线表示的是标准偏差;星号用来表示染毒组与对照组之间的统计学差异;其中,*表示P < 0.05;**表示P < 0.01。下同。Fig. 2 CYP19α gene expressive levels in mosquitofish after exposure to PCBsNote: Control. control group; 0.08 μg·L-1. 0.08 μg·L-1 PCBs exposure group; 0.4 μg·L-1. 0.4 μg·L-1 PCBs exposure group; 2 μg·L-1. 2 μg·L-1 PCBs exposure group; 10 μg·L-1. 10 μg·L-1 PCBs exposure group. The error bars indicate the standard deviations; * P < 0.05 and ** P < 0.01 indicate significant differences between the controls and corresponding exposure groups. The same below.
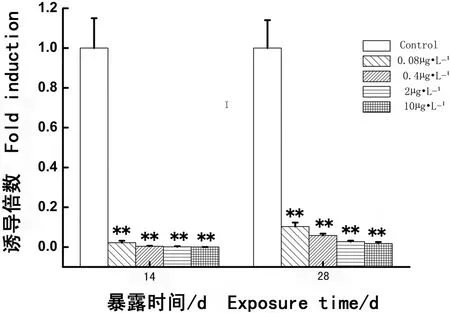
图3 多氯联苯暴露食蚊鱼VTGα基因表达的水平Fig. 3 VTGα gene expressive levels in mosquitofish after exposure to PCBs
如图3所示,各个实验组(0.08、0.4、2和10 μg·L-1PCBs)连续暴露14 d,食蚊鱼肝脏VTGα基因的表达均受到极其强烈地抑制,各实验组食蚊鱼肝脏VTGα基因的表达分别仅为对照组的0.1、0.2、0.3和0.4倍,差异十分显著(分别P < 0.01);连续暴露至第28天,各个实验组食蚊鱼肝脏VTGα基因的表达水平仍然被十分显著地抑制(分别P < 0.01)。结果显示,PCBs暴露对VTGα基因表达的抑制十分强烈,并远大于对CYP19α的抑制作用。
2.3 PCBs暴露对雌性食蚊鱼第14、15、16椎体脉棘发育的影响
如图4所示,经过28 d PCBs暴露,各实验浓度组(0.08、0.4、2和10 μg·L-1PCBs)食蚊鱼第14椎体脉棘L值的变化与对照组相比均没有明显差异(分别P > 0.05);各浓度组食蚊鱼第15椎体脉棘的L值则都明显增加,与对照组相比差异显著(分别P < 0.05),尤其较高浓度组(2 μg·L-1和10 μg·L-1PCBs)L值提升幅度较高;较低浓度组(0.08 μg·L-1和0.4 μg·L-1PCBs)食蚊鱼第16椎体脉棘的L值与对照组相比均没有明显差异(分别P > 0.05),但是较高浓度组(2 μg·L-1和10 μg·L-1PCBs)L值增幅更高,与对照组相比差异显著或十分显著(分别P < 0.05和P < 0.01)。结果显示,椎体脉棘发育对外界环境激素物质影响的敏感度为:第15椎体脉棘 > 第16椎体脉棘 > 第14椎体脉棘。
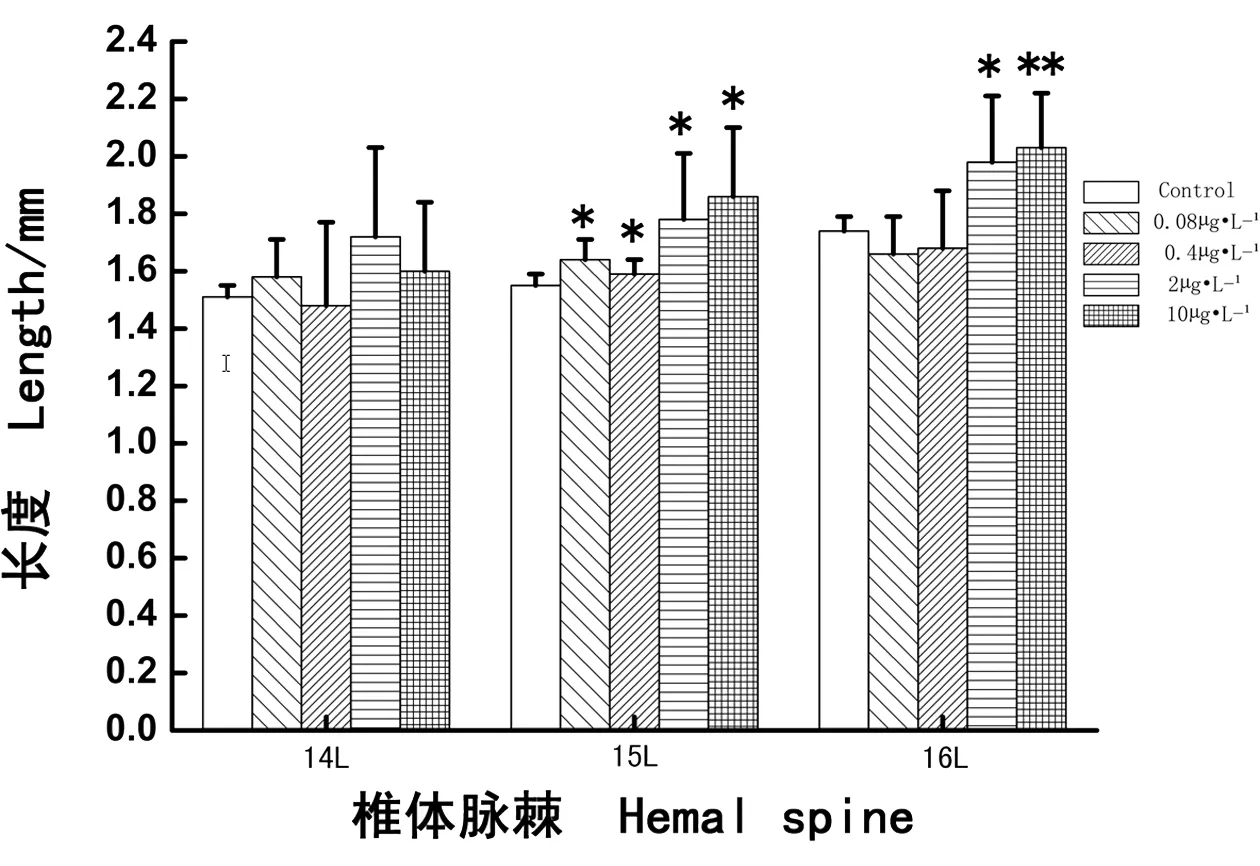
图4 多氯联苯暴露雌性食蚊鱼第14、15、16椎体脉棘的长度(L)Fig. 4 The length (L) of 14th, 15th, 16th hemal spine in adult female mosquitofish exposed to PCBs
如图5所示,经过28 d PCBs暴露,各实验浓度组食蚊鱼第14椎体脉棘的D值的变化与对照组相比均没有明显差异(分别P > 0.05);但是相对较高浓度组(2 μg·L-1和10 μg·L-1PCBs)食蚊鱼的第15和第16椎体脉棘的D值都明显增加,与对照组相比差异显著或十分显著(分别P < 0.05或P < 0.01)。结果显示,较高浓度的PCBs(2 μg·L-1和10 μg·L-1)暴露致使雌性食蚊鱼的第15和第16椎体脉棘的L和D值都同时显著性地增加。
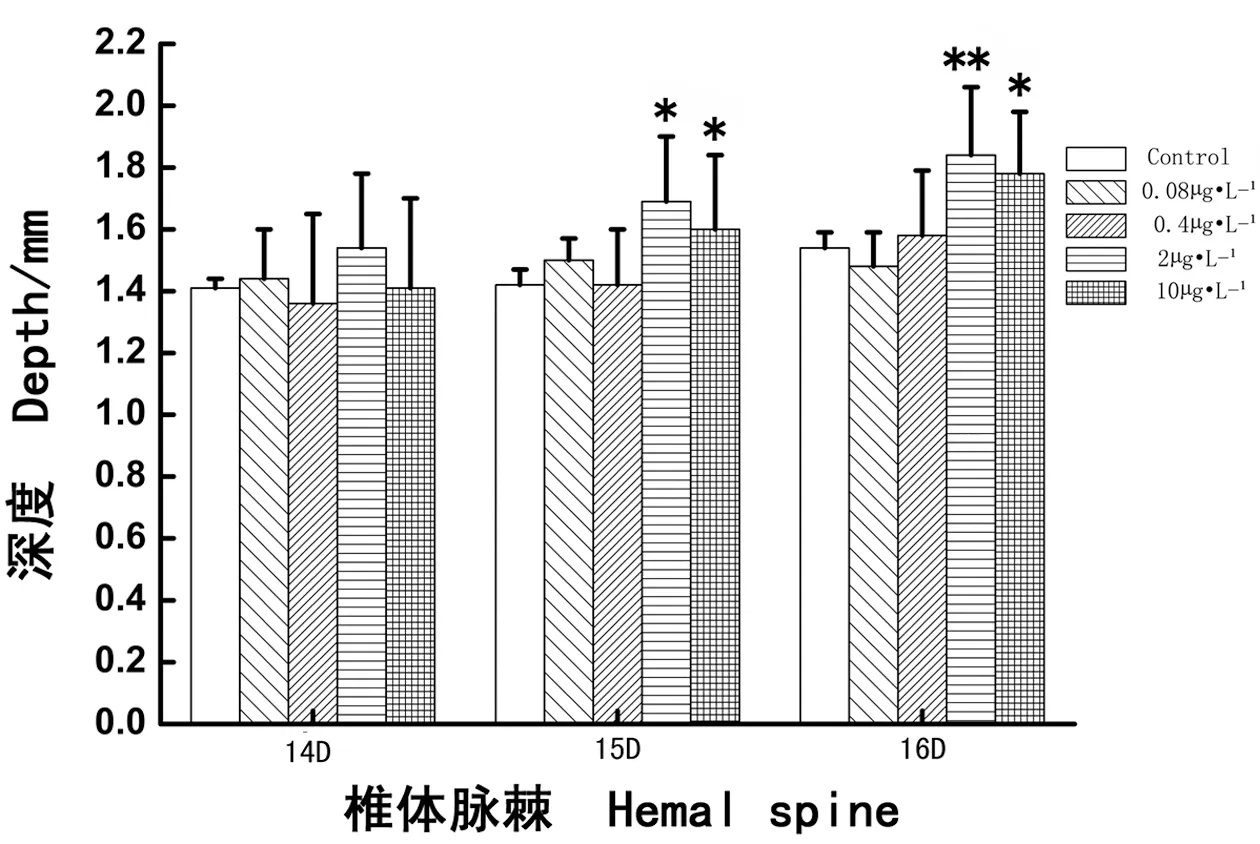
图5 多氯联苯暴露雌性食蚊鱼第14、15、16椎体脉棘的深度(D)Fig. 5 The depth (D) of 14th, 15th, 16th hemal spine in female mosquitofish exposed to PCBs
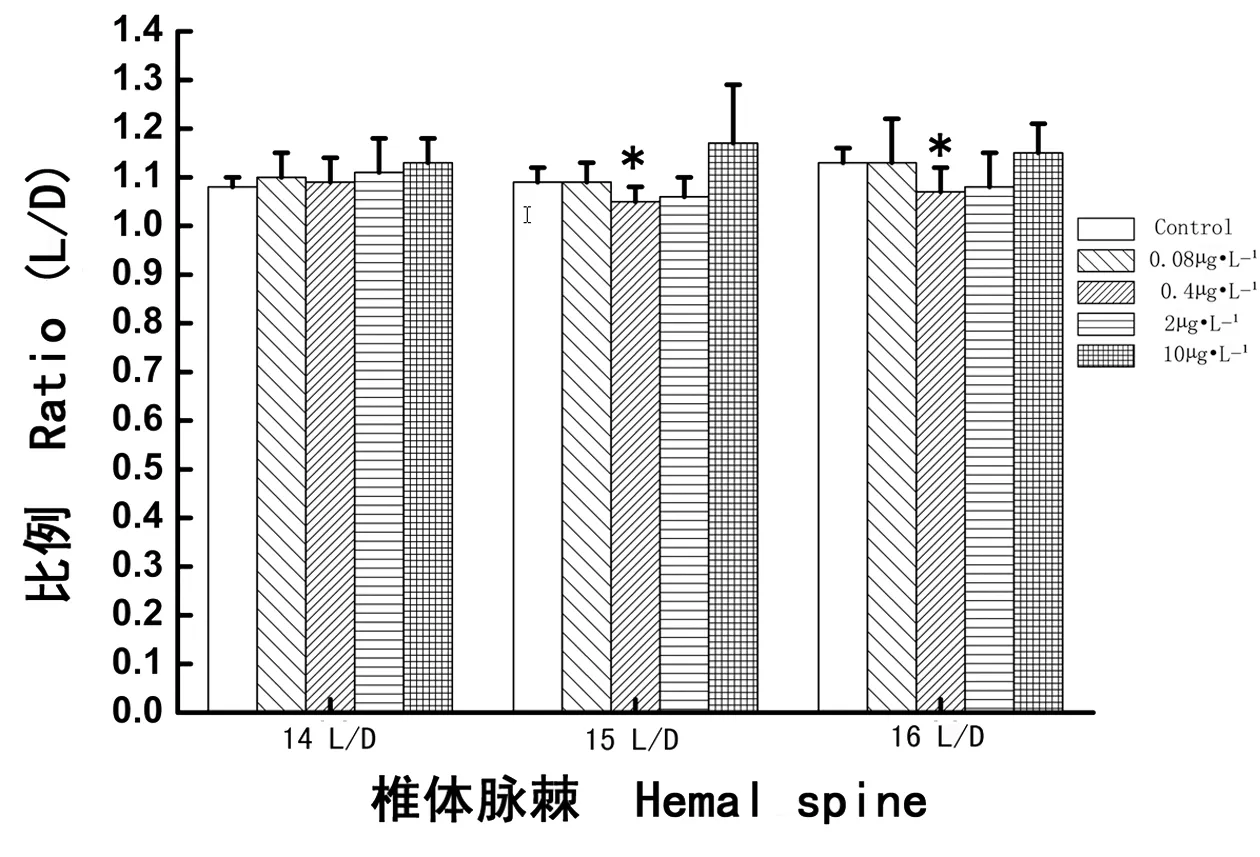
图6 多氯联苯暴露雌性食蚊鱼第14、15、16椎体脉棘长度与深度的比例(L/D)Fig. 6 The L/D ratio of 14th, 15th, 16th hemal spine in female mosquitofish exposed to PCBs
如图6所示,经过28 d PCBs暴露,0.4 μg·L-1实验组PCBs暴露分别致使雌性食蚊鱼的第15和第16椎体脉棘的L/D值降低,与对照组相比其变化分别具有显著性差异(分别P < 0.05),其他各PCBs浓度组变化不明显(分别P > 0.05)。结果显示,0.4 μg·L-1PCBs暴露显著地降低了雌性食蚊鱼第15和第16椎体脉棘的L/D值。
3 讨论(Discussion)
3.1 PCBs暴露对食蚊鱼CYP19α基因和VTGα基因表达的影响
PCBs是多种类似化合物的总称,有多种同分异构体,总共达209种,其中分为两大类,一大类是不共平面的,而另一种则是共平面的。这两大类PCBs所表现出的化学活性有较大区别。本次实验所使用的PCB 1248为不共平面的多氯联苯类型,在实验的2次取样中,雌性食蚊鱼的CYP19α和VTGα mRNA表达均受到抑制,PCBs对VTGα基因的抑制比对CYP19α基因的抑制更为明显。
Li等[20]以鼠睾丸间质细胞I-10和人的肾上腺皮质细胞H295R为实验对象,研究了多种PCBs对细胞内CYP19基因的表达情况,结果表明,PCB-126能够增加CYP19基因的表达,而不共平面的PCB-39则起抑制作用。对猪的卵细胞研究也表明,PCB-126能够增加雌二醇(E2)含量、芳香化酶活性,而PCB-153则起相反的作用[21-22]。共平面的PCBs,如PCB-126是生物体芳香烃受体(AhR)的激动剂[23]。它能够激活AhR的活性,使AhR与核芳香烃受体转位因子(Arnt)形成AhR-Arnt复合物,此复合物能够与某些基因上游的DNA转录元件相结合,从而影响基因的表达,如P450家族的一些基因[24]。而不共面PCBs虽然不是AnR的激动剂,但是可以和天然结合到核受体上的激动剂发生竞争作用,从而影响基因的表达[25]。本实验所使用PCB 1248含不共平面的PCBs。Li等[20]的研究表明,不共平面的PCBs,如PCB-39、PCB-153能够抑制细胞内CYP19基因的表达,与本实验的结果相一致,说明不共平面的PCBs能影响P450家族基因的转录水平。相反地,对P450家族其他基因的研究表明,似乎不共面的PCB对其影响可能不发生在转录期内。王伟等[26]以PCB 1211为材料,研究了其对小鼠肝微粒体CYP1A1酶活力的影响,未发现CYP1A1基因的mRNA表达。造成这种现象的原因可能是P450家族基因成员受影响的机制差异较大,也可能是由于PCBs结构的不同造成的。本实验表明,不共平面的多氯联苯能够抑制CYP19α基因的表达,并且随着时间和浓度的增加抑制作用增强。而本实验所采用的非共平面的PCBs对CYP19α基因的影响机制还有待继续深入地研究。
VTGα基因主要控制动物卵黄蛋白原(vitellogenin, VTG)的合成,与生物的生殖相关,已被广泛运用于外源激素对生物干扰的生物标志物。Hou等[27]、Xie等[28]的研究表明,野外受环境激素影响的食蚊鱼VTG α基因表达均受到影响。Calò等[5]研究了2种典型的PCBs短期暴露对金头鲷(Spaurus aurata)体内VTGα的影响,发现12 h的暴露,无论是PCB-126、PCB-153还是两者混合物的暴露,都能显著地增加肝脏VTGα的表达,而暴露24 h,VTGα的表达量却出现减少的现象,将暴露物移除48 h,VTGα的表达量又会显著地减少。结果显示暴露初期,PCBs表现出一定的雌激素效应,而随着暴露时间的增长,PCBs却表现出抗雌激素效应。本实验研究了长时间(28 d)PCBs暴露对食蚊鱼VTGα基因表达的影响,暴露14 d,实验设置的4个浓度PCBs均显著地抑制VTGα的表达,而暴露28 d,4个浓度PCBs亦均显著抑制VTG α基因的表达。这表明短时间的PCBs暴露和长时间的PCBs暴露对鱼类VTGα基因的影响是完全不相同的。这是由于随着暴露时间的增加,PCBs表现的不但是激素效应,更表现出PCBs的毒性效应,PCBs能通过代谢进入肝脏,对肝脏造成损伤,影响肝脏细胞的正常代谢[29],因此可能由于该暴露大大降低了肝脏合成VTG的能力,从而影响鱼类的正常代谢。然而PCBs对VTGα基因的作用机制,例如是直接作用于VTGα基因,还是与激素受体相结合,或是其他途径影响VTGα表达,还有待于作进一步深入地研究。
3.2 PCBs暴露对雌性食蚊鱼椎体脉棘骨骼发育的影响
食蚊鱼雌鱼和雄鱼从外形上容易分辨,因而被学者们用来指示河流中的内分泌干扰效应[30-31]。正常情况下,食蚊鱼雌鱼的椎体脉棘比雄鱼的要长,椎体脉棘至脊柱的距离也比雄鱼的要深,雌鱼的L/D值比雄鱼的也要大。当食蚊鱼受到外源激素的影响后,食蚊鱼的椎体脉棘长度L值和椎体脉棘到脊柱的深度D值均会发生变化,雄鱼第14、15、16椎体脉棘受激素影响的变化较大。范俊杰[32]的研究表明,雌性食蚊鱼暴露于含有雄性活性物质后,第14、15、16椎体脉棘骨骼的发育会发生变化,致使L值和D值也发生变化。本实验发现,雌性食蚊鱼的第15和16椎体脉棘发育受外界环境激素物质影响较为敏感,尤其是雌性食蚊鱼的第15椎体脉棘最为敏感。已有学者对食蚊鱼的近缘种Gambusia holbrooki其骨骼发育的过程进行了十分详细地观察,结果发现雄性G. holbrooki的第16椎体脉棘最先发育,紧随其后的是第14和第15椎体脉棘;将雄鱼暴露于雌激素化合物中,则这种发育将会变得缓慢[33-34]。但是最近张晓婵等[35]对捕自广州市海珠涌和黄埔涌各采样点食蚊鱼(G. affinis)样本观察的结果表明,成体雌性食蚊鱼的第15椎体脉棘对污染物(雄激素或类雄激素化合物)最敏感,其次为第16椎体脉棘,最后为第14椎体脉棘。对成体雄性食蚊鱼样本观察的结果也表明,水体的污染物对第15椎体脉棘的发育最为敏感,相对第14和第16椎体脉棘来说,第15椎体脉棘最先出现变化,并向后增生钩状骨质样组织。而本实验的结果也与以上报道的结果相一致。相对低浓度的PCBs(0.08 μg·L-1)暴露使雌性食蚊鱼的第15椎体脉棘的长度(L值)增长(图4),而对其D值无明显影响(图5);相对高浓度的PCBs(2 μg·L-1和10 μg·L-1)暴露致使雌性食蚊鱼的第15和第16椎体脉棘的L值和D值都显著性地增加(图4和图5),但L/D值则无明显变化(图6);0.4 μg·L-1PCBs暴露也显著地减低了雌性食蚊鱼的第15椎体脉棘的L值(图4),并且明显降低了第15和第16椎体脉棘的L/D比值(图6)。出现上述情况的原因可能是:①雌性食蚊鱼第15椎体脉棘比较敏感,受外界物质影响变化大;②长时间的PCBs暴露,其毒性可能会影响食蚊鱼椎体脉棘的发育,这可以解释高浓度的PCB暴露能影响雌性食蚊鱼椎体脉棘的L值和D值;③0.4 μg·L-1PCBs显著地降低了雌性食蚊鱼第15和第16椎体脉棘的L/D值,使雌鱼椎体脉棘出现形态雄性化的转化趋势,可能是长时间暴露,PCBs表现出的抗雌激素效应。
[1] 冯精兰, 刘相甫, 李怡帆, 等. 多氯联苯在我国环境介质中的分布[J]. 人民黄河, 2011, 33(2): 86-89
Feng J L, Liu X P, Li Y F, et al. The distribution of PCBs in China's environmental medium [J]. Yellow River, 2011, 33(2): 86-89 (in Chinese)
[2] 杜克久, 储少岗, 徐晓白, 等. 用MCF-7细胞增殖法研究国产多氯联苯的类雌激素效应[J]. 环境科学学报, 2000, 20(2): 230-233
Du K J, Chu S G, Xu X B, et al. Studies on the estrogenic effect of Chinese commercial PCBs by MCF-7 cell proliferation bioassay [J]. Acta Scientiae Circumstantiae, 2000, 20(2): 230-233 (in Chinese)
[3] 杨丽丽, 张晶, 方展强. 雌二醇、壬基酚、多氯联苯、镉和锌及其混合物对唐鱼的雌激素效应比较研究[J]. 水产学报, 2011, 35(6): 102-109
Yang L L, Zhang J, Fang Z Q. Comparative study of estrogenic effects of estradiol, nonylphenol, polychlorinated biphenyls, cadmium, zinc and its mixtures on Tanichthys albonubes [J]. Journal of Fisheries of China, 2011, 35(6): 102-109 (in Chinese)
[4] Vega-López A, Martínez-Tabche L, Domínguez-López M L, et al. Vitellogenin induction in the endangered goodeid fish Girardinichthys viviparus: Vitellogenin characterization and estrogenic effects of polychlorinated biphenyls [J]. Comparative Biochemistry and Physiology, Part C, 2006, 142(3-4): 356-364
[5] Calò M, Alberghina D, Bitto A, et al. Estrogenic followed by anti-estrogenic effects of PCBs exposure in juvenil fish (Spaurus aurata) [J]. Food and Chemical Toxicology, 2010, 48(8-9): 2458-2463
[6] Greytak S R, Champlin D, Callard G V. Isolation and characterization of two cytochrome P450 aromataseforms in killifish (Fundulus heteroclitus): Differential expressionin fish from polluted and unpolluted environments [J]. Aquatic Toxicology, 2005, 71(4): 371-389
[7] Kazeto Y, Place A R, Trant J M. Effects of endocrine disrupting chemicals on the expression of CYP19 genes in zebrafish (Danio rerio) juveniles [J]. Aquatic Toxicology, 2004, 69(1): 25-34
[8] Orrego R, McMaster M, Van Der Kraak G, et al. Effects of pulp and paper mill effluent extractives on aromatase CYP19a gene expression and sex steroid levels in juvenile triploid rainbow trout [J]. Aquatic Toxicology, 2010, 97(4): 353-360
[9] Halm S, Pounds N, Maddix S. Exposure to exogenous 17 beta-oestradiol disrupts P450aromB mRNA expression in the brain and gonad of adult fathead minnows (Pimephales promelas) [J]. Aquatic Toxicology, 2002, 60(3-4): 285-299
[10] Contractor R G, Foran C M, Li S F, et al. Evidence of gender- and tissue-specific promoter methylation and the potential for ethinylestradiol-induced changes in Japanese medaka (Oryzias latipes) estrogen receptor and aromatase genes [J]. Journal of Toxicology and Environmental Health Part A, 2004, 67(1): 1-22
[11] Kishida M, McLellan M, Miranda J A, et al. Estrogen and xenoestrogens upregulate the brain aromatase isoform (P450aromB) and perturb markers of early development in zebrafish (Danio rerio) [J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2000, 129(2-3): 261-268
[12] Rosen D E, Gordon M. Functional anatomy and evolution of male genitalia in Poeciliid fishes [J]. Zoologica, 1953, 38(1): 1-52
[13] 范俊杰, 黎紫兰, 徐少群, 等. 孕激素暴露致食蚊鱼形态雄性化的生物学效应[J]. 中国实验动物学报, 2014, 22(4): 31-36
Fan J J, Li Z L, Xu S Q, et al. The biological effects of morphological masculinization in mosquitofish (Gambusia affinis) exposed to progesterone [J]. Acta Laboratorium Animalis Scientia Sinica, 2014, 22(4): 31-36 (in Chinese)
[14] 谢勇平, 方展强. 利用食蚊鱼目标基因转录水平评价东莞寒溪河雌/雄激素物质污染现状[J]. 水生生物学报, 2013, 37(4): 691-697
Xie Y P, Fang Z Q. Evaluation of estrogen/androgen pollution by using the mosquitofish target gene expression in Hanxi River, Dongguan City [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 1-7 (in Chinese)
[15] 谢勇平, 方展强. 城市废水暴露致食蚊鱼形态雌/雄性化的生物学效应[J]. 生物灾害科学, 2015, 38(2): 106-113
Xie Y P, Fang Z Q. Urban sewage induces morphological feminization/masculinization in mosquitofish (Gambusia affinis) [J]. Biological Disaster Science, 2015, 38(2): 106-113 (in Chinese)
[16] 侯丽萍, 舒琥, 李强, 等. 利用食蚊鱼目标基因转录水平评价四会市邓村河雌/雄激素物质污染现状[J]. 安徽农业大学学报, 2015, 42(1): 152-158
Hou L P, Shu H, Li Q, et al. Evaluation of estrogen/androgen pollution by using the mosqueitofish target gene expression in Dengcun River, Sihui City [J]. Journal of Anhui Agricultural University, 2015, 42(1): 152-158 (in Chinese)
[17] Leusch F D L, Vanden Heuvel M R, Laurie A D, et al. Quantification of vitellogenin mRNA induction in mosquitofish (Gambusia affinis) by reverse transcription real-time polymerase chain reaction (RT-PCR) [J]. Biomarkers, 2005, 10(6): 429-438
[18] 贺争鸣, 李冠民, 邢瑞昌. 3R理论的形成、发展及在生命科学研究中的应用[J]. 实验动物科学与管理, 2000, 17(3): 43-47
He Z M, Li G M, Xing R C. The formation, development and application of 3R theory [J]. Laboratory Animal Science & Administration, 2000, 17(3): 43-47 (in Chinese)
[19] Rawson C, Lim R P, Warne M S J, et al. The effect of 17β-estradiol on the development of modified hemal spines in early life-stage Gambusia holbrooki [J]. Archives of Environmental Contamination and Toxicology, 2006, 51(2): 253-262
[20] Li L A. Polychlorinated biphenyl exposure and CYP19 gene regulation in testicular and adrenocortical cell lines [J]. Toxicology in Vitro, 2007, 21(6): 1087-1094
[21] Gregoraszczuk E L, Sowa M, Kajta M, et al. Effect of PCB 126 and PCB 153 on incidence of apoptosis in cultured theca and granulosa cells collected from small, medium and large preovulatory follicles [J]. Reproductive Toxicology, 2003, 17(4): 465-471
[22] Wojtowicz A K, Goch M, Gregoraszczuk E L. Polychlorinated biphenyls (PCB 153 and PCB 126) action on conversion of 20-hydroxylated cholesterol to progesterone, androstenedione to testosterone, and testosterone to estradiol 17beta [J]. Experimental and Clinical Endocrinology & Diabetes, 2005, 113(8): 464-470
[23] Safe S H. Polychlorinated biphenyls (PCBs): Environmental impact, biochemical and toxic responses, and implications for risk assessment [J]. Critical Review in Toxicology, 1994, 24(2): 87-149
[24] Mimura J, Fujii-Kuriyama Y. Functional role of AhR in the expression of toxic effects by TCDD [J]. Biochimica et Biophysica Acta, 2003, 1619: 263-268
[25] Bonefeld-Jorgensen E C, Andersen H R, Rasmussen T H, et al.Effect of highly bioaccumulated polychlorinated biphenyl congeners on estrogen and androgen receptor activity [J]. Toxicology, 2001, 158(3): 141-153
[26] 张伟, 刘丛强, 梁小兵, 等. 多氯联苯对小鼠肝微粒体CYP1A1酶活力及其mRNA表达的影响[J]. 毒理学杂志, 2007, 21(3): 255-260
Zhang W, Liu C Q, Liang X B, et al. Effects of PCBs on the activity of CYP1A1 and mRNA expression in mouse liver microsomal [J]. Journal of Toxicology, 2007, 21(3): 255-260 (in Chinese)
[27] Hou L, Xie Y, Ying G, et al. Developmental and reproductive characteristics of western mosquitofish (Gambusia affinis) exposed to paper mill effluent in the Dengcun River, Sihui, South China [J]. Aquatic Toxicology, 2011, 103(3-4): 140-149
[28] Xie Y P, Fang Z Q, Hou L P, et al. Altered development and reproduction in western mosquitofish (Gambusia affinis) found in the Hanxi River, Southern China [J]. Environmetal Toxicology and Chemistry, 2010, 29(11): 2607-2615
[29] 闫月明. 多氯联苯(Aroclor 1248)暴露对食蚊鱼CYP19α mRNA表达的影响及毒性效应研究[D]. 广州:华南师范大学, 2013
Yan Y M. Effects of PCBs (Aroclor 1248) exposure on the expression of gonadal cytochmme P450 aromatase (CYP19a) gene and the toxic effect in mosquitofish (Gambusia affinis) [D]. Guangzhou: South China Normal University, 2013 (in Chinese)
[30] Orlando E F, Bass D E, Caltabiano L M, et al. Altered development and reproduction in mosquitofish exposed to pulp and paper mill effluent in the Fenholloway River, Florida USA [J]. Aquatic Toxicology, 2007, 84(3): 399-405
[31] Angus R A, Weaver S A, Grizzle J M, et al. Reproductive characteristics of male mosquitofish (Gambusia affinis) inhabiting a small southeastern US river receiving treated domestic sewage effluent [J]. Environmental Toxicology and Chemistry, 2002, 21(7): 1404-1409
[32] 范俊杰. 雄激素和孕激素暴露对雌性食蚊鱼形态雄性化和生殖基因的影响[D]. 广州: 华南师范大学, 2012
Fan J J.Vitellogenin gene expression and morphological masculinization in female western mosquitofish (Gambusia affinis) exposed to androgens and progesterone [D]. Guangzhou: South China Normal University, 2012 (in Chinese)
[33] Rawson C A, Lim R P,Warne M St J, et al. The effect of 17β-estradiol on the development of modified hemal spines in early life-stage Gambusia holbroohi [J]. Archives of Environmental Contamination and Toxicology, 2006, 51(2): 253-262
[34] Rawson C A, Lim R P, Warne M St J. Skeletal morphology and maturation of male Gambusia holbroohi exposed to sewage treatment plant effluent [J]. Ecotoxicology and Environmental Safety, 2008, 70(3): 453-461
[35] 张晓婵, 温茹淑, 方展强. 广州河涌污水暴露致食蚊鱼骨骼形态雄性化的影响[J]. 动物学杂志, 2015, 50(6): 895-912
Zhang X C, Wen R S, Fang Z Q. Morphological masculinizing effects of bone morphogenetic in mosquitofish (Gambusia affinis) exposed to municipal wastewater in Guangzhou creek [J]. Chinese Journal of Zoology, 2015, 50(6): 895-912 (in Chinese)
◆
Effects of PCBs Exposure onCYP19α,VTGα Gene Expression and Morphological Masculinizing of Bone Morphogenesis in Mosquitofish (Gambusiaaffinis)
Yan Yueming, Fang Zhanqiang*
Key Laboratory of Ecology and Environmental Science in Guangdong Higher Education, College of Life Science, South China Normal University, Guangzhou 510631, China
The cytochrome P450 aromatase (CYP19α) and vitellogenin (VTGα) genes mRNA transcriptional levels in mosquitofish (Gambusia affinis) were detected in order to investigate the effects of trace PCBs on the CYP19α and VTGα expression in the adult female G. affinis for long time exposure, and evaluate its effect on the morphological masculinization in female G. affinis. G. affinis were randomly divided into five groups, with one control group and four experimental groups (0.08, 0.4, 2 and 10 μg·L-1PCBs). Parallel experimental groups were also established. The CYP19α and VTGα mRNA expression levels in fish gonad and liver tissues were determined after 14 and 28 d exposure, respectively. The effect of PCBs on the development of hemal spine was also detected. The exposure experiment results showed that: ① different concentrations of PCBs group (0.08, 0.4, 2 and 10 μg·L-1PCBs) exposure could inhibit the G. affinis CYP19αand VTGα gene expression, which suggested that the inhibition of PCBs on G. affinis VTGα gene was far greater than the inhibition of G. affinis CYP19α gene; ② 0.4 μg·L-1PCBs exposure significantly reduced the length (L) of 15th haemal spine, and reduced the L/D ratio of 15th and 16th haemal spine in G. affinis, which appeared masculinization of skeletal morphology. These showed that a certain concentration of PCBs exposure would show anti estrogen effect.
polychlorinated biphenyl (PCBs); Gambusia affinis; CYP19α; VTGα; mRNA expression; hemal spine; morphological masculinization
10.7524/AJE.1673-5897.20151109002
广东高校城市水环境生态治理与修复工程技术研究中心建设项目(No. 2012gezxA004)
闫月明(1986-),男,硕士,研究方向为水生动物生态毒理学,E-mail: Yanyueming198615@126.com;
*通讯作者(Corresponding author), E-mail: fangzhq@scnu.edu.cn
2015-11-24 录用日期:2015-12-22
1673-5897(2016)2-257-09
Q785; S917; X171.5
A
简介:方展强(1953-),男,教授,博士生导师,主要研究方向水生动物生态毒理学,发表学术论文170余篇。
闫月明, 方展强. 多氯联苯暴露对食蚊鱼CYP19α和VTGα基因的表达及骨骼形态雄性化的影响[J]. 生态毒理学报,2016, 11(2): 257-265
Yan Y M, Fang Z Q. Effects of PCBs exposure on CYP19α,VTGα gene expression and morphological masculinizing of bone morphogenetic in mosquitofish (Gambusia affinis) [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 257-265 (in Chinese)
