肝癌患者血清和组织中prohibitin的表达及其临床意义
2016-12-12石娟娟杨宁吴凤萍杨颖李梅张欣贾晓黎尹佳锋党双锁
石娟娟 杨宁 吴凤萍 杨颖 李梅 张欣 贾晓黎 尹佳锋 党双锁
·论 著·
肝癌患者血清和组织中prohibitin的表达及其临床意义
石娟娟 杨宁 吴凤萍 杨颖 李梅 张欣 贾晓黎 尹佳锋 党双锁
目的 研究抑制素prohibitin(PHB)在肝癌患者血清和组织中的表达及其临床意义。方法 应用双抗体夹心ELISA法检测肝癌患者和健康人各82例血清PHB浓度。应用RT-PCR和免疫组织化学的方法检测PHB在30例肝癌患者组织、癌旁组织和正常肝组织中的表达水平。同时,收集肝癌患者的临床资料,分析PHB表达与各临床参数之间的相关性。结果 PHB在肝癌患者和健康人血清中浓度分别为227.97 pg/mL和55.78 pg/mL,肝癌患者血清PHB浓度明显高于健康人(Z=-4.532,P=0.000);肝癌患者血清中的PHB浓度与ALT、TBil、AFP呈正相关(r=0.337,P=0.034;r=0.431,P=0.006;r=0.319,P=0.045)。在肝癌组织和癌旁组织中PHB蛋白阳性表达率分别为73.3%和86.7%,与正常肝组织(6.7%)比较,差异有统计学意义;在肝癌组织和癌旁组织中PHB mRNA的表达较正常组织亦明显升高;肝癌组织中PHB表达与肿瘤分化程度、TNM分期和AFP含量相关,即肿瘤低分化、TNM Ⅲ~Ⅳ期、AFP≥400 μg/L的肿瘤组织中PHB表达明显升高,差异有统计学意义。结论 PHB在肝癌患者血清和组织中均高表达,分别与肝脏损伤的程度和HCC恶性程度相关,提示PHB可能参与HCC的发生和发展。
抑制素;肝细胞性肝癌;甲胎蛋白;血清;组织
抑制素(prohibitin,PHB)是重要的细胞膜蛋白超家族成员之一,广泛高表达于多种肿瘤组织中,参与抑制细胞增殖、调控细胞周期、诱导细胞凋亡、维持细胞内稳态等诸多细胞生命活动[1, 2]。越来越多的研究发现,PHB在一些肿瘤细胞中表达增强,如肝癌、胃肠癌、胰腺癌、子宫颈癌、前列腺癌等[3-7]。我们前期研究发现,PHB在人肝癌细胞株Huh 7和SMMC-7721中均有表达且在SMMC-7721细胞中表达量较高[8],提示PHB可能和肿瘤的发生发展有着密切的关系。因此,本研究通过检测肝癌患者血清中PHB的表达水平,探讨PHB在肝癌发生发展过程中的临床意义。
资料和方法
一、研究对象
血清标本为2015年3月至2016年3月西安交通大学第二附属医院感染科住院肝癌患者82例,其中男63例,女19例,平均年龄(48.4±13.3)岁,排除术前进行过抗肿瘤治疗或有其他恶性肿瘤证据的患者。健康对照者82例来自健康体检部,其中男59例,女23例,平均年龄(46.8±11.4)岁。组织标本为2013年11月至2015年10月普外科住院的肝癌患者30例,其中男21例,女9例,平均年龄(50.5±14.3)岁;均经过两名病理学家进行组织学评估证实,排除术前进行过抗肿瘤治疗或有其他恶性肿瘤证据的患者。选出最具代表性的肿瘤组织和癌旁组织,同一患者的非肿瘤性肝组织标本作为阴性对照。该研究经西安交通大学第二附属医院伦理委员会审核通过,标本收集取得患者本人或家属同意。
二、主要试剂与仪器
prohibitin酶联免疫分析试剂盒(R&D systems,美国);E.Z.N.A.○RTotal RNA Kits(Omega,美国);AMV Reverse Transcriptase (RT) kit,SYBR○RPremix ExTaqⅡkit(TAKARA,日本);兔抗prohibitin蛋白抗体(Santa,美国);羊抗兔二抗(ABGENT,美国)。实时定量PCR仪(Bio-Rad,美国)、普通倒置显微镜(Nikon,日本)、全自动酶标仪(Thermo Fisher,美国)等。
三、肝功能和AFP的检测
肝功能检查采用全自动生化分析仪(日立7170型,日本),AFP采用酶联免疫分析试剂盒进行检测。
四、ELISA法检测血清PHB的含量
采用prohibitin酶联免疫分析试剂盒进行检测,具体步骤如下:设置标准品孔和样本孔,同时设三个复孔,标准品孔各加不同浓度的标准品50 μL;样本孔先加待测样本10 μL,再加样本稀释液40 μL;同时设置空白孔,空白孔加入50 μL样本稀释液。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的抗体100 μL,37 ℃恒温箱孵育60 min。弃去液体,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复5次。每孔加入底物A、B各50 μL,37℃避光孵育15 min。每孔再加入终止液50 μL,在450 nm波长处检测各孔的A值。根据标准品A值绘制标准曲线,按曲线方程计算各样本浓度值(pg/mL)。
五、实时定量PCR
采用E.Z.N.A.○RTotal RNA Kits说明书提取组织总RNA;按AMV反转录试剂盒说明书操作,取1 μg RNA反转录成cDNA;按SYBR○RPremix ExTaqⅡ kit实时定量PCR试剂盒说明书进行操作,以GAPDH做内参。25 μL反应体系为12.5 μL 2×SYBR ExTaqⅡ、2 μL cDNA、1 μL上游引物(10 μmol)、1 μL下游引物(10 μmol)、8.5 μL无RNA酶水。反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 60 s,72 ℃ 60 s,40次循环。按ΔΔCT=2-(Ct目的基因-Ct GAPDH)计算。实验重复6次。PHB上游引物:5′-CGTAATGTGCCAGTCATCA-3′,PHB下游引物5′-AGTTCTCCAGCATCAAAGC-3′。GAPDH上游引物:5′-GCACCGTCAAGGCTGAGAAC-3′,GAPDH下游引物5′-TGGTGAAGACGC AGTGGA-3′。
六、免疫组织化学法检测组织中PHB的表达
手术切除标本离体后均立即取材,经4%多聚甲醛固定,常规石蜡包埋,制成5 μm厚的连续切片。具体操作步骤:放置组织切片于烤箱,68 ℃ 20 min;常规二甲苯脱蜡,梯度乙醇脱水;采用0.01 mmol/L枸橼酸缓冲液高温抗原热修复15 min,冷却至室温;3% H2O237 ℃孵育20 min以阻断灭活内源性过氧化物酶;正常羊血清工作液封闭30 min;依次滴加一抗4 ℃过夜,滴加生物素标记的二抗37 ℃孵育20 min;滴加辣根过氧化物酶标记的链霉素卵白素工作液37 ℃孵育30 min;DAB显色,苏木素复染,常规脱水、透明、干燥,封片;倒置显微镜观察并拍照。染色结果判定,由两名病理学家进行独立评估。在显微镜下,随机选取3个高倍视野(×400),计算阳性细胞比率(阳性细胞数/肿瘤细胞总数)和染色强度,根据两者进行评分。阳性细胞比率<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分;染色强度:无着色0分,淡黄色1分,棕黄色2分,棕褐色3分;两项结果相加≥3分为阳性。
七、统计学处理
采用SPSS 17.0统计学软件处理。计量资料用均数±标准差表示,采用W检验 (Shapiro-Wilk) 检测数据正态性;偏态分布数据以中位数表示。组间差异性比较采用t检验和秩和检验,率的比较采用χ2检验,相关性分析采用Spearman相关性检验,以P<0.05为差异有统计学意义。
结 果
一、PHB在肝癌患者血清中的表达情况
经ELISA法检测可知,原发性肝癌患者血清PHB含量为227.97(36.99~ 639.83)pg/mL,健康人血清含量为55.78(26.06~70.30)pg/mL,差异有统计学意义(Z=-4.532,P=0.000)。
二、PHB在肝癌患者血清中的含量与临床资料的关系
肝癌患者血清中的PHB浓度与患者年龄、性别、AST、γ-GT、ALP均无相关性,而与ALT、TBil、AFP具有相关性(P<0.05),并且呈正相关,即肝癌患者ALT、TBil、AFP值越高,PHB浓度越高,见表1。
三、PHB在肝癌患者组织中的表达情况
PHB在各组肝组织中均有表达,主要表达与胞质和胞核中,随表达强度不同,可依次表现为淡黄、棕黄至棕褐色不等,散在或团簇状分布(见图1A)。在肝癌组织和癌旁组织中PHB蛋白阳性表达率分别为73.3%和86.7%,与正常肝组织(6.7%)比较,差异有统计学意义,见表2。同时,在肝癌组织和癌旁组织中PHB mRNA的表达较正常组织明显升高,差异有统计学意义,见图1B。
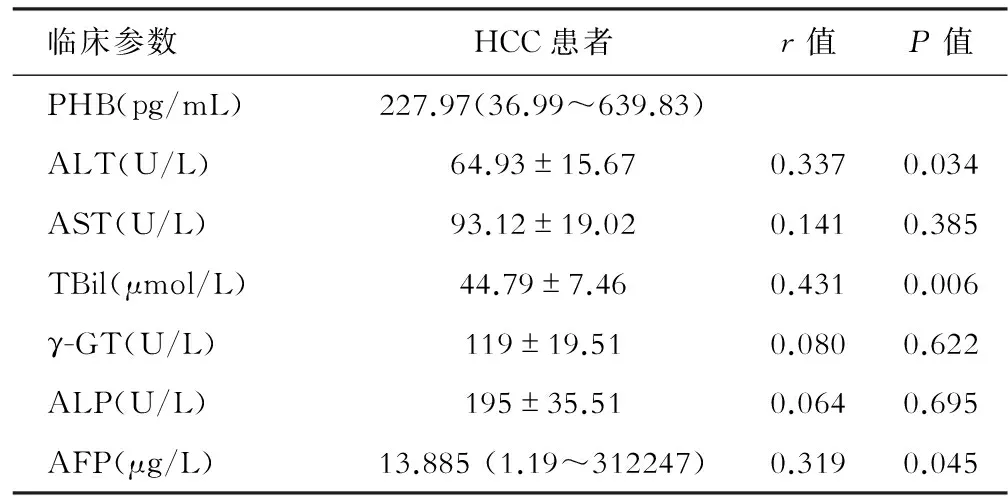
表1 肝癌患者血清中PHB含量与临床资料相关性分析
注:ALT:丙氨酸转氨酶,AST:天冬氨酸转氨酶, TBil:总胆红素,γ-GT:谷酰转肽酶, ALP:碱性磷酸酶,AFP:甲胎蛋白
四、PHB在肝癌患者组织中的表达与临床病理因素的关系
PHB在肝癌组织中的表达与肝癌患者的性别、年龄、肿瘤直径、肝外是否转移、门静脉是否存在癌栓均无关,差异无统计学意义。而PHB表达与肝癌患者的肿瘤分化程度、TNM分期和AFP含量相关,即肿瘤低分化、TNM Ⅲ~Ⅳ期、AFP≥ 400 μg/L的肿瘤组织中PHB表达明显升高,差异有统计学意义。见表3。

图1 PHB在肝癌患者组织中的表达情况

组别例数PHB蛋白(例,%)+-χ2值P值正常肝组织302(6.7)28(93.3)癌旁组织 3022(73.3)8(26.7)30.2400.000肝癌组织 3026(86.7)4(13.3)38.5710.000

表3 肝癌患者肝脏组织中PHB含量
讨 论
蛋白质是机体生物功能的主要承担者,任何疾病发生发展过程中表达异常的蛋白一定与该疾病的致病机制之间存在着某种联系。在肝癌的发生发展过程中,组织蛋白的异常表达的作用不容忽视[9]。因此,寻找表达异常的蛋白并研究其功能是探索肝癌致病机制的热点和难点。
近年来,越来越多的研究发现,在各种肿瘤中PHB蛋白表达异常,引起了广泛关注。研究显示,PHB基因敲除会抑制人肝癌细胞株PLC/PRF/5凋亡和扩散,其作用机制依赖于NF-κB的信号转导途径;同时发现PHB在维护细胞的转化表型和浸润表型中扮演着重要的角色[10]。PHB在高转移性肝癌细胞株MHCC97-H中高表达,高表达的PHB进一步抑制细胞增殖和增加肿瘤细胞迁移性[11]。进而提示PHB可能在肝癌的发生发展以及发病机制中起着重要作用。但是,目前PHB作为一种潜在的抑制肿瘤增殖的基因在肝癌患者血清和组织中的mRNA和蛋白水平的表达情况研究鲜见,尚缺少足够的临床证据。本研究通过检测肝癌患者的血清和组织中PHB的表达以及分析其与临床参数相关性,发现肝癌患者血清PHB浓度明显高于正常人,并且与ALT、TBil、AFP均呈正相关,即肝癌患者ALT、TBil、AFP值越高,PHB浓度越高,提示PHB可能与肝脏损伤的程度相关,肝损伤越重,PHB浓度越高。这与Ren等[12]的研究相似,其研究结果显示通过采用蛋白质组学的方法发现PHB在胃癌患者血清组织中表达显著增高。
本实验结果显示,PHB mRNA和蛋白在肝癌组织和癌旁组织的表达均高于正常肝组织,差异有统计学意义,提示PHB mRNA与其蛋白的变化在这三种肝组织间相一致,表明PHB蛋白变化是因为PHB基因转录变化的结果。进而证实PHB在肝癌组织中表达上调,可能参与肝癌的发生和发展。Kang等[13]研究显示,与癌旁正常组织比较,胃癌组织PHB mRNA和蛋白水平显著升高,其表达水平与肿瘤的恶性程度呈正相关。作者推测PHB表达水平亦可能与肝癌恶性程度相关,本实验中PHB表达水平与肝癌的肿瘤分化程度、TNM分期和AFP含量相关,即肿瘤低分化、TNM Ⅲ~Ⅳ期、AFP≥ 400 μg/L的肿瘤组织中PHB表达明显升高,提示PHB表达水平与肝癌恶性程度相关。
本实验中发现肝癌患者的血清和组织中PHB的表达均上调,证实了PHB可能参与肝癌的发生和发展。而血清中PHB表达与ALT、TBil、AFP均呈正相关,组织中PHB表达与肝癌的肿瘤分化程度、TNM分期和AFP含量相关,进一步证实了PHB的表达水平可能与肝脏损伤的程度和肝癌恶性程度相关。本研究为PHB参与肝癌的发生和发展提供了一定的基础和实验依据,但是PHB在肝癌发生发展中具体的作用机制尚不清楚,尚需要进一步深入研究。
[ 1 ] Rizwani W, Alexandrow M, Chellappan S. Prohibitin physically interacts with MCM proteins and inhibits mammalian DNA replication. Cell Cycle, 2009, 8: 1621-1629.
[ 2 ] Zhou TB, Qin Y. Signaling pathways of prohibitin and its role in diseases. J Recept Signal Transduct Res, 2013, 33:28-36.
[ 3 ] Ko KS, Tomasi ML, Iglesias-Ara A, et al. Liver-specific deletion of prohibitin 1 results in spontaneous liver injury, fibrosis, and hepatocellular carcinoma in mice. Hepatology, 2010, 52:2096-2108.
[ 4 ] Zhang Y, Chen Y, Qu C, et al. siRNA targeting prohibitins inhibits proliferation and promotes apoptosis of gastric carcinoma cell line SGC7901 in vitro and in vivo. Cell Mol Biol (Noisy-le-grand),2014, 60:26-32.
[ 5 ] Guan X, Liu Z, Wang L, et al. Identification of prohibitin and prohibiton as novel factors binding to the p53 induced gene 3 (PIG3) promoter (TGYCC)(15) motif. Biochem Biophys Res Commun, 2014, 443:1239-1244.
[ 6 ] Sato S, Murata A, Orihara T, et al. Marine natural product aurilide activates the OPA1-mediated apoptosis by binding to prohibitin. Chem Biol, 2011,18:131-139.
[ 7 ] Zhong N, Cui Y, Zhou X, et al. Identification of prohibitin 1 as a potential prognostic biomarker in human pancreatic carcinoma using modified aqueous two-phase partition system combined with 2D-MALDI-TOF-TOF-MS/MS. Tumour Bio, 2015,136:1221-1231.
[ 8 ] 党双锁,孙明珠,寻萌,等. 抑制素在人肝癌细胞SMMC-7721和Huh-7中的表达及其编码序列扩增. 中国肝脏病杂志(电子版), 2010, 2: 1-5.
[ 9 ] Diamond DL, Proll SC, Jacobs JM, et al. HepatoProteomics: applying proteomic technologies to the study of liver function and disease. Hepatology, 2006, 44:299-308.
[10] Sanchez-Quiles V, Santamaria E, Sequra V, et al. Prohibitin deficiency blocks proliferation and induces apoptosis in human hepatoma cells: molecular mechanisms and functional implications. Proteomics, 2010, 10:1609-1620.
[11] Xu Z, Wu J, Zha X. Up-regulation of prohibitin1 is involved in the proliferation of liver cancer cells. Sci China Life Sci, 2011, 54:121-127.
[12] Ren H, Du N, Liu G, et al. Analysis of variabilities of serum proteomic spectra in patients with gastric cancer before and after operation. World J Gastroenterol, 2006, 12: 2789-2792.
[13] Kang X, Zhang L, Sun J, et al. Prohibitin: a potential biomarker for tissue-based detection of gastric cancer. J Gastroenterol, 2008, 43: 618-625.
(本文编辑:钱燕)
Clinical significances and expressions of prohibitin in patients with hepatocellular carcinoma
SHIJuan-juan,YANGNing,WUFeng-ping,YANGYing,LIMei,ZHANGXin,JIAXiao-li,YINJia-feng,DANGShuang-suo.
DepartmentofInfectiousDiseases,theSecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China
Correspondingauthor:DANGShuang-suo,Email:dang212@126.com
Objective To investigate serum and tissue expressions and the clinical significances of prohibitin in patients with hepatocellular carcinoma (HCC). Methods Serum PHB levels in 82 HCC patients and 82 healthy individuals were determined by ELISA assay. The expression of PHB in the 30 pairs of HCC tissues, paracancerous tissues and normal tissues were detected by real-time PCR and immunohistochemistry assay. The clinical data were collected to determine the correlation between PHB and clinical features. Results Serum PHB protein level in HCC patients was significantly increased when compared with healthy individuals group (227.97 vs. 55.78 pg/mL, Z= -4.532,P=0.000). The expression of PHB in HCC patients had positive correlation with alanine aminotransferase (ALT,r=0.337,P=0.034), total bilirubin (TBil,r=0.431,P=0.006) and AFP (r=0.319,P=0.045). The positive rate of PHB in HCC tissues and paracancerous tissues were 73.3% and 86.7% that were significantly higher than that of the normal tissues, respectively. The PHB mRNA expression in HCC tissues and paracancerous tissues were also higher than that of the normal tissues. The expression of PHB in HCC patients had correlation with differentiation grade, TNM stage and AFP. Conclusion PHB is overexpressed in HCC patients tissues and serum and correlated with the degree of liver injury and tumor malignancy, indicating that PHB may be involved in the occurrence and progression of HCC.
Prohibitin; Hepatocellular carcinoma; AFP; Serum; Tissue
国家自然科学基金资助项目(31500650)
710004 西安交通大学第二附属医院感染科(石娟娟,杨宁,吴凤萍,杨颖,李梅,张欣,贾晓黎,党双锁),检验科(尹佳锋)
党双锁,Email: dang212@126.com
2016-08-12)
