南极鱼Ⅲ型抗冻基因真核表达质粒的构建及其细胞表达
2016-12-08陈良标
杨 敏,黄 巧,陈良标
(上海海洋大学 水产与生命学院 水产种质资源发掘与利用省部共建教育部重点实验室,上海201306)
南极鱼Ⅲ型抗冻基因真核表达质粒的构建及其细胞表达
杨 敏,黄 巧,陈良标*
(上海海洋大学 水产与生命学院 水产种质资源发掘与利用省部共建教育部重点实验室,上海201306)
为了探讨多聚AFPⅢ的作用机制,从南极鱼Lycodichthysdearborni的多聚三型抗冻蛋白基因LD12cDNA中克隆得到AFPⅢ的四聚体,命名为LD4,并构建真核表达质粒Tol2-actin-LD4-2A-EGFP。将表达质粒转染到斑马鱼细胞系ZF4中,发现LD4可以在ZF4中大量表达并且能够减少斑马鱼细胞在低温胁迫下的死亡率。通过对不同处理温度(28、18、10℃)下的WT、EGFP和LD4细胞进行转录组测序分析,找出26个表达差异转录因子,其中I3MB13、ZNF687b等表达上调,JUN、Cremb等表达下调,并且通过荧光定量PCR的验证。通过KEGG pathway分析发现,这些差异性基因主要参与细胞凋亡、细胞周期、增殖等调节通路。采用 Annexin V-PE/7-AAD双染色法对3种不同温度下的WT、EGFP和LD4细胞进行细胞凋亡检测,结果显示,LD4在低温下与对照组相比凋亡率没有显著差异,说明LD4可能是通过其他通路而不是通过抑制细胞凋亡来抵御低温胁迫,这为LD4作用机制的进一步研究提供了理论基础。
多聚Ⅲ型抗冻蛋白;斑马鱼细胞系;转录组测序;细胞凋亡
抗冻蛋白(antifreeze proteins,AFPs)存在于很多种生物体中,如鱼类、昆虫、植物、细菌和真菌。抗冻蛋白分子具有扩展性质,立体结构上有一块极易与冰晶水分子相互作用的表面区域,从而阻止冰晶的进一步生长,进而非线性地降低溶液的冰点,但不影响溶液的熔点,这导致熔点与冰点之间出现差值,这一现象被称为热滞效应(thermal hysteresis activity,THA)[1]。生活于地球南北两极的鱼类依靠体内特殊的抗冻蛋白使体液的冰点降低到环境温度以下,从而使它们的体液保持液体状态,保护细胞不被冰晶伤害。
目前在极地的鱼中已经发现了5种不同类型的抗冻蛋白[2],其中Ⅲ型抗冻蛋白(AFPⅢ)起源于唾液酸合成酶。Ⅲ型抗冻蛋白是一个64个氨基酸组成的具有一个球形分子结构域(AFPⅢ domain)的分子[3],有5个(Gln9、Asn14、Thr15、Thr18、Gln44)主要的保守亲水残基组成了一个冰晶结合平面,这一平面可能与水分子形成氢键而抑制冰晶的生长。Wang等[4]从南极Lycodichthusdearborni(LD)的血液中发现了一种135个氨基酸,具有2个AFPⅢ domain的蛋白,命名RD3。研究表明,单位重量的LD2抑制冰晶的能力超过单个结构域的AFP Ⅲ(RD1和RD2)[5]。Nishimiya等[6]以L.dearborni中自然存在的AFPⅢ二聚体RD3的N端和C端作为单体,按照14ku二聚体抗冻蛋白的组成方式,人工合成含有不同数量的N端或C端单体的AFPⅢ的二聚体、三聚体和四聚体,通过热滞后活性和冰晶形态的测定发现,同一溶度下分子量大的AFPⅢ抗冻活性明显得到提高。在这种鱼中克隆AFP Ⅲ基因家族发现,L.dearborni鱼内的抗冻蛋白基因存在一种多结构域化的分子进化的现象。除了大部分基因编码含一个AFPⅢ结构域的基因外,还有分别编码2个结构域[7]和12个结构域的基因,这种多结构域化的进化趋势可能赋予含有该基因的鱼类具有更高效的抗冻效果。
本实验室一直致力于研究在南极酷寒环境下,南极鱼的适应性进化和抗寒的分子机制,并且在2004年发现了LD12。LD12是一个287kb的cDNA克隆,由12个串联重复的片段构成,每一个片段编码一个61个氨基酸(aa)的Ⅲ型抗冻蛋白分子和一个9aa的连接子[8]。因此,这种独特的多聚基因结构可能是鱼类基因组在适应极端寒冷的环境中采取的一种普遍方式。为了阐述AFPⅢ多聚化对动物耐寒性的影响,本试验从南极鱼L.dearborni的多聚三型抗冻蛋白基因LD12cDNA中克隆得到四聚体(LD4),以斑马鱼细胞ZF4为体系,从存活率、表达差异转录因子分析和细胞凋亡等方面对LD4基因的作用机制做了初步的探讨,以期为以后的研究提供一定基础。
1 材料与方法
1.1 材料
1.1.1 材料
南极鱼绵鳚科(L.dearborni)从南极McMardo海湾通过铁网诱捕获得并保存于液氮中运回。
1.1.2 试剂及试剂盒
转染试剂(Thermo Scientific TurboFect),细胞培养基(Hyclone 公司),胎牛血清(Gibco 公司),限制性内切酶BamHⅠ、EcoRⅠ (NEB公司),台酚蓝染色试剂盒(生工),凋亡试剂盒(BD Biosciences)。
1.2 方法
1.2.1 构建载体中的引物设计
采用Premier 6.0软件设计引物,并在引物的5′端添加限制性内切酶EcoRⅠ和BamHⅠ的酶切位点。引物序列F: CGAATTCATGAAGTCAGTTGT;R:GGATCCCTCATAGTTTGGATC。
1.2.2 细胞的复苏、传代及冻存
从液氮中取出冻存细胞立即放入28℃水浴,快速融解后1000r·min-1离心5min,弃上清,加入5mL含10%胎牛血清和1%双抗的DMEM/F12培养基,吹吸混匀后移入培养皿于28℃、5% CO2培养箱中培养,当细胞达到80%融合时以1∶2进行传代。选3~6代细胞以5×106mL-1进行冻存,冻存前一天更换新鲜培养基,冻存液为10% DMSO+90%完全培养基,冻存过程为4℃(30min)、-20℃(30min)、-80℃过夜后投入液氮长期保存。
1.2.3 ZF4细胞系转染及稳定细胞系的获得
挑取测序正确的单菌落扩大培养后,用无内毒素质粒大提试剂盒提取质粒后于-20℃保存。转染前24h,于24孔板中,每孔加入5×104个细胞,放入1mL DMEM/F12培养基(含10%胎牛血清和1%双抗),吹吸混匀后移入28℃、5% CO2培养箱中培养。当细胞达到70%~90%汇合度时,将1μg 质粒DNA和100μL无血清培养基混匀,然后加入2μL转染试剂,充分混匀。室温中放置15~20min,形成转染复合物。然后把转染复合体缓缓加入到每孔的培养液中,轻摇培养板,混匀后,28℃培养箱中置7~9h。更换新鲜的含血清和双抗的培养基,于培养箱内培养48h后置于倒置荧光显微镜下观察绿色荧光信号。
转染过后的ZF4细胞进行24孔扩大培养,加入G418筛选成功转染质粒的细胞,方法为:首先要确定G418的致死浓度,本试验G418致死浓度为1000mg·mL-1,筛选一周后药量减半,维持浓度500mg·mL-1直到大部分未成功转染细胞死亡,并且转染成功细胞进行了扩大培养,药物筛选时间大概要2~3周。
1.2.4 台盼蓝测细胞存活率
胰酶消化斑马鱼细胞,制备单细胞悬液,并作适当稀释。细胞悬液与0.4%台盼蓝溶液以9∶1混合混匀(终浓度0.04%)。在2min内,用全自动细胞计数分析仪计算细胞存活率。
1.2.5 低温处理后RNA sequence分析
把WT、EGFP、LD4细胞设置不同的温度梯度进行低温处理。处理温度为28℃、18℃ 2d,18℃ 2d然后10℃ 2d。低温处理后分别对细胞进行RNA提取,然后进行建库和测序分析。
1.2.6 流式细胞仪进行凋亡检测
把WT、EGFP、LD4细胞分别放在28℃、18℃,2d、18℃2d然后10℃处理2d 后,用流式细胞仪进行检测分析。方法:(1)用不含EDTA的胰酶消化后于300g,4℃离心5min收集细胞。胰酶消化时间不宜过长,以防引起假阳性;(2)用预冷的PBS洗涤细胞2次,每次均在300g,4℃离心5min,收集1×105~5×105细胞;(3)加入100μL 1×Binding Buffer重悬细胞;(4)加入5μL PE Annexin V和5μL 7-AAD,轻轻混匀;(5)避光、室温反应10min;(6)加入400μL 1×Binding Buffer,轻轻混匀,样品在1h内用流式细胞仪检测。
2 结果与分析
2.1 真核表达质粒的构建及鉴定
以Tol2转座子的质粒载体骨架为基础,构建了斑马鱼细胞系表达载体(图1-A)。表达载体通过菌液PCR的验证(图1-B),同时通过菌落测序后,确认连接方向正确。经EcoRⅠ和BamHⅠ双酶切后出现分子量分别为7.2kb 和0.89kb 的2条带,正好与质粒载体和LD4基因的分子量一致(图1-C),证实表达载体Tol2-actin-LD4-2A-EGFP构建成功。

A,斑马鱼细胞系表达载体图谱;B,菌液PCR鉴定;C,EcoRⅠ和BamHⅠ双酶切鉴定A,Zebrafish cell expression vector map; B,Identification of bacteria PCR; C,double enzyme digestion of LD4gene in eukaryotic expression vector
2.2 表达载体转染斑马鱼细胞及蛋白表达
表达载体LD4和EGFP转染到斑马鱼细胞系ZF4中,显微镜下观察到绿色荧光(图2-A)。用抗LD4抗体进行Western Blot 检测(图2-B),证明LD4蛋白在ZF4细胞中高效表达。
2.3 台盼蓝测定低温处理后存活率的结果
利用台盼蓝技术,把LD4、EGFP、WT在28℃培养箱中放置过夜后,将其放入10℃低温培养箱2和3d,染色后记录下存活率。结果显示,与EGFP、WT相比,转LD4斑马鱼细胞存活率高(图3)。

A,荧光显微镜下(20×10)观察表达载体转染斑马鱼细胞图 (a、b分别为转染LD4细胞明场、荧光,c、d分别为转染EGFP细胞明场、荧光);B,为斑马鱼细胞系中LD4蛋白的Western Blot 检测,泳道从左到右分别是转染LD4、EGFP、WT的细胞裂解液A,The expression of LD4gene in zebrafish cell lines(a,b: normal light and green light of LD4cell,c,d: Normal light and green light of EGFP cell); B,The Western Blot detection of LD4,the lanes from left to right were cell lysates of transfected p-LD4-EGFP,the cell lysates of transfected with empty vector and wild type cells,respectively
2.4 转录组测序结果分析及实时定量PCR鉴定
对不同处理温度下(28℃、18℃、18℃后10℃)的WT、EGFP和LD4细胞进行转录组测序分析,找出了26个表达差异转录因子,其中I3MBT13、ZNF687b等表达上调,JUN、Cremb等表达下调(图4-A)。并且找出基因表达差异较大,通过荧光定量PCR进行验证(图4-B)
2.5 用流式细胞术检测凋亡的分析结果
我们通过转录组数据分析发现,低温的条件下,有大量的与凋亡相关的基因表达下调,所以我们猜想LD4是通过抑制凋亡的途径对细胞起到保护的作用。为了验证我们的猜想,我们用流式细胞仪检测了低温条件下的细胞凋亡情况(图5)。数据显示,与对照组相比,LD4在低温的条件下没有明显的变化。结果证实,LD4不是通过抑制凋亡的途径对细胞起到保护作用的。
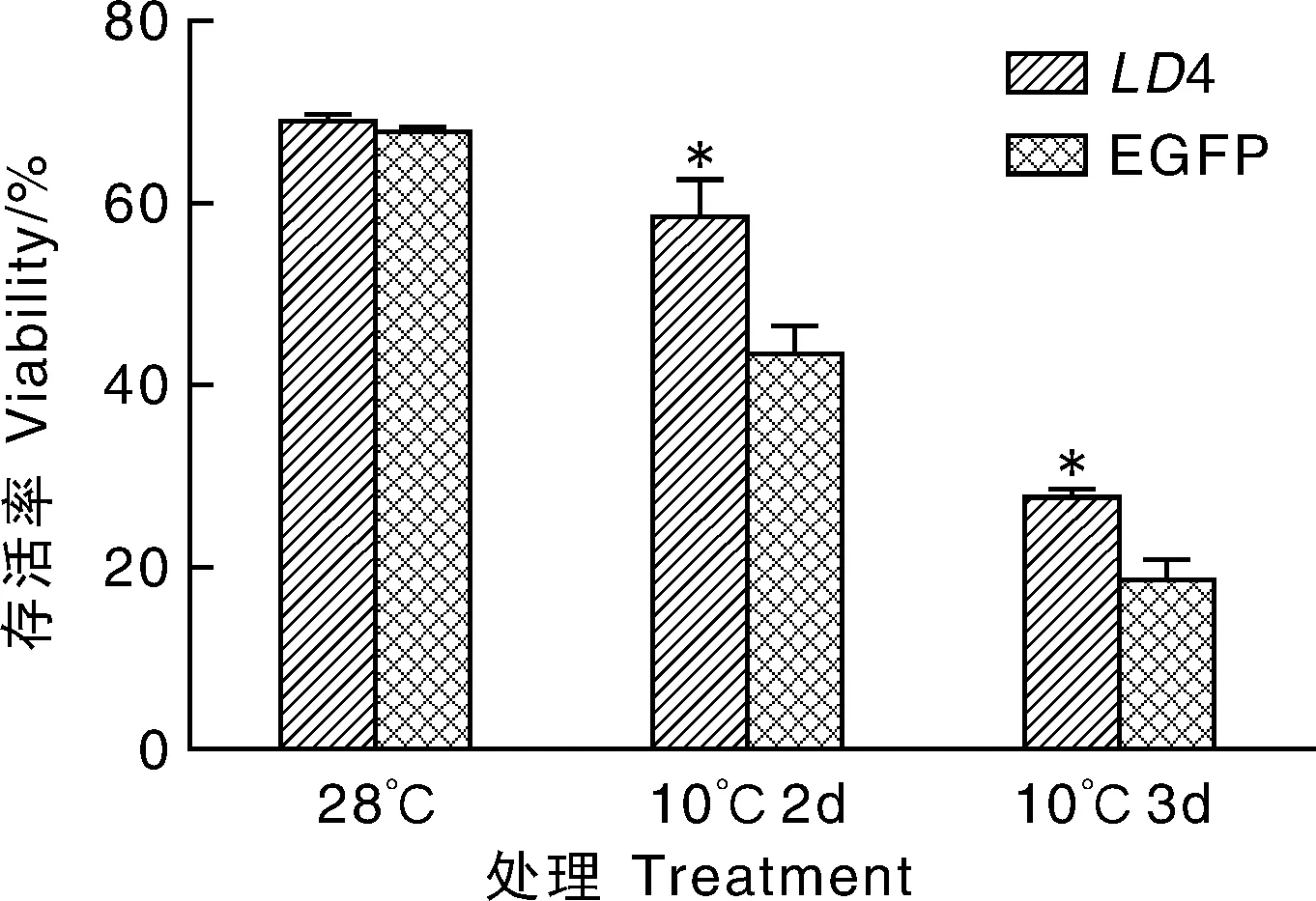
*表示差异显著(P<0.05)。下同*represents the significant difference at the level of 0.05.The same as below
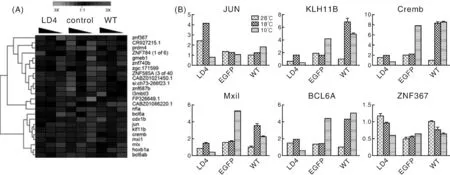
A,测序分析热图;B,荧光定量PCR鉴定A,Sequencing analysis of heat map; B,Fluorescence quantitative PCR identification

图5 流式细胞仪检测的不同温度下细胞凋亡数量百分比Fig.5 Flow cytometry detection of apoptosis percentage at different temperature
3 讨论
在水产养殖过程中,冬天的寒潮经常造成大量成鱼的死亡,罗非鱼因为不能耐受低于10℃低温而影响在我国的养殖范围。因此,有必要深入研究鱼类的抗寒机制,其中研究LD4基因抵抗低温的分子机制,对抗寒机制的深入了解以及揭示抗寒关键基因具有重要的理论意义,也可以为LD4基因的改进和利用奠定基础。
我们构建actin启动子的质粒转染斑马鱼ZF4细胞系,筛选获得稳定表达的细胞系。用特异抗体对LD4的蛋白表达量进行鉴定,筛选具有高表达量的细胞系。在与对照组WT、EGFP相比,低温胁迫的条件下LD4的存活率大于对照组,由此鉴定出LD4在斑马鱼细胞中能显著增强细胞的抗寒能力。对上述低温处理的细胞系用二代高通量测序进行转录组的比较研究,鉴定LD4转基因细胞系与非转化细胞之间在低温诱导基因转录水平的差异,鉴定LD4基因引起的基因表达谱的改变,推测可能的信号通路,并对信号通路进行验证。现在我们初步排除LD4是通过凋亡途径抵御低温胁迫。下一步试验我们将用LD4抗体对低温诱导的和非低温诱导的LD4细胞系进行免疫共沉淀,用蛋白质谱LC-MS/MS初步测定与LD4相互作用的蛋白。用荧光共定位或酵母双杂交等方法验证与LD4相互作用的蛋白;在此基础上确定抑制低温下细胞凋亡的信号通路,明确揭示其作用通路后可作用于渔业或是其他农作物的育种实践。
[1] CAN Ö, HOLLAND N B.Utilizing avidity to improve antifreeze protein activity: A type Ⅲ antifreeze protein trimer exhibits increased thermal hysteresis activity[J].Biochemistry, 2013, 52(48):8745-8752.
[2] RAYMOND J A, DEVRIES A L.Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1977, 74(6): 2589-2593.
[3] CHENG C, DEVRIES A L.Structures of antifreeze peptides from the antarctic eel pout,Austrolycicthysbrachycephalus[J].BiochimicaetBiophysicaActa, 1989, 997(1/2): 55-64.
[4] WANG X, DEVRIES A L, CHENG C H C.Antifreeze peptide heterogeneity in an antarctic eel pout includes an unusually large major variant comprised of two 7kD a type Ⅲ AFPs linked in tandem[J].BiochimicaetBiophysicaActa, 1995, 1247(2): 163-172.
[5] MIURA K, OHGIYA S, HOSHINO T, et al.NMR analysis of type Ⅲ antifreeze protein intramolecular dimer.structural basis for enhanced activity[J].JournalofBiologicalChemistry, 2001, 276(2):1304-1310.
[6] NISHIMIYA Y, OHGIYA S, TSUDA S.Artificial multimers of the type Ⅲ antifreeze protein-Effects on thermal hysteresis and ice crystal morphology[J].JournalofBiologicalChemistry, 2003,278(34): 32307-32312.
[7] ZHANG J, DENG C, WANG J, et al.Identification of a two-domain antifreeze protein gene in antarctic eelpoutLycodichthysdearborni[J].PolarBiology, 2008,32(1), 35-40.
[8] 於静, CHENG C H C,DEVRIES A L,等.南极eelpout (Lycodichthysdearbomi)多聚体Ⅲ型抗冻蛋白基因的克隆与进化分析[J].遗传学报, 2004, 32(8):789-794.
YU J, CHENG C H C, DEVRIES A L, et al.Characterization of a multmier type Ⅲ antifreeze protein gene from the antarctic eel pout(Lycodichthysdearborni)[J].JournalofGenetics&Genomics, 2004, 32(8):789-794.(in Chinese with English abstract)
(责任编辑 张 韵)
Construction of type Ⅲ antifreeze protein eukaryotic expression plasmid and expression in zebrafish cell line
YANG Min,HUANG Qiao,CHEN Liang-biao*
(CollegeofFisheriesandLifeSciences,KeyLaboratoryofAquacultureResourcesandUtilization,MinistryofEducation,ShanghaiOceanUniversity,Shanghai201306,China)
To elucidate the AFPⅢ multimerization molecular mechanisms on cold tolerance,we cloned tetramer (LD4) of the type Ⅲ AFP from a multimer type Ⅲ antifreeze protein geneLD12cDNA which was characterized from the Antarctic eelpout (Lycodichthysdearborni).The eukaryotic expression plasmid Tol2-actin-LD4-2A-EGFP was constructed and transfected into zebrafish cells (ZF4).It was found thatLD4was abundantly expressed in ZF4cell line and reduced mortality of zebrafish cells under low temperature stress.Transcriptome sequencing and gene expression analysis were carried out at WT,EGFP andLD4cells under different processing temperatures (28℃,18℃ for 2days,18℃ for 2days and 10℃ for 2days),the results indicated 26differentially expressed transcription factors,in which I3MB13and ZNF687b were up-regulated and JUN and Cremb were down-regulated.The expression patterns of 26selected genes were verified by qRT-PCR (quantitative real-time PCR).Based on the KEGG pathway analysis,the transcription factors were suggested to be involved in apoptosis,cell cycle and proliferation regulation.So,AnnexinV-PE/7-AAD double staining was used to detect the effect ofLD4on apoptosis.Unfortunately,apoptosis rate was not significantly decreased inLD4cells compared with the control group (EGFP and WT).That is,LD4might be involved in another channel rather than inhibiting apoptosis to resist low temperature,which provides a certain theoretical basis for further research on the mechanism ofLD4.
multimer type Ⅲ antifreeze protein; zebrafish cell line; transcriptome sequencing; cell apoptosis
10.3969/j.issn.1004-1524.2016.11.09
2016-02-29
国家自然科学基金 (31572611)
杨敏(1989—),女,山东临沂人,硕士研究生,主要从事南极鱼抗冻蛋白机制研究。E-mail: ymcassie@foxmail.com
*通信作者,陈良标,E-mail: lbchen@shou.edu.cn
S931.5;Q786
A
1004-1524(2016)11-1862-05
浙江农业学报ActaAgriculturaeZhejiangensis,2016,28(11): 1862-1866
http://www.zjnyxb.cn
杨敏,黄巧,陈良标.南极鱼Ⅲ型抗冻基因真核表达质粒的构建及其细胞表达[J].浙江农业学报,2016,28(11): 1862-1866.
