黄芩素对人胃癌SGC7901细胞迁移及侵袭的影响及其作用机制
2016-12-08张超贤郭李柯
张超贤,韩 宇,郭李柯
(1. 新乡医学院第一附属医院:1. 消化内科;2. 口腔科,河南卫辉 453100)
◇中医药研究◇
黄芩素对人胃癌SGC7901细胞迁移及侵袭的影响及其作用机制
张超贤1,韩 宇1,郭李柯2
(1. 新乡医学院第一附属医院:1. 消化内科;2. 口腔科,河南卫辉 453100)
目的 观察黄芩素对人胃癌SGC7901细胞迁移及侵袭的影响及其作用机制。方法 以人胃癌SGC7901细胞为研究对象,分别加入20 mL的培养液(对照组)或20 mL(50、100、150 mol/L)黄芩素溶液处理细胞48 h,细胞划痕试验检测不同剂量黄芩素对人胃癌SGC7901细胞迁移的影响,Transwell侵袭实验检测黄芩素对细胞侵袭能力的改变;比色法检测细胞胰蛋白酶活性,用Western blot方法检测活化的蛋白酶激活受体-2(protease-activated receptor-2, PAR-2)蛋白表达水平,RT-PCR法检测基质金属蛋白酶-2(matrix metalloproteinases-2, MMP-2)mRNA及基质金属蛋白酶-9(matrix metalloproteinases-9, MMP-9)mRNA水平。结果 与对照组比较,各治疗组人胃癌SGC7901细胞迁移及侵袭的能力、胰蛋白酶活性、活化的PAR-2、MMP-2 mRNA及MMP-9 mRNA表达水平均显著下降(P<0.05),呈剂量依赖性。活化的PAR-2与MMP-2 mRNA及MMP-9 mRNA表达水平呈正相关关系(r=0.564,P<0.05;r=0.581,P<0.05)。结论 PAR-2活性、MMP-2及MMP-9 mRNA表达与胃癌的发生、发展密切相关,活化的PAR-2可通过上调MMP-2及MMP-9 mRNA的表达而参与癌细胞迁移及侵袭,黄芩素能显著抑制人胃癌SGC7901细胞的PAR-2活性和MMP-2及MMP-9 mRNA表达,从而降低癌细胞迁移及侵袭能力,这与其抑制胰蛋白酶活性有密切关系。
黄芩素;人胃癌SGC7901细胞;迁移及侵袭;胰蛋白酶活性;蛋白酶激活受体-2;基质金属蛋白酶-2;基质金属蛋白酶-9
蛋白酶激活受体-2(protease-activated receptor-2, PAR-2)是一种细胞膜表面胰酶受体,广泛分布于体内多种器官和组织,可被体内胰蛋白酶、类胰蛋白酶、膜型丝氨酸蛋白酶-1和组织因子/活化凝血Ⅶ因子复合物(tissue factor/activated coagulation factor Ⅶ complex, TF/FⅦa)等内源性激活剂激活,PAR-2被激活后可调控多种细胞因子、机体酶生长因子的转录表达,参与调控机体免疫应答、炎症反应、细胞凋亡及肿瘤形成等多种生理和病理过程,与肿瘤关系密切[1-2]。国内外研究表明,PAR-2在恶性肿瘤中呈现过度激活状态,导致并调控恶性肿瘤患者基质金属蛋白酶-2(matrix metalloproteinases-2, MMP-2)和基质金属蛋白酶-9(matrix metalloproteinases-9, MMP-9)等细胞因子过度和持续表达,从而参与了肿瘤的生长和转移[3-4]。黄芩素(baicalein)是从唇形科植物黄芩的干燥根中提取的重要单体,是黄芩的主要有效成分之一,有较强的抗胰蛋白酶作用。国内外研究显示黄芩素可显著抑制恶性肿瘤生长及转移[5-6],但这种作用是否与抑制胰蛋白酶和PAR-2活性及下游炎症因子的表达有关尚不清楚。本研究以人胃癌SGC7901细胞为研究对象,体外研究黄芩素对细胞迁移及侵袭能力、胰蛋白酶活性、活化的PAR-2、MMP-2和MMP-9表达,初步探讨黄芩素抗胃癌转移的作用及其作用机制。
1 材料与方法
1.1 材料 人胃癌SGC7901细胞系购自中国生命科学院细胞库。细胞胰蛋白酶活性比色法定量检测试剂盒(上海铭博生物科技有限公司);Transwell小室购自BD公司,Trizol试剂(美国Invitrogen公司);MMP-2、MMP-9及β-actin基因引物(上海生工生物工程公司);RT-PCR(一步法)试剂盒(宝生物工程有限公司);用于Western blot的PAR-2抗体(上海安妍生物有限公司)。7500型实时荧光定量PCR仪(美国Life Technologies公司),2720型PCR扩增仪(美国Applied Biosystems公司),5417R型冷冻离心机(法国Eppendorf公司),Power Poc 型Western blot电泳仪(美国Bio-Rad公司),DMI3000B型荧光显微镜(德国莱卡公司)。黄芩素(纯度980 g/L)由陕西慈缘生物技术有限公司提供,实验前,用1 g/L二甲基亚砜将黄芩素溶解成50、100、150 mol/L溶液备用。
1.2 细胞与培养 从液氮中取出人胃癌SGC7901细胞复苏(新乡医学院中心实验室提供),用含100 mL/L FBS的DMEM培养基在37 ℃含50 mL/L CO2的孵箱中培养,隔天传代1次,待细胞状态稳定后用于实验。
1.3 细胞划痕试验检测细胞迁移能力 以每孔5×105个细胞的密度接种于6孔培养板,待细胞贴壁后加入mytomycin C(S期细胞周期阻滞剂)预处理1 h,抑制细胞生长。用10 μL移液枪头在每个培养孔内划一直线,PBS洗去划下的细胞后分别加入20 mL DMEM培养液(对照组)和同体积(50、100、150 mol/L黄芩素溶液继续培养。显微镜下对比0、24、48 h各组细胞划痕的愈合情况,用Image-Pro PLus 6.0软件计算分析。
1.4 Transwell侵袭试验检测细胞侵袭能力 将人胃癌SGC7901细胞均匀接种于铺有基质胶的24孔Transwell小室(上室)中,分别加入20 mL DMEM培养液(对照组)和同体积(50、100及150 mol/L黄芩素溶液培养,下室加入含200 g/L FBS的完全培养基,37 ℃培养24、48 h,用棉签拭去小室内底部细胞,40 g/L甲醛固定液固定小室外底部的细胞,结晶紫染色,显微镜下观察各组细胞穿过小室基质胶的情况,统计穿过的细胞数目,对比不同组间处理对SGC7901细胞侵袭能力的影响。
1.5 癌细胞胰蛋白酶活性的测定 细胞计数,调人胃癌SGC7901细胞密度1×105/mL,加入compound48/80至终质量浓度为5 μg/mL,37 ℃培养1 h,离心,取上清液备用,比色法测定胰蛋白酶活性。
1.6 Western blot法检测活化PAR2蛋白表达水平 不同浓度黄芩素溶液或DMEM培养液作用48 h后去培养基,用冰PBS洗两遍,加入细胞裂解液(50 mmol/L Tris-HCl pH 7.4,150 mmol/L NaCl,1 mmol/L PMSF,1 mmol/L EDTA,10 g/L Tritonn X-100,5 g/L deoxycholate,1 μg/mL leupeptin,2 mg/L aprotinin,1 mmol/L Na3VO4和1 g/L SDS)冰上30 min,抽提细胞总蛋白,取100 μg胞浆蛋白样品于100 g/L SDS-聚丙烯酰胺凝胶电泳,然后转印至PVDF膜,用封闭液(50 g/L脱脂奶粉、0.5 g/L Tween-20TBS)封闭后,一抗1∶1 000,4 ℃过夜。二抗1∶2 000,室温4 h,采用GAPDH作内参,化学发光现象于X光片。凝胶成像系统分析吸光度(A)比值。
1.7 RT-PCR检测PAR2、MMP-2及MMP-9 mRNA表达水平 不同浓度组黄芩素溶液或DMEM培养液作用48 h后去培养基,加入1 mL/孔Trizol,室温裂解10 min,加入0.2 mL三氯甲烷,剧烈颠倒混匀15 s。静置10 min后4 ℃ 12 000 r/min,离心15 min,吸取上层水样层加入0.5 mL异丙醇,颠倒混匀后,25 ℃放置10 min,4 ℃ 12 000 r/min/离心15 min,移去上清。750 mL/L乙醇1 mL沉淀RNA,4 ℃ 7 500 r/min离心5 min,在防止丢失RNA沉淀的前提下吸尽上清,静置以挥发乙醇。DEPC水30 μL溶解RNA,用Trizol(Invitrogen公司)抽提RNA,RT-PCR半定量法检测mRNA表达量:①PAR2 mRNA检测。PAR2 mRNA上游引物序列:5′-CCCTTTGTATGTCGTGAAGCAGAC-3′;TNF-α下游引物序列:5′-TTCCTGGAGTGTTTCTTTGAGGTG-3′,产物长度385 bp;设β-actin为内参照,其上流引物序列:5′-TTGTAACCAACTGGGACGATATGG-3′,下游引物序列:5′-GATCTTGATCTTCATGGTGCTAGG-3′,产物长度275 bp。反应条件:50 ℃ 1 h,90 ℃ 5 min;94 ℃ 30 min,65 ℃ 30 min,68 ℃ 1 min 30个循环;65 ℃延伸2 min,4 ℃保存。20 g/L的琼脂糖凝胶电泳,在凝胶成像系统中计算PAR2 mRNA与β-肌动蛋白的电泳条带的光密度比值。②MMP-2 mRNA检测。MMP-2引物序列:上游5′-GTGCCCAAAGAAAGGTGCTG-3′,下游5′-AGGAGGGGAGCCATCCATAG-3′,扩增产物长度454 bp。内参β-肌动蛋白序列:上游5′-GTAAAGACCTCTATGCCATCA-3′,下游5′-GGACTCATGCTACTCCTGCT-3′,扩增产物长度227 bp。PCR条件:各扩增管先置于55 ℃水浴逆转录40 min,然后直接置PCR扩增仪94 ℃变性45 s,54 ℃退火45 s,72 ℃延伸60 s,共40个循环,再72 ℃延伸5 min,PCR产物在15 g/L琼脂糖凝胶上电泳,在凝胶成像系统中计算MMP-2 mRNA与β-肌动蛋白的吸光度比值。③MMP-9 mRNA检测。MMP-9引物序列:上游5′-AACCAATCTCACCGACAG-3′,下游5′-AAAGGCGTCGTCAATCAC-3′。扩增产物全长316 bp,β-actin序列:上游5′-CAGCCTGTGCTGCTCACCGAGGCC-3′。下游5′-CCACACAGATGACTTGCGCTCAGG-3′,扩增产物全长690 bp,扩增条件为:预变性94 ℃ 4 min,循环,94 ℃变性60 s,58 ℃ 45 s,72 ℃ 45 s,共38个循环,72 ℃延伸10 min,取10 μL PCR扩增产物,以DL2000作为分子量标准,进行12 g/L的琼脂糖凝胶电泳(含0.5 mg/L EB)。电泳后进行凝胶电泳图像扫描分析。电泳结果以MMP-9 mRNA的表达相对量来表示,即MMP-9 mRNA/β-actin的比值来表示。

2 结 果
2.1 黄芩素对人胃癌SGC7901细胞迁移及侵袭的影响 细胞划痕试验结果显示,与0 h对比,对照组细胞24 h迁移率为67.48%,50 mol/L黄芩素组为54.91%,100 mol/L黄芩素组为42.02%,150 mol/L黄芩素组为26.65%。处理48 h后,溶剂对照组细胞迁移率为85.32%,50 mol/L黄芩素组为69.23%,100 mol/L黄芩素组为54.51%,150 mol/L黄芩素组为38.47%,提示黄芩素明显抑制人胃癌SGC7901细胞的迁移,呈剂量依赖性(图1)。

图1 黄芩素对人胃癌SGC7901细胞迁移的影响Fig.1 Effects of baicalein on migration of human gastric carcinoma SGC7901 cells
用Transwell侵袭试验检测黄芩素对人胃癌SGC7901细胞侵袭能力的影响,与对照组相比,黄芩素各组穿过小室的细胞数明显减少(P<0.01),提示黄芩素可降低人胃癌SGC7901细胞的侵袭能力,呈剂量依赖性(图2)。

图2 黄芩素对人胃癌SGC7901细胞侵袭能力的影响Fig.2 Effects ofbaicalein on the invasion of human gastric carcinoma SGC7901 cells
2.2 黄芩素对人胃癌SGC7901胞胰蛋白酶活性、活化的PAR-2及PAR-2、MMP-2和MMP-9 mRNA的影响 与对照组比较,黄芩素各组胰蛋白酶活性、活化的PAR2、MMP-2 mRNA及MMP-7 mRNA表达水平均显著下降(P<0.05),呈剂量依赖性。胰蛋白酶活性与活化PAR2、PAR2与MMP-2 mRNA、PAR2与MMP-9 mRNA表达水平呈正相关关系(r1=0.564,P<0.05;r2=0.581,P<0.05;r2=0.601,P<0.05)。随黄芩素浓度增大,组间PAR-2 mRNA有下降趋势,但差异无统计学意义(P>0.05,表1、图3~图6)。

图3 各组活化的PAR-2的表达Fig.3 Active PAR-2 expression in the 4 groups

图4 各组PAR-2 mRNA的表达Fig.4 PAR-2 mRNA expression in the 4 groups

图5 各组MMP-2 mRNA的表达Fig.5 MMP-2 mRNA expression in the 4 groups

图6 各组MMP-9 mRNA的表达Fig.6 MMP-9 mRNA expression in the 4 groups
3 讨 论
肿瘤的生长、浸润及转移是一个复杂的肿瘤细胞与宿主细胞间相互作用的连续过程,涉及细胞间粘附、细胞外基质(extracellular matrix, ECM)降解、细胞迁移以及血管形成等步骤[7]。MMP-2和MMP-9是两种重要的降解胶原纤维酶类,他们通过对ECM的降解而促进肿瘤细胞对周围组织的浸润[8-10]。血管内皮生长因子VEGF是公认的特异性作用于血管内皮细胞的强力促血管生成因子,其可以促进血管内皮细胞分裂增生和分化成熟。因此,在肿瘤的发生发展、浸润和转移中发挥了重要作用[11-13]。蛋白酶激活受体(protease-activated receptors, PARS)属于G蛋白耦联受体超家族成员之一,具有7个跨膜单位,目前已先后发现有PAR-1、PAR-2、PAR-3、PAR-4四种亚型,其中PAR-1、PAR-3和PAR-4都是凝血酶受体,PAR-2是胰酶受体。1994年首次在鼠DNA序列中发现了一种G蛋白耦联受体的基因序列,命名为PAR-2。PAR-2由细胞外区(N末端和细胞外袢)、跨膜区(7个跨膜螺旋)及细胞内区(细胞内袢和C末端)组成。PAR-2广泛分布于人体内,可被体内多种内源性激活剂激活,如胰蛋白酶、类胰蛋白酶、膜型丝氨酸蛋白酶-1、TF/FⅦa复合物等。PAR-2被激活后通过直接和间接方式产生多种生物学效应,包括炎症反应、扩血管效应、激发唾液分泌和胰腺分泌、特异性调节血管增生以及导致细胞的增殖和迁移等。在许多肿瘤中均可见到PAR-2的异常表达及活化并诱导MMP-2、MMP-9和VEGF等细胞因子大量表达,在恶性肿瘤进展中发挥重要的作用[14]。所以,在理论上通过抑制胰蛋白酶和PAR2活性、下调MMP-2 mRNA及MMP-9 mRNA表达是抑制肿瘤的生长和转移一个重要途径。
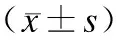
表1 各组胰蛋白酶活性、活化的PAR-2、MMP-2 mRNA及MMP-9 mRNA表达水平的比较Tab.1 Comparison oftypsin activity, active PAR-2, MMP-2 mRNA and MMP-9 mRNA expressions among the 4 groups
本研究显示,各组胰蛋白酶活性、PAR2活性与MMP-2 mRNA及MMP-9 mRNA表达呈同方向变化,且与癌细胞迁移及侵袭能力相平行,这验证了活化的PAR2可通过上调MMP-2 mRNA及MMP-9 mRNA表达来参与恶性肿瘤发生、发展。研究显示人胃癌SGC7901细胞PAR2 mRNA在各组间表达差异不明显,提示PAR2的活性并非完全由PAR2 mRNA表达所决定。PAR2 mRNA的表达从分子角度反映了基因的转录水平,转录水平越高,PAR2表达的数量越多,一定程度上就可提高PAR2的活性,但PAR2活性变化是受多因素影响的,在恶性肿瘤发生发展过程中,PAR2活性的增强主要是因为胰蛋白酶等活化因素的变化导致,而非PAR2 mRNA表达增多所致,所以抑制PAR2活性的有效手段是减少PAR2活化因素、阻断PAR2活化途径。黄芩素是黄芩的黄酮类成分之一,具有较强的抗胰蛋白酶作用,而黄芩其他的6种黄酮类成分抗胰蛋白酶作用弱,这可能与黄芩素结构中黄酮骨架邻接的羟基有关[15-16]。本研究显示,各黄芩素组人胃癌SGC7901细胞迁移及侵袭的能力、PAR2、MMP-2 mRNA及MMP-9 mRNA表达水平较对照组显著下降,且高浓度效果强于低浓度(P<0.05),MMP-2 mRNA及MMP-9 mRNA表达与PAR2呈正相关(r均>0),提示通过抑制胰蛋白酶活性来抑制PAR2活化,下调MMP-2 mRNA及MMP-9 mRNA等下游因子表达可能是黄芩素降低癌细胞迁移及侵袭能力的重要机制。
[1] XIE L, DUAN Z, LIU C, et al. Protease-activated receptor 2 agonist increases cell proliferation and invasion of human pancreatic cancer cells[J]. Exp Ther Med, 2015, 9(1):239-244.
[2] SEDDA S, MARAFINI I, CARUSO R, et al. Proteinase activated-receptors-associated signaling in the control of gastric cancer[J]. World J Gastroenterol, 2014,20(34):11977-11984.
[3] LIN ZM, ZHAO JX, DUAN XN, et al. Effects of tissue factor, PAR-2 and MMP-9 expression on human breast cancer cell line MCF-7 invasion[J]. Asian Pac J Cancer Prev, 2014, 15(2):643-646
[4] CHANG LH, PAN SL, LAI CY, et al. Activated PAR-2 regulates pancreatic cancer progression through ILK/HIF-α-induced TGF-α expression and MEK/VEGF-A-mediated angiogenesis[J]. Am J Pathol, 2013, 183(2): 566-575.
[5] CHEN K, ZHANG S, JI Y, et al. Baicalein inhibits the invasion and metastatic capabilities of hepatocellular carcinoma cells via down-regulation of the ERK pathway[J]. PLoS One,2013, 8(9):e72927.
[6] GUO Z, HU X, XING Z, et al. Baicalein inhibits prostate cancer cell growth and metastasis via the caveolin-1/AKT/mTOR pathway[J]. Mol Cell Biochem, 2015, 406(1-2):111-119.
[7] GU Y, CHENG Y, SONG Y, et al. MicroRNA-493 suppresses tumor growth, invasion and metastasis of lung cancer by regulating E2F1[J]. PLoS One,2014,9(8):e102602.
[8] WIECZOREK E, JABLONSKA E, WASOWICZ W, et al. Matrix metalloproteinases and genetic mouse models in cancer research: a mini-review[J]. Tumour Biol, 2015, 6(1):163-175.
[9] 贾宗良,朱宏升,柴明明,等. 甲状腺乳头状癌中MMP2、COX-2、VEGF和MVD的表达及临床意义[J]. 西安交通大学学报(医学版), 2015, (3):362-367.[10] 孙晓宏,房福元,李卉,等. MMP-2和MMP-9在食管鳞状细胞癌患者癌组织中的表达及其意义[J]. 吉林大学学报(医学版), 2015, 41(4):814-819.
[11] 刘邦,刘钧,蹇顺海,等. Eag1钾离子通道、HIF-1α以及VEGF在子宫颈癌中的表达及其临床意义[J]. 川北医学院学报, 2014, 29(1):57-62.
[12] WANG Y, HUANG L, WU S, et al. Bioinformatics analyses of the role of vascular endothelial growth factor in patients with non-small cell lung cancer[J]. PLoS One, 2015, 10(9):e0139285.
[13] 甘卫刚,洪育明,刘海,等. VEGF和MVD在下咽鳞癌组织中的表达及其意义[J]. 川北医学院学报, 2013, 28(3):222-228.
[14] WANG GJ, WANG YB, LI DN, et al. Expression of protease-activated receptor-2 in human gastric stromal tumor and its clinicopathological significance[J]. Hepatogastroenterology, 2013, 60(128):2125-2128.
[15] LI J, WU Y, ZHANG S, et al. Baicalein protect pancreatic injury in rats with severe acute pancreatitis by inhibiting pro-inflammatory cytokines expression[J]. Biochem Biophys Res Commun, 2015, 466(4):664-669.
[16] LI ZF, XIA XM, HUANG C, et al. Emodin and baicalein inhibit pancreatic stromal derived factor-1 expression in rats with acute pancreatiti[J]. Hepatobiliary Pancreat Dis Int, 2009, 8(2):201-208.
(编辑 韩维栋)
Effects of baicalein on the migration and invasion of human gastric carcinoma SGC7901 cells and its mechanism
ZHANG Chao-xian1, HAN Yu1, GUO Li-ke2
(1. Department of Gastroenterology, the First Affiliated Hospital of Xinxiang Medical University, Weihui 453100; 2. Department of Stomatology, the First Affiliated Hospital of Xinxiang Medical University, Weihui 453100, China)
Objective To observe the effects of baicalein on the migration and invasion of human gastric carcinoma SGC7901 cells and its mechanism. Methods Human gastric carcinoma SGC7901 cells culturedinvitrowere respectively treated with 20 mL culture medium (control group), 50 mol/L baicalein, 100 mol/L baicalein, and 150 mol/L baicalein for 48 hours. Wound healing and Transwell assay were used to determine the inhibitory effects of baicalein on cell migration and invasion in human gastric carcinoma SGC7901 cells respectively. The typsin activity of cells was detected by photocolorimetric method, the protein expression of active protease-activated receptor-2 (PAR-2) was detemined by Western blotting; the matrix metalloproteinases-2 (MMP-2) mRNA, matrix metalloproteinases-9 (MMP-9) mRNA expressions were measured with RT-PCR. Results Compared with those in control group, the abilities of cells migration and invasion and the typsin activity, active PAR-2, MMP-2 mRNA and MMP-9 mRNA expressions were dose-dependently decreased in three baicalein groups (P<0.01). There were obvious positive correlations among active PAR-2, MMP-2 mRNA and MMP-9 mRNA expressions (r=0.564,P<0.05;r=0.681,P<0.05). Conclusion PAR-2 activity, MMP-2 mRNA and MMP-9 mRNA expressions are closely correlated with the pathogenesis of gastric carcinoma. Active PAR-2 may play an important role in carcinoma cells migration and invasion via upregulating MMP-2 mRNA and MMP-9 mRNA expressions. Baicalein can inhibit PAR-2 activity, MMP-2 mRNA and MMP-9 mRNA expressions obviously in human gastric carcinoma SGC7901 cells, thus decreasing the carcinoma cells migration and invasion, which is closely correlated to its inhibiting effects on typsin activity.
baicalein; human gastric carcinoma SGC7901 cell; migration and invasion; typsin activity; protease-activated receptor-2; matrix metalloproteinases-2; matrix metalloproteinases-9
2016-01-23
2016-06-29
河南省教育厅科研基金项目(No.20073200143)
Supported by the Scientific Research Foundation of Henan Provincial Education Department (No.20073200143)
张超贤. E-mail: nn21882001@aliyun.com
R735.2
A
10.7652/jdyxb201606024
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161012.0952.006.html(2016-10-12)
