花期高温胁迫对水稻颖花生理特性的影响
2016-12-07兰旭顾正栋丁艳菲王珂江琼朱诚
兰旭 顾正栋 丁艳菲 王珂 江琼 朱诚
(中国计量学院 生命科学学院/浙江省海洋食品品质与危害物控制重点实验室, 杭州 310018;*通讯联系人, E-mail: pzhch@cjlu.edu.cn)
花期高温胁迫对水稻颖花生理特性的影响
兰旭 顾正栋 丁艳菲 王珂 江琼 朱诚*
(中国计量学院 生命科学学院/浙江省海洋食品品质与危害物控制重点实验室, 杭州 310018;*通讯联系人, E-mail: pzhch@cjlu.edu.cn)
LAN Xu, GU Zhengdong, DING Yanfei, et al. Effect of high temperature stress on physiological characteristics of spikelet of rice during flowering stage. Chin J Rice Sci, 2016, 30(6): 637-646.
以野生型水稻中花11及其耐热型突变体(hst)为材料,于抽穗扬花期高温处理7 d (40℃,每天处理6 h),探讨开花期水稻颖花生理特性与耐热性之间的关系。研究表明,花期高温导致剑叶叶绿素含量、颖花可溶性蛋白和可溶性糖含量均显著下降,突变体hst的降幅明显小于野生型中花11;同时,高温下颖花中丙二醛(MDA)、过氧化氢(H2O2)及游离脯氨酸含量均显著增加,而突变体hst的增幅明显低于野生型中花11。在抗氧化酶活性方面,超氧化物歧化酶(SOD)、过氧化物酶(POD)及过氧化氢酶(CAT)活性对水稻开花期高温胁迫的响应有所不同,其变化与耐热性之间的相关性有待进一步验证。高温胁迫下水稻剑叶中保持较稳定的光合作用,颖花中保持较多的渗透调节物质及较低的MDA和H2O2含量,是突变体耐高温的生理基础。
水稻; 抽穗扬花期; 高温胁迫; 颖花; 生理特性
近年来,随着全球工业化进程的推进,温室气体大肆排放,导致全球表面平均气温逐步上升,极端高温天气频发。据预测,到21世纪末,全球温度将升高2~4℃[1],夏季炎热期可能延长,高温热害将成为作物生长的主要限制因素之一[2.3]。水稻是重要的粮食作物,世界近一半的人口以水稻为主食。水稻最适生长温度是28~32℃[4],据报道,水稻生长期间,平均夜间最低温度每升高1℃,水稻产量就下降10%[3]。2013年中国长江中下游地区的最高温度和保持高温的天数均创历史新高,严重影响稻米产量与品质,威胁长江流域这一重要商品粮基地的生产安全[5]。我国人口众多,水稻高产依然是我国粮食生产的首要条件,也是保障我国粮食安全的重要措施之一[6]。因此,在全球气候持续变暖、极端高温频发的背景下,开展水稻耐热性研究对于确保粮食安全和农业可持续发展有十分重要的战略意义。
日本学者Yoshida等[7]通过大量研究证明,水稻扬花期是对高温胁迫最敏感的时期。周建霞等[8]研究发现,常规高温处理下颖花育性对开花当天高温最敏感,而高温后移处理下颖花育性对开花期前1 d高温最敏感,开花前高温主要 通过影响花药散粉、花粉粒萌发和花粉管延伸从而引起颖花败育。谢晓金等[9]研究表明,高温胁迫下水稻花药中的脯氨酸(pro)、游离氨基酸、可溶性蛋白质、抗坏血酸(ASA)和还原型谷胱甘肽(GSH)含量较对照处理均显著降低(P<0.01),并且随着胁迫温度的升高与胁迫时间的延长,其花粉活力、花粉萌发率、结实率、每穗实粒数与单株产量均有所下降。张桂莲等[10]研究认为,高温胁迫下水稻花药保持较高抗氧化酶活性、较好的花粉散落特性和花粉萌发特性及较低的膜透性和丙二醛(MDA)含量,是品种耐高温的生理基础。受精过程是水稻产生籽粒的必要环节,对水稻结实产生重要影响[11]。抽穗扬花期对高温最为敏感,极易导致花粉败育和子房受精受阻,空粒率大幅度提高,结实率大幅度下降,造成严重减产[12-14]。
水稻作为模式植物被研究多年,但目前关于高温对水稻影响机理的系统研究大多是在不同的基因型材料中开展的,而同种植物不同的基因型对于热胁迫的耐性反应机制不完全相同。本研究的材料是实验室自繁的粳稻品种中花 11(ZH11)和已通过多次自交获得纯合体的ZH11为背景的耐高温突变体(hst),我们对突变体hst的突变基因进行了初步定位和克隆,发现在目标区段一个锌指蛋白转录因子基因发生了4个碱基插入,造成了移码突变,导致了该基因功能缺失。遗传分析表明,该突变体属单基因隐性突变,由于突变基因HST功能的缺失,使得突变体具有了花期耐高温的能力,因此HST为水稻花期耐高温的负调控因子。利用突变体开展热胁迫方面的研究工作在拟南芥中开展较多,在水稻中开展很少。本研究利用人工气候室对生殖生长期-抽穗开花期遗传背景相同但耐高温性状具有显著差异的两水稻品系进行高温处理,通过对颖花生理生化指标的测定,探讨开花期颖花生理生化特性变化与耐热性的关系,探明开花期高温胁迫对水稻花器官的影响机理,为选育耐热性水稻品种或改良已有高产水稻品种的耐热性提供理论依据。特别是以水稻耐热突变体为研究材料,为耐热机制的阐明及利用分子技术选育水稻耐高温品种提供了更好的平台。
1 材料与方法
1.1 材料与处理
供试材料是本实验室自繁的粳稻品种中花 11和已通过多次自交获得纯合体的中花11为背景的耐高温突变体hst。二者在耐热性方面具有显著差异,在高温条件下种植,前者的结实率和产量受到明显影响,而后者受影响较小,两品系热胁迫指数差异显著(P<0.01)。试验于2015年在中国计量学院进行,2015年3月10日和4月12日分两期播种,并于4月11日和5月10日移栽。待水稻生长到抽穗扬花期前10 d,将生长发育进程基本一致的植株移栽到盆钵中,每盆8株,每批次共计40盆。当水稻生长到抽穗扬花期前1 d,将其移入人工气候室,抽穗扬花期当天,分别进行高温和适温处理,高温处理如下:30℃(6:00-9:00)、40℃(9:00-15:00)、30℃(15:00-19:00)、23℃(19:00-6:00),相对湿度为60%。适温处理温度如下28℃(6:00-19:00)、23℃(19:00-6:00),相对湿度为60%。高温处理7 d,并于处理1、3、5和7 d后分别取样,进行各项指标测定,每项指标测定重复3次。高温处理结束后,将植株移到适温条件下继续生长到成熟,进行考种和测产。
1.2 测定项目及方法
1.2.1 结实率、千粒重等农艺性状测定
对开花前1 d的水稻连续高温处理7 d,处理结束后移至适温条件下恢复培养至结实,考查每穗实粒数、千粒重、单株产量、结实率及受精率。受精率(%) = (秕粒数+饱粒数)/(空粒数+秕粒数+饱粒数)×100%。
1.2.2 颖花生理指标测定
1.2.2.1 抗氧化酶活性测定
抗氧化保护酶[过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)]活性采用蔡冲主编的《植物生物学实验》方法[15]测定。
1.2.2.2 丙二醛(MDA)含量测定
称取0.5 g新鲜主茎稻穗颖花样品,加入2 mL预冷的0.05 mol/L磷酸缓冲液(pH7.8),冰浴研磨成匀浆,转移到5 mL刻度离心试管中,将研钵用缓冲液洗净,清洗液也移入离心管中,最后用缓冲液定容至5 mL。4500 r/min、4℃下离心10 min,上清液即为MDA提取液,测量提取液的体积,采用硫代巴比妥酸比色法[16]测定。
1.2.2.3 可溶性糖含量测定
称取0.1~0.3 g新鲜主茎颖花样品,剪碎后放入刻度试管中,加入5~10 mL蒸馏水,塑料薄膜封口,于沸水中提取30 min(提取2次),提取液过滤入25 mL容量瓶中,反复冲洗试管及残渣,定容至刻度,采用蒽酮比色法[17]测定可溶性糖含量。
1.2.2.4 游离脯氨酸含量测定
称取0.3~0.5 g新鲜主茎颖花样品,剪碎后放入具塞试管中,加5 mL 3%磺基水杨酸溶液,加塞后在沸水浴中提取10 min,收集过滤液,采用磺基水杨酸提取,茚三酮显色法测定。
1.2.2.5 可溶性蛋白含量测定
称取0.3~0.5 g新鲜主茎稻穗颖花样品,置于冷冻过的研钵中加50 mmol/L Tris-HCl提取液3 mL,加少量石英砂,在冰浴中快速研磨成匀浆,匀浆倒入离心管中,再用5 mL提取液(分2次)将研钵中匀浆洗入离心管。10000 r/min、4℃下离心20 min,上清液即为可溶性蛋白质提取液,采用考马斯亮蓝比色法[18]测定。
1.2.2.6 过氧化氢含量测定。
称取0.1 g新鲜主茎颖花样品,加入3 mL预冷的磷酸钾缓冲液 (即PBS,50 mmol/L,pH 6.5 ),冰浴研磨。匀浆液在6000×g、4℃下离心25 min,上清即为H2O2提取液。加入1 mL 0.1%四氯化钛(含20% H2SO4)。混合液在6000×g、4℃下离心15 min。取上清测定波长410 nm的OD值,消光系数0.28 μmol/cm,CH2O2(μmol/L)=OD410×3000/28。
1.2.2.7 剑叶中叶绿素含量测定。
称取0.2 g新鲜水稻剑叶样品,放入研钵中,加少量石英砂和碳酸钙粉及2~3 mL 95%乙醇,研成匀浆,再加95%乙醇10 mL,继续研磨至组织变白。静置3~5 min,取滤纸一张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到25 mL棕色容量瓶中,用少量95%乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至25 mL,摇匀。采用分光光度计比色法[12]测定。
1.2.3 数据分析
所有实验数据处理和方差分析采用Microsoft Excel和SPSS软件完成。
2 结果与分析
2.1 农艺性状
2.1.1 高温胁迫对水稻受精率的影响
从图1可知,在适温条件下,两水稻品系的受精率没有显著差异;在高温胁迫下,两水稻品系的受精率均显著降低,野生型中花11的受精率比适温下降低62.90个百分点,突变体hst的受精率比适温下降低35.54个百分点;高温下两品系水稻的受精率存在显著差异(P<0.05),突变体hst的受精率显著高于野生型中花11。由此可以说明,突变体hst的受精率受高温热害的影响较野生型中花11小。
2.1.2 高温胁迫对水稻结实率、千粒重及产量的影响
从表1可知,在适温条件下,两品系水稻的千粒重、每穗实粒数和结实率均没有显著差异,而突变体hst的单株产量相对野生型中花11显著增加。与适温条件相比,两水稻品系在高温胁迫下的每穗实粒数、单株产量和结实率均显著下降。同时可以发现,在高温胁迫下,突变体hst水稻每穗实粒数、单株产量和结实率较野生型中花11均有升高且差异达显著水平,而千粒重呈显著下降趋势。热敏感指数能有效地反映水稻受高温热害的程度,其值越大,热害越严重。本研究结果显示,野生型中花11的热害程度为80.24%,而突变体hst为46.87%。结果表明突变体hst在高温胁迫下的热害程度相对野生型中花11明显降低,即突变体hst受高温热害程度较小。
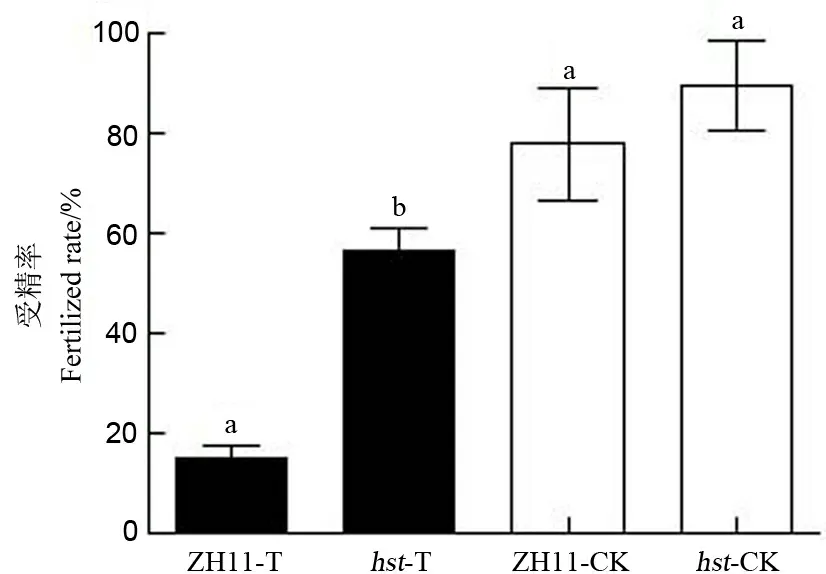
ZH11-T-高温胁迫下野生型中花11;hst-T-高温胁迫下突变体;ZH11-CK-适温条件下的野生型中花11;hst-CK-适温条件下的突变体;图中数据为平均数±标准差;n=30;相同字母表示差异未达0.05 显著水平。下同。
ZH11-T, Wild type under high temperature stress;hst-T, Mutant under high temperature stress; ZH11-CK, Wild type under natural condition;hst-CK, Mutant under natural condition; All data are mean±standard deviation;n=30; The same letter indicates no significant difference at 0.05 significant level. The same below.
图1 花期高温胁迫对水稻颖花受精率的影响
Fig. 1. Effect of high temperature stress on the fertilized rate of spikelets at the flowering stage.
表1 高温胁迫对水稻结实率、千粒重及单株产量的影响
Table 1. Effect of high temperature stress on rice seed-setting rate,1000-grain weight and yield per plant.
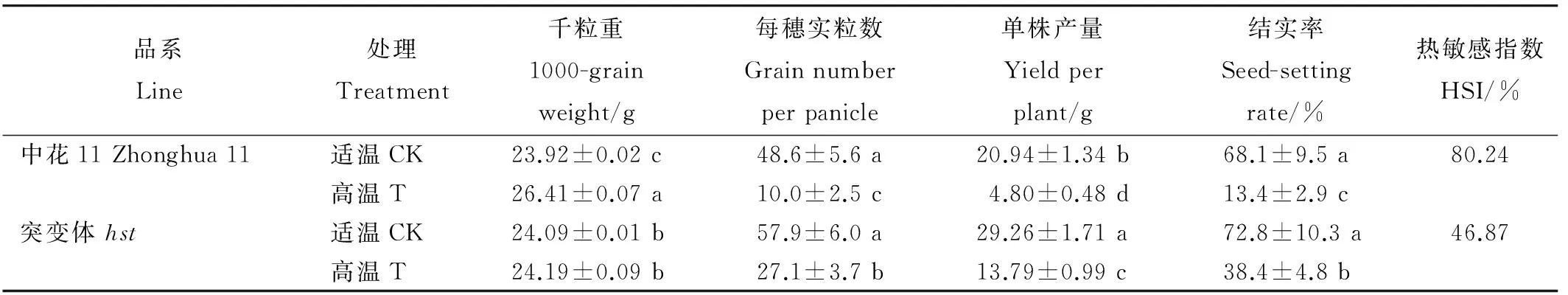
品系Line处理Treatment千粒重1000-grainweight/g每穗实粒数Grainnumberperpanicle单株产量Yieldperplant/g结实率Seed-settingrate/%热敏感指数HSI/%中花11Zhonghua11适温CK23.92±0.02c48.6±5.6a20.94±1.34b68.1±9.5a80.24高温T26.41±0.07a10.0±2.5c4.80±0.48d13.4±2.9c突变体hst适温CK24.09±0.01b57.9±6.0a29.26±1.71a72.8±10.3a46.87高温T24.19±0.09b27.1±3.7b13.79±0.99c38.4±4.8b
CK-适温; T-高温。下同。结实率=饱粒数/总粒数×100%;热敏感指数(HSI)=(适温结实率-高温结实率)/适温结实率×100%;表中数据为平均值±标准差;n=30。同一列中相同字母表示差异未达0.05 显著水平。下同。
CK,Natural condition;T,High temperature condition; Seed-setting rate(%)= Full grain number/Total grain number×100%; Heat sensitivity index(HSI) = (Seed-setting rate under natural condition - seed-setting rate under high temperature condition) / seed-setting rate under natural condition ×100%; All data are mean±standard deviation;n=30; The same letter in the same column indicates no significant difference at 0.05 significant level. The same below.
2.2 生理特性
2.2.1 高温胁迫对水稻剑叶中叶绿素含量的影响
光合作用被认为是对高温最敏感的过程之一,高温主要影响类囊体的物理化学性质和结构组织,导致细胞膜的解体和细胞组分的降解,影响植物的光合效率[19]。本研究在不同处理条件下测定了水稻扬花期剑叶中的叶绿素含量,结果如图2。从图2可知,高温处理后,野生型中花11剑叶叶绿素含量与适温下相比显著下降,而突变体hst剑叶叶绿素含量与适温下相比变化并不明显;在相同的高温胁迫条件下,野生型中花11剑叶叶绿素含量的降幅明显高于突变体hst。这说明突变体hst的光合作用受高温热害的影响较野生型中花11小。
2.2.2 高温胁迫对水稻颖花可溶性蛋白、可溶性糖和脯氨酸含量的影响
2.2.2.1 对水稻颖花可溶性蛋白含量的影响
可溶性蛋白是重要的渗透调节物质和营养物质,能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用[20]。由图3可知,高温胁迫导致中花11及其突变体hst的颖花中可溶性蛋白含量

图2 花期高温胁迫对水稻剑叶中叶绿素含量的影响
Fig. 2. Effect of high temperature stress on chlorophyll content in flag leaf of rice at the flowering stage.
显著下降。高温处理1 d后这两个品系的颖花可溶性蛋白含量下降幅度达最大值,此时野生型中花11和突变体hst分别比适温下降低了49.50%和38.70%;高温下突变体hst的可溶性蛋白含量降幅低于野生型中花11。突变体hst颖花中可溶性蛋白含量在整个高温胁迫期间显著高于野生型中花11(处理7 d后除外)。
2.2.2.2 对水稻颖花可溶性糖含量的影响
植物体内糖的积累与细胞的渗透压有关,提高渗透性,降低水势,增强保水力,通过调节渗透浓度来启动脱落酸的形成,诱发蛋白质的合成,增加抗性[21]。由图4可知,高温胁迫导致中花11及其突变体hst的颖花可溶性糖含量均显著降低,处理7 d后降幅达最大值,此时野生型中花11比适温下降低41.54%,突变体hst比适温下降低26.34%。高温下突变体hst的可溶性糖含量降幅低于野生型中花11。突变体hst颖花中可溶性糖含量在整个高温胁迫期间显著高于野生型中花11(处理1 d后除外)。
2.2.2.3 对水稻颖花脯氨酸含量的影响
在逆境胁迫下,游离氨基酸可以维持细胞的水势,解除物质毒害和储存氮物质等。研究证实,在水分胁迫下,植物可通过游离氨基酸的累积参与渗透调节,通过渗透势的改变来维持膨胀,进而抵御高温干旱胁迫的影响[22]。由图5可知,随处理时间延长,中花11及其突变体hst的游离脯氨酸含量呈现持续下降趋势。与适温条件相比,高温胁迫1 d和3 d后两品系水稻颖花中游离脯氨酸含量均升高,且处理3 d后增幅达最大值,此时野生型中花11和突变体hst颖花中游离脯氨酸含量分别比适温下升高25.92%和11.31%。随后两品系水稻颖花中游离脯氨酸含量开始降低,处理5 d后脯氨酸含量显著低于适温水平;处理7 d后脯氨酸含量与适温下相比没有显著差异。在整个高温胁迫期间,突变体hst颖花中游离脯氨酸含量显著高于野生型中花11(处理7 d后除外)。
2.2.3 高温胁迫对水稻颖花SOD、POD和CAT活性的影响
2.2.3.1 对水稻颖花SOD活性的影响
在膜保护酶系统中,SOD可清除超氧阴离子和过氧化氢,减少膜系统所受的伤害[23]。由图6可见,高温胁迫下中花11及其突变体hst颖花中SOD活性随处理时间延长均呈现持续下降的趋势。与适温条件相比,两水稻品系SOD活性在高温胁迫1 d和3 d后均升高,高温胁迫5 d和7 d后均显著降低。高温下野生型中花11颖花中SOD活性显著高于突变体hst(处理1 d后除外)。
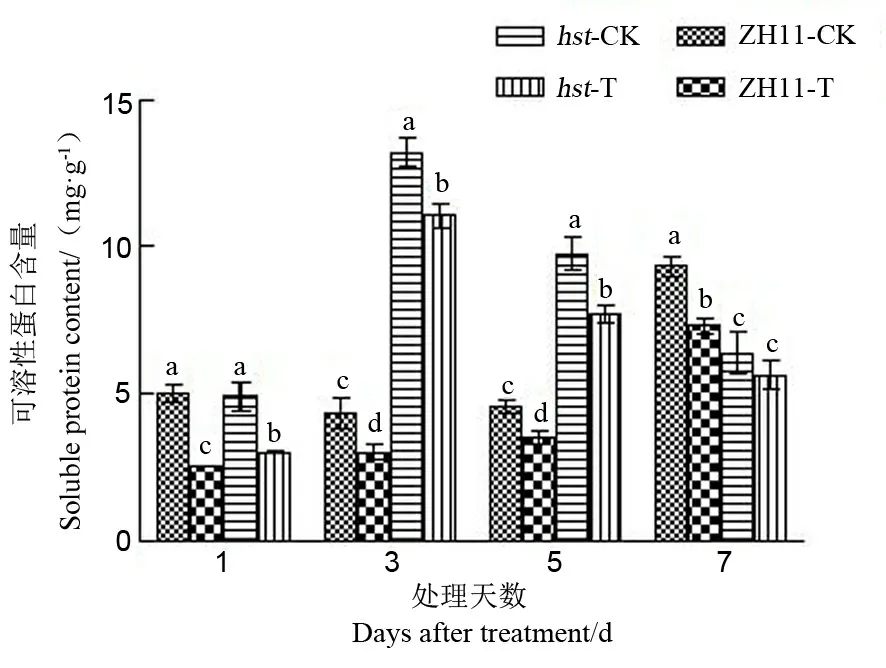
图3 花期高温胁迫对水稻颖花可溶性蛋白含量的影响
Fig. 3. Effect of high temperature stress on soluble protein content in spikelets of rice at the flowering stage.
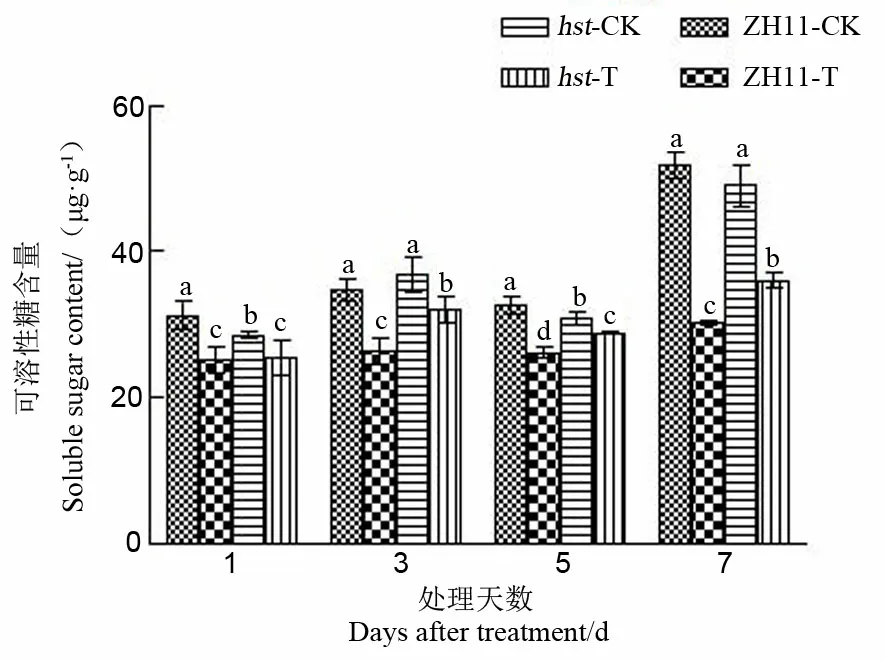
图4 花期高温胁迫对水稻颖花可溶性糖含量的影响
Fig.4. Effect of high temperature stress on soluble sugar content in spikelets of rice at the flowering stage.
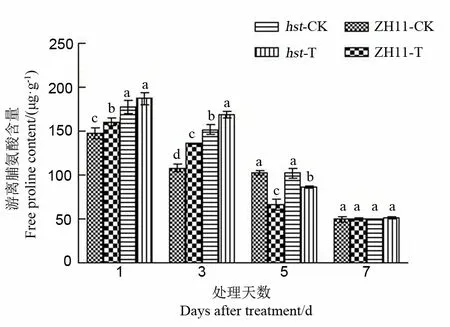
图5 花期高温胁迫对水稻颖花游离脯氨酸含量的影响
Fig. 5. Effect of high temperature stress on free proline content in spikelets of rice at the flowering stage.
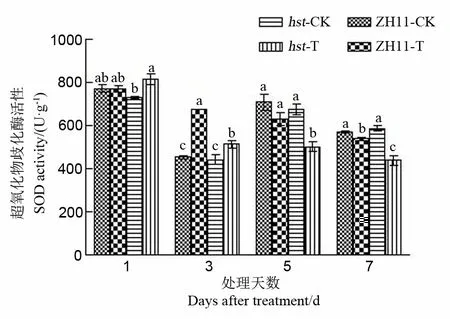
图6 花期高温胁迫对水稻颖花SOD活性的影响
Fig. 6. Effect of high temperature stress on SOD activity in spikelets of rice at the flowering stage.
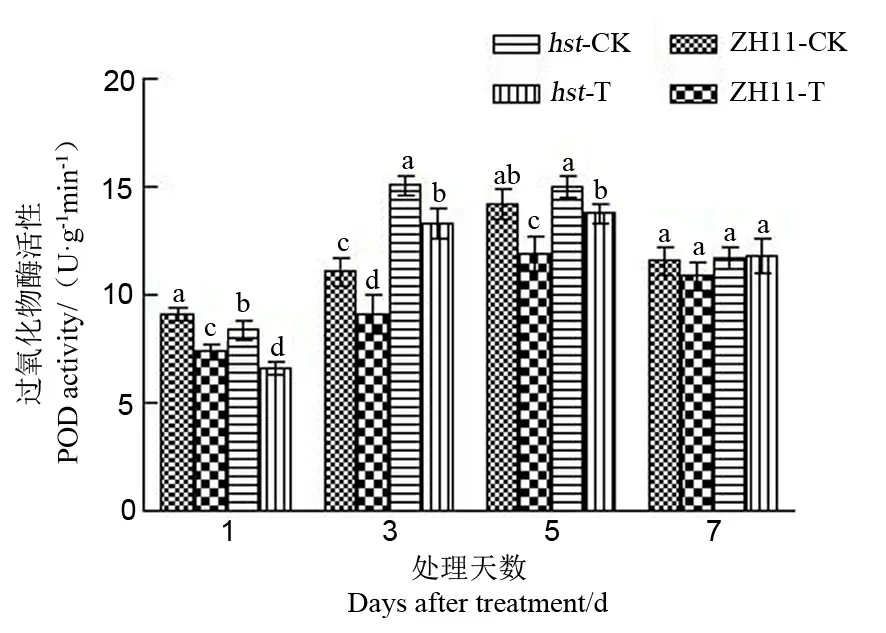
图7 花期高温胁迫对水稻颖花POD活性的影响
Fig. 7. Effect of high temperature stress on POD activity in spikelets of rice at the flowering stage.

图8 花期高温胁迫对水稻颖花CAT活性的影响
Fig. 8. Effect of high temperature stress on CAT activity in spikelets of rice at the flowering stage.
2.2.3.2 对水稻颖花POD活性的影响
POD主要作用在于清除活性氧,消除过氧化氢的危害,减少膜系统的伤害[24]。从图7中可以看出,POD活性随处理时间延长,呈现出先升后降的趋势,处理5 d后活性达最大值。与适温条件相比,高温处理1 d、3 d和5 d后两品系水稻颖花中POD活性均显著下降,高温处理7 d后POD活性变化均不显著。与野生型中花11相比,在相同高温处理1d后,突变体hst颖花中POD活性相对较低;而在高温处理3 d和5 d后突变体hst水稻颖花中POD活性均相对较高。
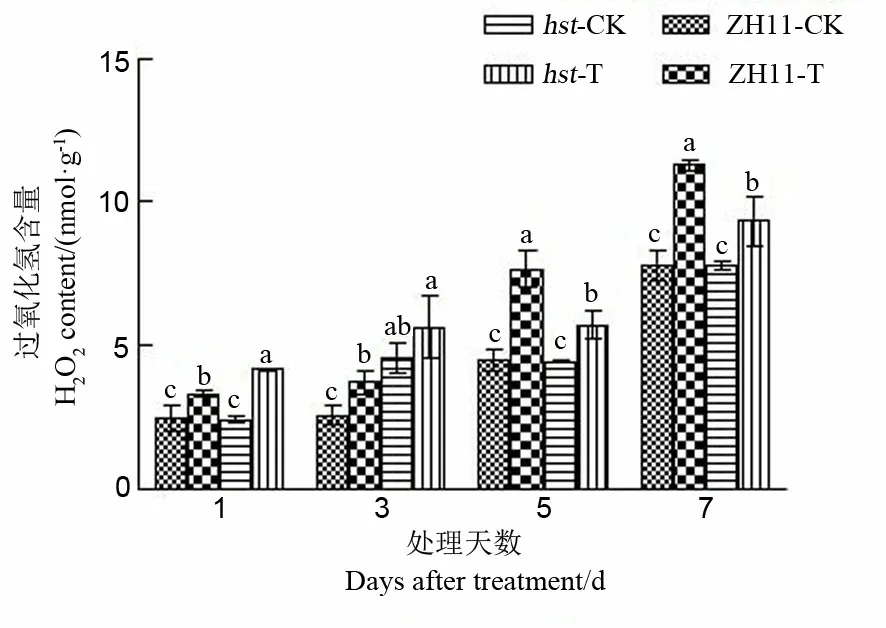
图9 花期高温胁迫对水稻颖花H2O2含量的影响
Fig. 9. Effect of high temperature stress on H2O2content in spikelets of rice at the flowering stage.
2.2.3.3 对水稻颖花CAT活性的影响
从图8中可知,CAT活性变化较为复杂,与适温条件相比,两水稻品系颖花中CAT活性在高温胁迫下均显著下降(处理3 d后除外);高温胁迫下两水稻品系颖花中CAT活性随处理时间延长,均呈现先升后降的趋势,处理3 d后达最大值,随后开始降低。同时可以看出,在高温处理下两水稻品系颖花中CAT活性存在显著差异,高温下突变体hst颖花中CAT活性显著高于野生型中花11。
2.2.4 高温胁迫对水稻颖花H2O2和MDA含量的影响
2.2.4.1 对水稻颖花H2O2含量的影响
H2O2是活性氧(ROS),激素等信号以及生物、非生物胁迫刺激均可诱导植物细胞内H2O2的产生和积累[25]。活性氧积累以及由此引发的膜脂过氧化是高温伤害的原因之一[26]。由图9可知,与适温条件相比,两品系水稻颖花H2O2含量在高温胁迫下均显著上升。在高温处理1 d和3 d后,突变体hst颖花中H2O2含量显著高于野生型中花11;而随着高温处理时间延长,高温处理5 d和7 d后,突变体hst颖花中H2O2含量显著低于野生型中花11。从颖花中H2O2含量变化上来看,突变体hst比野生型中花11变幅小(处理1 d后除外),即花期高温胁迫对两水稻品系颖花H2O2含量变化的影响存在差异。
2.2.4.2 对水稻颖花MDA含量的影响
MDA作为膜脂过氧化的最终产物,能够抑制细胞保护酶活性和降低抗氧化物的含量,从而加剧膜脂过氧化[27]。由图10分析可知,与适温条件相比,高温胁迫导致野生型中花11颖花中MDA含量显著升高(处理1 d后除外),而对突变体hst影响不明显。突变体hst颖花中MDA积累量在整个高温胁迫期间均显著低于野生型中花11。

图10 花期高温胁迫对水稻颖花MDA含量的影响
Fig. 10. Effect of high temperature stress on MDA content in spikelets of rice at the flowering stage.
3 讨论
温度是影响水稻生长的重要因子之一,温度过低或过高均不利于水稻生长[28,29]。高温胁迫导致水稻花期的花器官伤害,而花器官是与水稻产量关系最密切的器官,它的正常发育是水稻获得高产的关键。水稻花期日平均温度升高导致小穗不育率增加,尤其与日最高温度的关系更为密切[30]。本研究结果表明,花期高温胁迫明显降低了两水稻品系的每穗实粒数、单株产量和结实率,该结果与符冠富等[31]和Liao等[32]的研究结果相似。在高温胁迫下,与野生型中花11相比,突变体hst具有更高的每穗实粒数、单株产量及结实率,这表明中花11与其突变体hst在耐热性方面存在显著差异,突变体hst具有更强的高温耐性。高温下突变体hst的受精率远高于野生型中花11,这与其结实率及产量高于野生型中花11的趋势一致,说明高温胁迫下水稻开花受精受到影响,导致其结实率及单株产量的下降。此外,花期高温胁迫对突变体hst的千粒重影响较小,而提高了野生型中花11的千粒重,其具体机理还有待进一步研究。
叶绿素含量降低通常被认为是光合作用对高温胁迫响应的主要表现[33]。高温显著降低热敏感水稻品系的剑叶叶绿素含量,而耐热性品系在高温下能维持相对较高的光合速率[18]。因此,叶绿素含量变化可作为评判植物高温耐性的重要指标。本研究结果显示,高温胁迫下,两水稻品系剑叶中叶绿素含量均降低,野生型中花11剑叶中叶绿素降幅显著大于突变体hst,表明高温胁迫对突变体hst水稻剑叶光合作用的影响较野生型中花11小,高温下突变体hst能维持相对较高的光合强度,从而保证了供籽粒充实的光合产物的高效合成。
可溶性蛋白容易受到逆境胁迫的影响,是一种比较重要的渗透调节物质,其含量可以作为植物抗逆性的指标[34]。可溶性糖可维持细胞膜和原生质胶体的稳定性[35],高温下可溶性糖含量下降,可能是高温下水稻叶片蒸腾速率加快,为防止干旱胁迫,降低其可溶性糖含量以降低植物水势,从而维持细胞膜和原生质胶体的稳定性[36]。李萍萍等[37]研究高温对水稻剑叶生理特性时发现,高温加速了剑叶中可溶性糖和可溶性蛋白的含量降低。本研究结果也显示高温胁迫导致两水稻品系颖花中可溶性蛋白和可溶性糖含量显著下降,且突变体hst降幅小于野生型中花11。游离脯氨酸溶解度高,水合作用强,可提高原生质渗透压,防止和减少水分散失,对原生质有保护作用[38],但对于脯氨酸含量在逆境胁迫下的响应变化仍存在不同观点。有一些研究认为逆境胁迫下植物体内脯氨酸含量下降;另有些研究得出在逆境胁迫下,脯氨酸合成酶类对脯氨酸的反馈抑制的敏感性降低,导致脯氨酸含量升高。脯氨酸积累量可作为植物抗逆性的一个指标[39]。本研究结果表明,颖花中游离脯氨酸含量在高温处理初期显著升高,高温下突变体hst游离脯氨酸含量显著高于野生型中花11。本研究认为可溶性蛋白质、可溶性糖及游离脯氨酸含量高有助于维持颖花细胞较低的渗透水平、增强耐脱水能力、保护原生质体,以抵御高温胁迫的伤害。高温下突变体hst颖花中具有更多的渗透调节物质,因而具备了更强的生物膜保护能力,能保持膜结构及功能的相对稳定性,减少细胞内容物外渗,从而减轻高温对水稻颖花的伤害,增强了它耐受高温逆境的能力。
MDA作为脂质过氧化程度的指标,是脂质过氧化的一种典型产物[24]。本研究中,高温胁迫导致颖花膜脂过氧化程度加剧,MDA含量升高,这与张桂莲等[10]的研究一致。与突变体hst相比,高温下野生型中花11颖花中积累了更多的MDA,MDA大量与膜蛋白结合,造成膜结构破坏和功能丧失,质膜透性加大,电解质外渗,从而影响到花器官的生理生化机能。H2O2是植物代谢中产生的一种过氧化物,其积累对细胞具有氧化破坏作用,在逆境胁迫下可根据其值变化,来了解组织的破坏程度。本研究结果表明,高温胁迫初期突变体hst颖花中H2O2含量较野生型中花11显著升高,此时H2O2作为重要的抗性诱导因子,可触发植物细胞启动自我保护机制,产生大量的过氧化保护酶来清除体内过多的活性氧,减轻颖花受到的氧化胁迫,但随着胁迫时间延长,颖花抗氧化酶活性下降,颖花中H2O2积累量持续升高,颖花受到的氧化损伤程度不断加重,野生型ZH11比突变体hst积累了更多的H2O2,因而其颖花受到了更严重的氧化损伤。
SOD、POD和CAT是酶促活性氧清除系统的主要组成成分,对防止膜脂过氧化,减轻逆境造成的膜伤害和延缓植物衰老有重要作用,不同的酶对水稻开花期高温胁迫的反应有所不同[9]。本研究结果显示,高温下两水稻品系颖花中SOD活性随胁迫时间的延长持续下降,而POD和CAT活性呈先升高后下降的趋势,其中POD活性至处理5 d后达最大值,CAT活性至处理3 d后达最大值。联系到高温胁迫下MDA及H2O2含量的升高和酶活性的降低,说明高温胁迫会减弱水稻自身清除活性氧及防止膜脂过氧化的作用,造成生物膜结构的破坏和功能的丧失,严重影响水稻颖花的生理代谢,这可能是高温胁迫导致水稻热害的生理原因。
以上研究结果表明,高温胁迫下水稻剑叶中维持较稳定的光合作用,颖花中保持较多的渗透调节物质及较低的MDA和H2O2含量,使得水稻花器官具备较强的渗透调节能力和生物膜保护能力,从而保证了正常的授粉受精过程,维持了较高的结实率,这可能是突变体耐高温的生理基础。要明确突变基因在高温胁迫调控通路中发挥的作用,还需要利用分子生物学手段进行深入研究。
[1] Pachauri R K. Climate change 2007. Synthesis report, Contribution of Working Groups I, II and III to the fourth assessment report. 2008.
[2] Wang S W, Ye J L. Analysis of global warming during the last one hundred years.SciAtmosSin, 1995, 19(5): 545-553.
[3] Pens S B,Huang J L,Sheehy J E,et al.Rice yields decline with high temperature from global warming.PNAS, 2004, 101(27): 9971-9975.
[4] 吉林省教育系统科教兴农专家组. 水稻栽培技术. 长春: 吉林出版集团有限责任公司, 吉林科学技术出版社, 2008: 56-57.
The education system in Jilin Province by science and technology expert group. Rice Cultivation Technology. Changchun: Jilin publishing Refco Group Ltd, Jilin Science and Technology Press, 2008: 56-57. (in Chinese)
[5] 曲爱丽. 水稻花期耐高温突变体的遗传分析. 杭州: 中国计量学院, 2014.
Qu A L. Genetic analysis of the rice(OryzsativaL. ) high tolerance mutant during anthesis. Hangzhou: China Jiliang University, 2014. (in Chinese with English abstract)
[6] 符冠富, 张彩霞, 杨雪芹, 等. 水杨酸减轻高温抑制水稻颖花分化的作用机理研究. 中国水稻科学, 2015, 29(6): 637-647.
Fu G F, Zhang C X, Yang X Q, et al. Action mechanism by which SA alleviates high temperature-induced inhibition to spikelet differentiation.ChinJRiceSci, 2015, 29(6): 637-647. (in Chinese with English abstract)
[7] Satake T, Yoshida S. High temperature-induced sterility in indica rice at flowering.JpnJCropSci, 1978, 47: 6-17.
[8] 周建霞, 张玉屏, 朱德峰, 等. 高温后移对水稻颖花败育的影响. 中国农业气象, 2014, 35(5): 544-548.
Zhou J X, Zhang Y P, Zhu D F, et al. Effects of high temperature on rice spikelet sterility at flowering stage.ChinJAgrometeorol, 2014, 35(50): 544-548. (in Chinese with English abstract)
[9] 谢晓金, 申双和, 李秉柏, 等. 抽穗期高温胁迫对水稻开花结实的影响. 中国农业气象, 2009, 30(2): 252-256.
Xie X J, Shen S H, Li B B, et al. Influences of high temperature stress on blooming and seed setting of rice during heading stage.ChinJAgrometeorol, 2009, 30(2): 252-256. (in Chinese with English abstract)
[10]张桂莲, 张顺堂, 肖浪涛, 等. 花期高温胁迫对水稻花药生理特性及花粉性状的影响. 作物学报, 2013, 39(1): 177-183.
Zhang G L, Zhang S T, Xiao L T, et al. Effect of high temperature stress on physiological characteristics of anther and pollen traits of rice at flowering stages.ActaAgronSin, 2013, 39(1): 177-183. (in Chinese with English abstract)
[11]Jagadish S V K, Craufurd P Q, Wheeler T R.High temperature stress and spikelet fertility in rice.JExpBot, 2007, 58: 1627-1635.
[12]Prasad P V V,Boote K J,Allen L H Jr,et al.Species,ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature stress.FieldCropsRes, 2006, 95: 398-411.
[13]周建霞, 张玉屏, 朱德峰, 等. 高温下水稻开花习性对受精率的影响. 中国水稻科学, 2014, 28(3): 297-303.
Zhou J X, Zhang Y P, Zhu D F, Influence of flowing characteristics on spikelet fertility under high temperature.ChinJRiceSci, 2014, 28(3): 297-303. (in Chinese with English abstract)
[14] Rang Z W, Jagadish S, Zhou Q M, et al. Effect of high temperature and water stress on pollen germination and spikelet fertility in rice.EnvironExpBot, 2011, 70(1): 58-65.
[15]蔡冲, 姜维梅, 孙骏威. 植物生物学实验. 北京: 北京师范大学出版社, 2013: 55-58.
Cai C, Jiang W M, Sun J W. Plant Biological Experiment. Beijing: Beijing Normal University Press, 2013: 55-58. (in Chinese)
[16]胡雁春. 模拟酸雨对三叶草种子萌发及幼苗生理指标的影响. 安徽农业科学, 2014, 42(1): 85-86, 89.
Hu Y C. Study on the influence of simulated acid rain on clover.JAnhuiAgricSci, 2014, 42(1): 85-86, 89. (in Chinese with English abstract)
[17]刘海英, 王华华, 崔长海, 等. 可溶性糖含量测定(蒽酮法)实验的改进. 实验室科学, 2013, 16(2): 19-20.
Liu H Y, Wang H H, Cui C H, et al. Experiment improvement of the soluble sugar content determination by enthrone colorimetric method.LabSci, 2013, 16(2): 19-20. (in Chinese with English abstract)
[18]赵英永, 戴云, 崔秀明, 等. 考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量. 云南民族大学学报:自然科学版, 2006, 15(3): 235-237.
Zhao Y Y, Dai Y, Cui X M, et al. Determination of protein contents of radix aconiti kusnezoffii using Coomassie Brillant Blue G-250 dye binding.JYunnanNatUniv:NatSciEd), 2006, 15(3): 235-237. (in Chinese with English abstract)
[19]张桂莲, 陈立云, 雷东阳, 等. 水稻耐热性研究进展. 杂交水稻, 2005, 20 (1): 1-5.
Zhang G L, Chen L Y, Lei D Y, et al. Progress in research on heat tolerance in Rice.HybridRice, 2005, 20 (1): 1-5(in Chinese with English abstract).
[20]李轶冰, 杨顺强, 任广鑫, 等. 低温处理下不同禾本科牧草的生理变化及其抗寒性比较. 生态学报, 2009, 29(3): 1341-1347.
Li Y B, Yang S Q, Ren G X, et al. Changes analysis in physiological properties of several gramineous grass species and cold-resistance comparison on under cold stress.ActaEcolSin, 2009, 29(3): 1341-1347. (in Chinese with English abstract)
[21]和红云, 薛琳, 田丽萍, 等. 低温胁迫对甜瓜幼苗根系活力及渗透调节物质的影响. 石河子大学学报: 自然科学版, 2008, 26(5): 583-586.
He H Y, Xue L, Tian L P, et al. Effect of low temperature stress on root vigor and osmotic adjustment matter in Muskmelon Seedlings.JShiheziUniv:NatSci, 2008, 26(5): 583-586.(in Chinese with English abstract)
[22]Bohnert H J, Nelson D E, Jensen R G. Adaptations to environmental stresses.PlantCell, 1995(7): 1099-1111.
[23]Noctor G, Foyer C H. Ascorbate and glutathione: Keeping active oxygen under control.AnnuRevPlantPhysialPlantMolBiol, 1998, 49: 249-279.
[24]Quartacci M F, Navarilzzo F. Water stress and free radical mediated changes in sunflower seeding.PlantPhysiol, 1991, 139(5): 621-625.
[25]贺丹, 毛仓仓, 陈颖, 等. H2O2对牡丹愈伤组织分化及抗氧化酶活性的影响. 湖北农业科学, 2015, 54(1): 122-125.
He D, Mao C C, Chen Y, et al. Effects of on callus differentiation and antioxidant enzymes activity of peony.HubeiAgricSci, 2015, 54(1): 122-125. (in Chinese with English abstract)
[26]宋建, 乐明凯, 符冠富, 等. 水稻高温胁迫伤害机理研究进展. 中国稻米, 2009, 6: 8-14.
Song J, Le M K, Fu G F, et al. Progress in the study of damage mechanism of rice under high temperaturestress.ChinaRice, 2009, 6: 8-14. (in Chinese)
[27]杨春祥, 李宪利, 高东升, 等. 低温胁迫对油桃花器官膜脂过氧化和保护酶活性的影响. 果树学报, 2005, 22(1): 69-71.
Yang C X, Li X L, Gao D S, et al. Effects of chilling stress on membrane lipid peroxidation and activities of protective enzymes in nectarine flower organs.JFruitSci, 2005, 22(1): 69-71. (in Chinese with English abstract)
[28]李训贞, 梁满中, 周广洽, 等. 水稻开花时的环境条件对花粉活力和结实的影响. 作物学报, 2008, 28(3): 417-420.
Li X Z, Liang M Z, Zhou G Q, et al Effect of environment condition on pollen vigor and seed set during flowing time of rice.ActaAgronSin, 2008, 28(3): 417-420. (in Chinese with English abstract)
[29]Zhang C X, Fu G F, Yang X Q, et al. Heat stress effects are stronger on spikelets than on flag leaves in rice due to differences in dissipation capacity.JAgronCropSci, 2015, doi: 10. 1111/jac, 12138.
[30]陶龙兴, 谈惠娟, 王熹, 等. 超级杂交稻国稻6号对开花结实期高温热害的反应. 中国水稻科学, 2007, 21(5): 518-524.
Tao L X, Tan H J, Wang X, et al. Effects of high temperature stress on sperhybird rice Guodao 6 during flowering and filling phases.ChinJRiceSci, 2007, 21(5): 518-524. (in Chinese with English abstract)
[31]符冠富, 宋健, 廖西元, 等. 中国常用水稻保持系及恢复系开花灌浆期耐热性评价. 中国水稻科学, 2011, 25(5): 495-500.
Fu G F, Song J, Liao X Y, et al. Thermal resistance of common rice maintainer and mestorer lines to high temperature stress during flowering and early grain filling stages.ChinJRiceSci, 2011, 25(5): 495-500. (in Chinese with English abstract)
[32] Liao J L, Zhang H Y, Shao X L, et al. Identificantion for heat tolerance in backcross recombinant screening of backcross introgression lines with heat tolerance at milky stage in rice.RiceSci, 2011, 18: 279-286.
[33]李永庚, 于振文, 张秀杰, 等. 小麦产量与品质对灌浆不同阶段高温胁迫的响应. 植物生态学报, 2005, 29(3): 461-466.
Li Y K, Yu Z W, Zhang X J, et al. Response of yield and quality of wheat to heat stress at different grain filling stages.ActaPhytoecolSin, 2005, 29(3): 461-466. (in Chinese with English abstract)
[34]薛建鹏, 王秋玉, 任欢. 干旱胁迫下白桦主要生理指标的变化及相互关系. 东北林业大学学报, 2007, 35(8): 12-15.
Xue J P, Wang Q Y, Ren H. Drought stress-induced responses of physiological indices ofBetulaplatyphylla.JNortheastForUniv, 2007, 35(8): 12-15(in Chinese with English abstract).
[35]杨升, 张华新, 张丽. 植物耐盐生理生化指标及耐盐植物筛选综述. 西北林学院学报, 2010, 25(3): 59-65.
Yang S, Zhang H X, Zhang L. Physiological and biochemical indices of salt tolerance and scanning of salt-tolerance plant: A review.JNorthwestForUniv, 2010, 25(3): 59-65. (in Chinese with English abstract)
[36]张桂莲, 张顺堂, 肖浪涛, 等. 抽穗开花期高温胁迫对水稻花药、花粉粒及柱头生理特性的影响. 中国水稻科学, 2014, 28(2): 155-166.
Zhang G L, Zhang S T, Xiao L T, et al. Effect of high temperature stress on physiological characterstics of anther, pollen and stigma of rice during head-flowering stage.ChinJRiceSci, 2014, 28(2): 155-166. (in Chinese with English abstract)
[37]李萍萍,程高峰,张佳华,等. 高温对水稻抽穗扬花期生理特性的影响. 江苏大学学报,2010,31(2): 125-130.
Li P P, Cheng G F, Zhang J H, et al. Effects of high temperature stress on physiological characteristics of rice during heading and flowering period.JJiangsuUniv,2010, 31(2): 125-130. (in Chinese with English abstract)
[38]Anjum S A, Xie X Y, Wang L C, et al. Morphological, physiological and biochemical responses of plants to drought stress.AfricJAgricRes, 2011, 6(9): 2026-2032.
[39]Pongprayoon W, Chaum S, Pichakum A, et al. Proline profiles in aromatic rice cultivars photoautotrophically grown in responses to salt stress.InterJBot,2008,4(3): 276-282.
Effect of High Temperature Stress on Physiological Characteristics of Spikelet of Rice During Flowering Stage
LAN Xu, GU Zheng-dong, DING Yan-fei, WANG Ke, JIANG Qiong, ZHU Cheng*
(CollegeofLifeScience,ChinaJiliangUniversity/KeyLaboratoryofMarineFoodQualityandHazardControllingTechnologyofZhejiangProvince,Hangzhou310018,China;*Corresponding author, E-mail: pzhch@cjlu.edu.cn )
To ascertain the effect of high temperature stress on the physiological characteristics of rice spikelet at flowing stage, wild type Zhonghua 11(ZH11) and its heat-resistant mutant (hst) were exposed to heat stress (40℃,6 h per day) for 7 days in growth chambers. The results showed that under heat stress the chlorophyll content in flag leaf, soluble protein and soluble sugar contents in spikelet of rice decreased obviously with lower decline in the mutanthstcompared to the wild type ZH11. While malonyldialdehyde (MDA), hydrogen peroxide(H2O2) and free proline contents in spikelets increased significantly with greater increase in wild type ZH11 than in the mutanthst. Superoxide dismutase (SOD), catalase (CAT) and peroxidase(POD) activities showed different responses to high temperature stress, and the correlation between the enzyme activities and the thermal sensitivity would be further investigated. Under high temperature stress, higher photosynthesis efficiency, better osmotic adjustment ability as well as lower MDA and H2O2content of spikelets in the mutant could be the physiological basis of high temperature tolerance.
rice; flowering stage; high temperature stress; spikelet; physiological characteristics
2015-12-02; 修改稿收到日期: 2016-03-09。
国家自然科学基金资助项目(31401299,31470368,31170251,31101133); 浙江省自然科学基金资助项目(LZ14C020001)。
Q785; S435.112+.3
A
1001-7216(2016)06-0637-10
兰旭, 顾正栋, 丁艳菲, 等. 花期高温胁迫对水稻颖花生理特性的影响. 中国水稻科学, 2016, 30(6): 637-646.
