高压静电场处理种子对小麦幼苗抗寒性的影响
2016-12-04唐山学院河北唐山063000
, , (唐山学院, 河北 唐山 063000)
高压静电场处理种子对小麦幼苗抗寒性的影响
黄洪云,杜宁,韩哲
(唐山学院, 河北 唐山 063000)
电场处理强度为EN=0.5×N(kV/cm),N=0,1,2,…,12,对照组为E0(电场未处理),处理时间T=10 min和T=5 min处理小麦干种子。处理组幼苗在4 ℃的条件下进行低温胁迫处理,研究小麦幼苗各项抗寒性指标:相对电导率、可溶性蛋白含量、脯氨酸含量、丙二醛含量和3种保护酶(POD、SOD、CAT)活性的变化情况。结果表明,电场预处理小麦种子不但明显提高了幼苗叶片的脯氨酸含量,而且提高幼苗的抗低温胁迫能力。处理组幼苗在4 ℃的低温胁迫条件下与对照组相比具有较高的过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)的活性及可溶性蛋白质含量。同时电场处理还降低了幼苗叶片的相对电导率及MDA含量,且小麦幼苗各个抗寒性指标变化的最大幅值均出现在处理条件4.5 kV/cm,10 min,由此得出高压静电场处理种子提高小麦幼苗的抗寒性的最佳处理条件。
静电场; 小麦; 抗寒性指标
小麦是我国的主要粮食作物,而冻害和冷害是小麦生产上最大的自然灾害。有文章报道了高压静电场对小麦种子的生物学效应研究[1],不同静电场处理对小麦幼苗的各种生物学指标有不同程度的影响,并从物理学方面进行了机理解释。为此,本实验在前文的研究基础上,进一步研究高压静电场处理种子对小麦幼苗抗寒性的影响。
1 材料和方法
1.1 种子处理
材料为“京东8号”小麦品种,挑选大小均匀的小麦种子随机分成13组,每组100粒种子,3次重复,其中1组为空白对照,其余用不同高压静电场处理。场强EN=0.5×N(kV/cm),N=0,1,2,…,12,对照组为E0(电场未处理),电场处理时间T=10 min和T=5 min。
将对照和电场处理的种子在25 ℃恒温培养箱中发芽,培养14 d,待小麦长到三叶期置于4 ℃低温培养箱中进行72 h胁迫处理,测定处理组和对照组幼苗子叶相对电导率、可溶性蛋白质含量、脯氨酸含量、丙二醛含量和酶活性的测定。
1.2 测试项目及方法
植物组织受到逆境伤害时,由于膜的功能受损或结构破坏,而使其透性增大,细胞内的盐类或有机物将有不同程度生出,从而引起组织浸泡液电导率发生变化。通过测定外渗液电导率的变化,就可以反映出质膜的伤害程度和所测材料抗逆性的大小,伤害越重,外渗越多,电导率的值也就越大,用电导法测定电导率[2],脯氨酸含量测定采用磺基水杨酸提取比色法测定,可溶性蛋白含量的测定用考马斯亮蓝 G-250染色法[3],MDA含量采用硫代巴比妥酸法[4],SOD活性测定采用NBT光化还原法[5],过氧化氢酶(CAT)活性采用碘量法测定[5],过氧化物酶(POD)活性测定采用愈创木酚法[6],以上实验均取重复3次测量的平均值。
2 结果分析
2.1 电场处理对叶片相对电导率的影响
由图1可知,在冷害胁迫条件下,不同电场处理条件对小麦幼苗叶片电导率影响不同。不同电场处理强度相同作用时间,相对电导率随处理电场强度的变化呈非单调型变化曲线;相同电场强度下不同处理时间对相对电导率的影响也不相同。
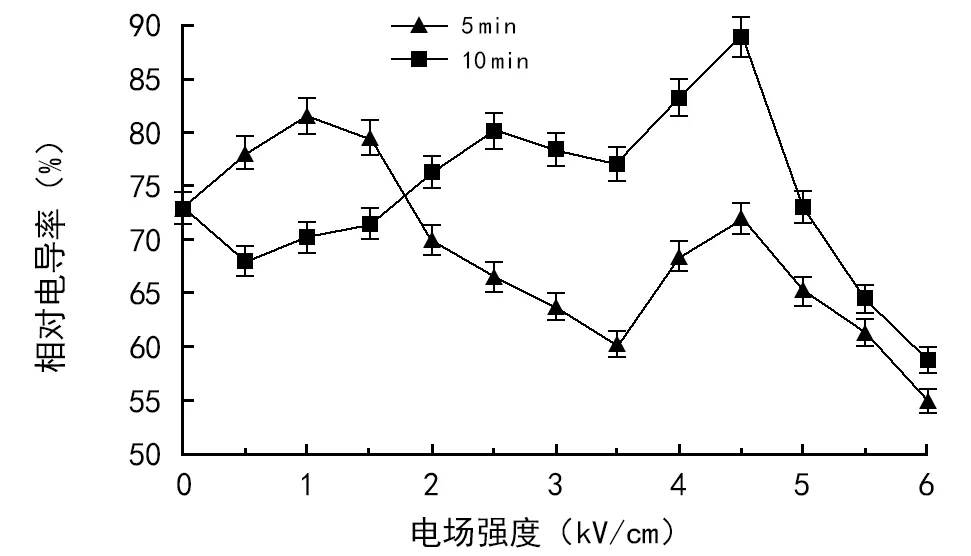
图1 不同电场对相对电导率的影响
电场处理种子5 min,小麦幼苗叶片的相对电导率大部分低于对照,降幅为1.4%~24.6%,场强6.0 kV/cm时降幅最大为24.6%,场强为0.5,1.0,1.5 kV/cm时,小麦幼苗叶片的相对电导率有一定提高,增幅为7.0%~11.6%。
电场处理小麦种子10 min,在2.0~4.5 kV/cm的场强范围内,小麦幼苗叶片的相对电导率高于对照组,增幅为4.5%~21.8%,其它处理电场强度下,小麦幼苗叶片的相对电导率均低于对照组,下降幅度为2.1%~19.5%。
2.2 电场处理对叶片可溶性蛋白含量的影响
不同电场处理条件对幼苗叶片可溶性蛋白含量影响不同。处理时间一定时,随着处理电场强度的增加,可溶性蛋白含量呈非单调型变化。不同电场处理时间对可溶性蛋白含量的影响也不同。
电场处理5 min,场强为0.5,1.0,1.5 kV/cm时,小麦幼苗叶片的可溶性蛋白含量均提高,增幅为3.0%~11.5%,场强范围2.0~6.0 kV/cm时,可溶性蛋白含量均下降,降幅为3.8%~30.4%。电场处理10 min,场强为2.0~5.0 kV/cm的范围内,幼苗叶片的可溶性蛋白含量高于对照,其中电场强度为4.0,4.5 kV/cm 2个电场强度下,增幅分别为13.4%和20.4%。其它各个电场强度下可溶性蛋白含量均降低,降幅为1.0%~19.8%。
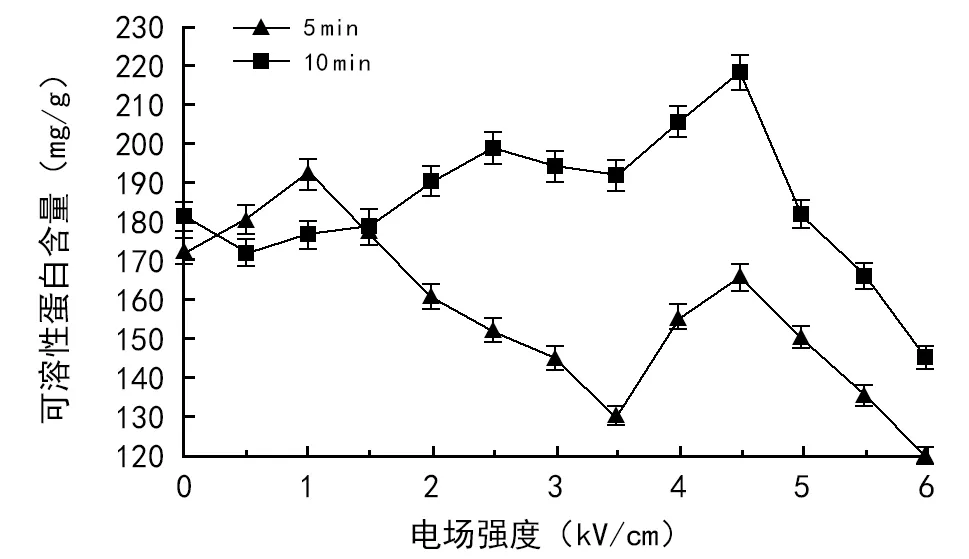
图2 不同电场对可溶性蛋白含量的影响
2.3 电场处理对叶片脯氨酸含量的影响
不同处理条件对幼苗叶片脯氨酸含量影响不同。一定处理时间条件下,脯氨酸含量随着处理电场强度的变化呈非单调型变化;不同处理时间对脯氨酸含量的影响也不同。
电场处理5 min,小麦幼苗叶片的脯氨酸含量大部分低于对照,降幅为0.79%~100%,场强为6.0 kV/cm时降幅最大,为100%。电场处理10 min的小麦幼苗叶片的脯氨酸含量在场强为4.5 V/cm时增幅最大,为56.2%,其它各处理脯氨酸含量均降低,最大降幅为39.1%,处理场强为6.0 kV/cm。
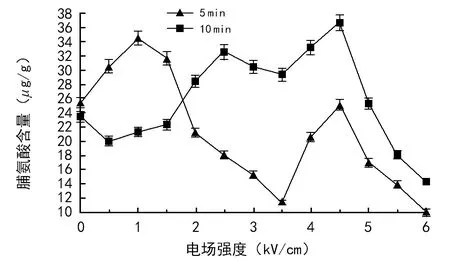
图3 不同电场对脯氨酸含量的影响
2.4 电场处理对叶片丙二醛含量的影响
由图4可看出,不同处理电场强度对小麦幼苗叶片MDA含量的影响不同,处理时间不同对MDA含量的影响也有差异。处理时间一定条件下,随着处理电场强度的增加,小麦幼苗MDA含量呈非单调型变化。不同处理时间对小麦幼苗MDA含量的影响也不同。电场处理10 min,多数处理条件下小麦幼苗MDA含量减少。
电场处理5 min,小麦幼苗叶片MDA含量在场强6.0 kV/cm时增幅最大,为37.2%,在电场强度为1.0 kV/cm时降幅最大,为6.5%。电场处理10 min,小麦幼苗叶片的MDA含量在场强4.5 kV/cm时降幅最大,为26.3%,这表明小麦幼苗的抗寒性指标有了明显提高。
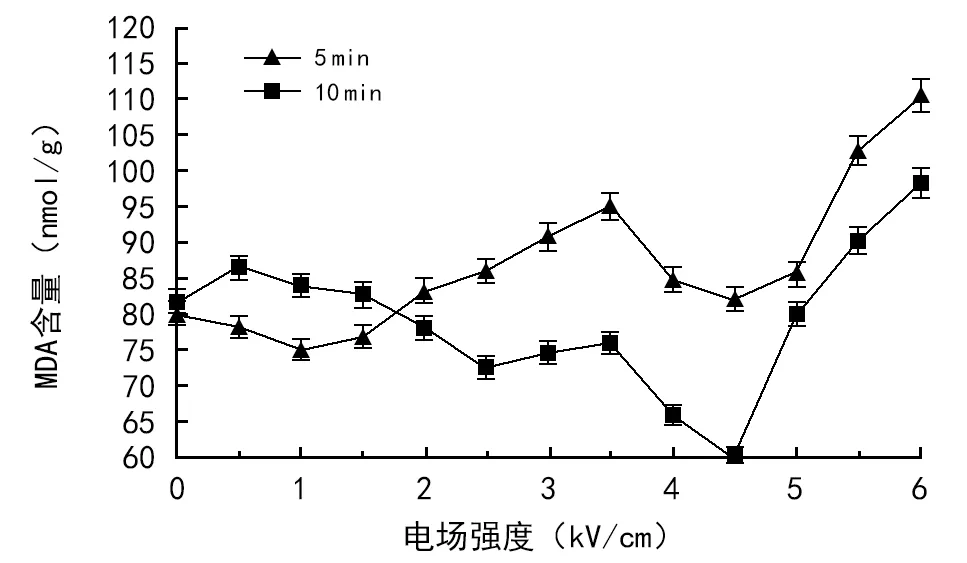
图4 不同电场对MDA含量的影响
2.5 电场处理对叶片酶活性的影响
不同电场处理强度对小麦幼苗叶片酶的活性产生不同影响,一定处理时间条件下,随着处理电场强度的增加,酶的活性呈非单调型变化;相同电场强度处理不同作用时间对小麦幼苗叶片酶的活性影响也不相同,不同处理时间对小麦幼苗POD活性的影响也不同。
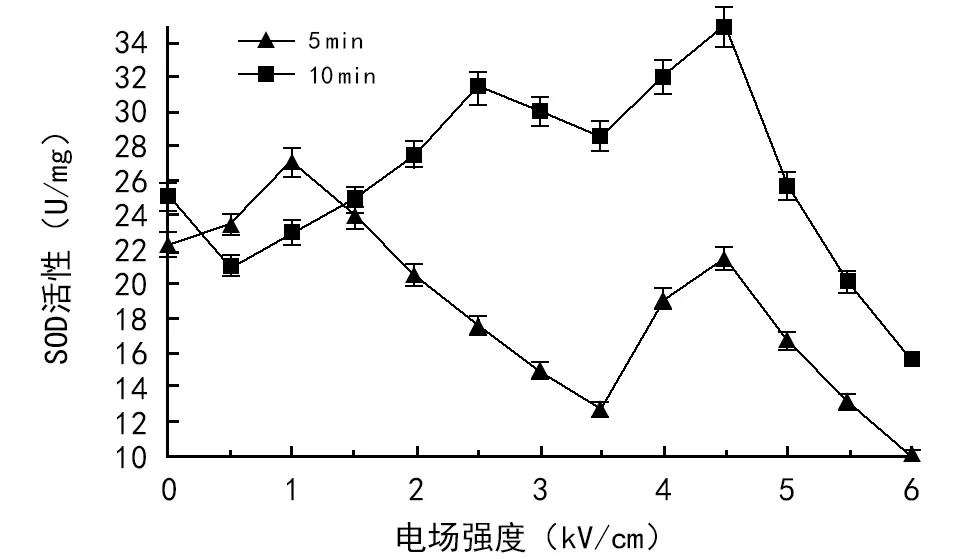
图5 不同电场对POD活性的影响

图6 不同电场对SOD活性的影响
电场处理5 min,小麦幼苗叶片POD活性在场强0.5,1.0,1.5 kV/cm时有所增加外,其它处理组POD活性均减少。电场处理10 min,POD活性在2.0~4.5 kV/cm的场强范围内高于对照组,且在4.5 kV/cm时增幅最大,为58.7%。
电场处理5 min,小麦幼苗叶片的SOD活性在场强为1.0 kV/cm时增幅最大,为21.5%,电场强度为6.0 kV/cm时降幅为55.2%。处理10 min,SOD活性在场强为4.5 kV/cm时增幅最大,为39.2%。
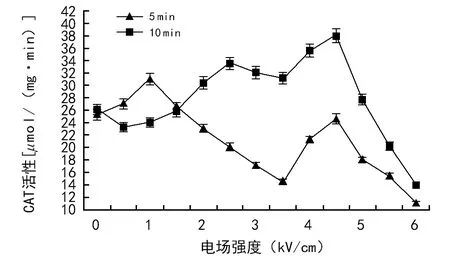
图7 不同电场对CAT活性的影响
电场处理5 min,小麦幼苗叶片的CAT活性在电场强度为1.0 kV/cm时增幅最大,为23.0%,场强为6.0 kV/cm时降幅最大,为56.3%。电场处理10 min,POD活性在电场强度为4.5 kV/cm时增幅最大,为45.0%。
3 小 结
当小麦叶片受到低温胁迫后,细胞膜结构遭到破坏,细胞膜透性增大,使细胞内的电解质外渗,从而小麦浸泡的电导率增大。电导率越大,植物叶片的抗寒性越弱,植物组织所受伤害越大;电导率越小,植物叶片的抗寒性越强,伤害越小[7]。合适的静电场处理降低了小麦幼苗叶片浸出液的相对电导率,是因为电场作用使细胞膜功能受损或膜结构破坏,使细胞膜透性增大,电解质外渗增强, 从而浸出液电导率增大。可溶性蛋白含量与植物的抗寒能力之间存在密切的关系,低温胁迫条件下,植物体内的可溶性蛋白含量降低,而一定的电场处理能有效地提高叶片的可溶性蛋白含量,从而提高有机体的抗寒能力。静电场处理种子可以提高代谢酶系及保护酶系的活力[8]。酶活性的提高使幼苗具有旺盛的生命力,同时也为幼苗对低温的耐受性奠定了物质基础。酶的活性电场处理组高于对照组,在低温胁迫条件下蛋白质的合成减缓,而电场处理的小麦幼苗叶片的可溶性蛋白含量迅速升高,POD、SOD、CAT活性增加速率比对照组快,从而各处理组清除自由基的能力迅速提高,因此对照组的调节能力比电场处理组差,POD、SOD、CAT活性上升缓慢,所以对照组的MDA含量高于处理组。综上表明,静电场处理的小麦种子其幼苗的耐寒性一定高于对照组,综合比较各个抗寒性指标的变化情况,以上各个电场强度和作用时间的组合,得到电场处理小麦种子提高幼苗抗寒性的最佳电场处理条件为4.5 kV/cm,作用时间为10 min,本研究为静电场应用于生产实践提供了实验依据,静电场对小麦的生物学效应的机理解释提供了理论依据。
[1]黄洪云.高压静电场对小麦种子生物学效应的物理机理研究[J].种子,2015,34(6):99-101.
[2]郝再彬,苍晶,徐仲.植物生理学实验[M].哈尔滨:哈尔滨工业大学出版社,2004:111-113.
[3]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein synthesis in tortulia turalis[J]. Plant Physical,1991,95:648.
[4]Heath R L,Packer L.Photoperoxidation in isolated chloroplasts. I. kinetics and stoichiometry of fatty acid peroxidation[J]. Arch Biochem Biophys.1968,125:189-198.
[5]田廷亮,扶惠华. 植物生长物质及其应用[M].北京:科学技术文献出版社,1995:291-296.
[6]朱广廉,钟诲文,张爱琴.植物生理学实验[M].北京:科学出版社,1990:252-253,37-39,175-178.
[7]张亚琳,衣莹,林凤,等.低温胁迫对小麦族物种抗寒生理的影响[J].沈阳农业大学学报,2012,43(4):406-410.
[8]赵剑,马福荣,杨文杰,等.高压静电场(HVEF)对大豆种子吸胀冷害的影响[J].生物物理学报,1995,11(4):595-598.
Effects of Wheat Seedling Cold Resistance Through Pretreatment of Seeds with High Voltage Electrostatic Field
HUANGHongyun,DUNing,HANZhe
(Department of tangshan college,Tangshan Hebei 063000,China)
The wheat seeds treated with high voltage electrostatic field which doses wereEN=0.5×N(kV/cm),N=1, 2, …,12,E0(control),and the times were 5 min,10 min.pretreatment groups seedlings at 4 ℃ temperature had much higher the relative conductivity,soluble protein content,proline content.The content of malondialdehyde and enzyme activities of POD,SOD,CAT were higher than those in control.The experiment results showed that the best processing condition was 4.5 kV/cm,10 min.
electrostatic field; wheat; cold resistance index
2016-04-11
2015年度唐山市科技计划项目(编号:15130261 a)。
黄洪云(1979—),女,河北唐山人;硕士,副教授,主要从事生物物理研究;E-mail:lzyhhy0922@163.com。
10.16590/j.cnki.1001-4705.2016.08.024
S 512.1
A
1001-4705(2016)08-0024-04
