道地药材射干快繁体系的建立
2016-12-04广西大学农学院南宁50004亚热带生物资源保护与利用国家重点实验室广西南宁50004广西农业科学院水稻研究所广西作物遗传改良重点实验室南宁50004
, , , , (.广西大学农学院, 南宁 50004;2.亚热带生物资源保护与利用国家重点实验室, 广西 南宁 50004; .广西农业科学院水稻研究所/广西作物遗传改良重点实验室, 南宁 50004)
道地药材射干快繁体系的建立
薛艳霞1,2,张慧英1,郭辉3,洪登伟1,2,刘芳1,2
(1.广西大学农学院, 南宁 530004;2.亚热带生物资源保护与利用国家重点实验室, 广西 南宁 530004; 3.广西农业科学院水稻研究所/广西作物遗传改良重点实验室, 南宁 530004)
目的:建立射干快速繁殖体系,为人工栽培提供优良种苗。方法:以道地药材射干的根茎芽和茎腋芽为外植体,通过正交混合设计法筛选出影响诱导丛生芽增殖的主次因素。利用组织培养技术摸索适宜丛生芽增殖不同附加物的浓度。结果与结论:茎腋芽是最佳的外植体,丛生芽增殖的最佳培养基是MS+BA 2.0 mg/L+NAA 0.5 mg/L+糖6%+琼脂5%,丛生芽数目为207个,增殖率高达690.0%。
射干; 丛生芽; 快速繁殖
射干(Belamcandachinensis(L.) DC.)为鸢尾科鸢尾属多年生草本植物。其主治咽喉肿痛、痰咳气喘、扁桃体炎、咽喉炎、关节炎、牙痛、月经不调等症。临床上,以射干为主要成分的复方有射干口服液;射干麻黄汤;射干麻黄冲剂;加味射干麻黄汤;射干润喉片[1]。射干常规繁殖主要有种子繁殖和根状茎繁殖,种子繁殖发芽率低且至少需要3年时间。根状茎繁殖费时费力,用种量大,且长期进行无性繁殖导致种质退化,影响产量及品质,无法满足目前市场的大量需求和品质要求。组织培养可实现种苗的大量快速繁殖,具有重要的科研和生产意义[2]。前期已经建立以叶片为外植体诱导愈伤组织植株再生体系以及对射干试管根茎的诱导做了系统研究[3-5]。王晓炜等[6]以幼茎为外植体诱导愈伤组织建立快繁体系。但以根茎芽和茎腋芽为外植体诱导丛生芽的快速繁殖体系未见有相关报道。本研究以根茎芽和茎腋芽外植体建立射干快繁体系技术,为射干人工栽培提供大量优质种苗。
1 材料与方法
1.1 材 料
以射干根茎芽和茎腋芽为外植体(经中国医学科学院药用植物研究所马小军教授鉴定)。
1.2 方法
1.2.1 多因素试验
为摸索影响射干丛生芽诱导的主要因素和次要因素,采用正交混合设计法L16(43×21)研究培养基、细胞分裂素、NAA和外植体不同组合对丛生芽增殖的影响(表1)。试验选取生长健壮的茎腋芽和新鲜的根茎芽接种在不同的诱导培养基上。每个处理接种6瓶,每瓶5块,每隔3 d观察1次,1个月后统计丛生芽的增殖率。
表1 L16(43×21)正交试验方案

因素A培养基B细胞分裂素(mg/L)CNAAD外植体试验号1MSBA(1.0)0根茎芽21/2MSKT(1.0)0.5茎腋芽3B5Zip(1.0)1.04N6ZT(0.1)1.5
1.2.2 BA不同浓度对丛生芽增殖的影响
将初代培养获得的无菌芽切成1.2 cm长,接种到以MS+NAA 0.5 mg/L为基本培养基,添加不同浓度(0.5,1.0,2.0, 3.0 mg/L)的BA培养基上,每个处理接种10瓶,每瓶接3个。每隔3 d观察1次,1个月后统计丛生芽数、芽增殖率。
1.2.3 不同糖浓度对丛生芽增殖的影响
将无菌苗切割成约1 cm长,3株为1丛接种在以MS+BA 2 mg/L,添加不同糖浓度(2.0%,4.0%,6.0%,8.0%)的增殖培养基上,每个处理接种10瓶,每瓶接3个。每隔3 d观察1次,1个月后统计丛生芽数、芽增殖率。
2 结果与分析
2.1 多因素试验
试验选取生长健壮的射干根茎芽和茎腋芽接种在不同的增殖培养基上。试验结果见表2。
表2 L16(43×21) 正交试验结果

因素A培养基B细胞分裂素(mg/L)CNAA(mg/L)D外植体增殖率(%)试验号11(MS)1(BA)4(1.5)1(根茎芽)501.0722(1/2MS)1(BA)1(0)2(茎腋芽)467.8533(B5)1(BA)3(1.0)2(茎腋芽)421.3344(N6)1(BA)2(0.5)1(根茎芽)428.5451(MS)2(KT)3(1.0)2(茎腋芽)443.3362(1/2MS)2(KT)2(0.5)1(根茎芽)425.4773(B5)2(KT)4(1.5)1(根茎芽)402.3384(N6)2(KT)1(0)2(茎腋芽)397.6591(MS)3(Zip)1(0)1(根茎芽)446.52102(1/2MS)3(Zip)4(1.5)2(茎腋芽)421.92113(B5)3(Zip)2(0.5)2(茎腋芽)395.14124(N6)3(Zip)3(1.0)1(根茎芽)370.20131(MS)4(玉米素)2(0.5)2(茎腋芽)506.71142(1/2MS)4(玉米素)3(1.0)1(根茎芽)487.03153(B5)4(玉米素)1(0)1(根茎芽)422.25164(N6)4(玉米素)4(1.5)2(茎腋芽)403.47Ⅰ1897.631818.791734.273483.41Ⅱ1802.271668.781755.863457.4Ⅲ1641.051633.781721.89Ⅳ1599.861819.461728.796940.81(总和)R297.77185.6833.9726.01
从表2可以看出:第13号试验芽增殖率最高,为506.71%,其培养条件为A1B4C2D2,即用MS作为基本培养基,细胞分裂素为玉米素,NAA浓度为0.5 mg/L,茎腋芽为外植体。比较Ⅰ、Ⅱ、Ⅲ和Ⅳ,可以得出“算一算”的好条件是A1B4C2D1,因素A、B和C的位极同 “直接看” 一样,仅D的位极不同。比较极差R,得出影响射干丛生芽增殖率的主次因素依次为培养基A>细胞分裂素>NAA>外植体。由此可以估计“直接看”和“算一算”的效果可能差别不大,即利用根茎芽和茎腋芽作为外植体对丛生芽增殖率的影响差异不显著。BⅣ-BⅠ=0.67,即细胞分裂素BA和玉米素对丛生芽增殖率的影响差异不大,但从经济角度考虑,用BA代替玉米素可以大幅度降低成本。综合上述分析可以得出,较优组合为A1B1C2D1:即用MS作为基本培养基,细胞分裂素为BA,NAA浓度为0.5 mg/L,茎腋芽为外植体。
2.2 BA不同浓度对丛生芽增殖的影响
将无菌芽切成1.2 cm,接种到以MS+NAA 0.5 mg/L为基本培养基,添加不同浓度(0.5,1.0,2.0, 3.0 mg/L)的BA 的增殖培养基上,试验结果见表3。
表3 BA不同浓度对丛生芽增殖的影响

BA浓度(mg/L)接种数(个)丛生芽数(个)增殖率(%)株高(cm)叶片数(张)苗生长势BA0.53062206.674.914.2+BA1.030124413.336.034.4++BA2.030187623.336.215.1+++BA3.03065216.675.433.6++BA0.53070233.335.515.2+
注:增殖率(%)=丛生芽数(个)/接种数(个);“+”表示生长一般,“++”表示苗生长较好,“+++”表示生长良好。下同。
从表3可以看出:BA浓度对射干丛生芽增殖有较大的影响。以茎腋芽为外植体,当BA浓度为2.0 mg/L时,丛生芽增殖率最高(623.33%),比BA浓度为0.5,1.0 mg/L时分别提高了416.66%和210.00%,且长势良好。BA浓度继续提高,丛生芽增殖率却降低,当BA浓度为3.0 mg/L时,丛生芽增殖率有下降趋势,为216.67%,以上分析可以得出,丛生芽增殖的最佳BA浓度为2.0 mg/L。
2.3 不同糖浓度对丛生芽增殖的影响
将无菌苗切割成约1 cm长,3株为1丛接种在以MS+BA 2.0 mg/L+NAA 0.5 mg/L,添加不同浓度(2.0%,4.0%,6.0%,8.0%)白糖的增殖培养基上,试验结果见表4。
表4 不同糖浓度对丛生芽增殖的影响
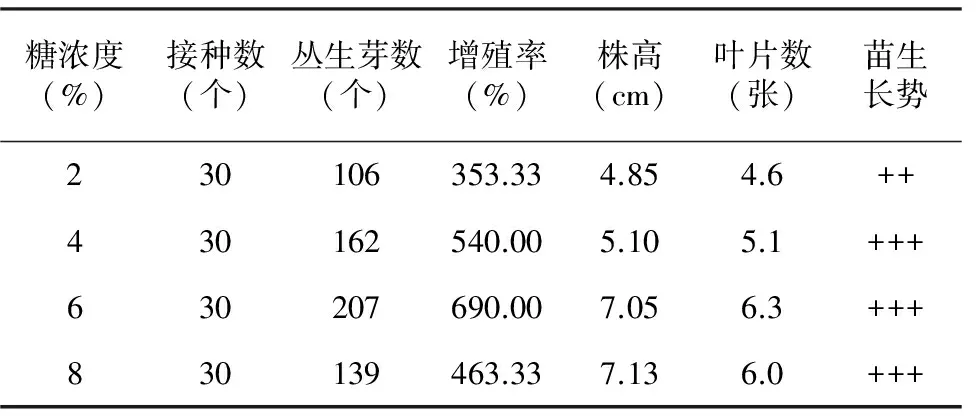
糖浓度(%)接种数(个)丛生芽数(个)增殖率(%)株高(cm)叶片数(张)苗生长势230106353.334.854.6++430162540.005.105.1+++630207690.007.056.3+++830139463.337.136.0+++
从表4可以看出:当糖浓度为6%时,丛生芽增殖率为690%,增殖率比糖浓度为2%和4%时分别提高了336.67%和150%,苗的长势良好。随着糖浓度的提高,丛生芽增殖率却降低,当糖浓度为8%时,丛生芽的增殖率降低了226.67%。以上分析可以得出,试管苗增殖率最佳糖浓度为6%。
3 结 论
本试验采用正交混合设计法L16(43×21)研究培养基、细胞分裂素、NAA和外植体不同组合对不定芽增殖的影响。试验结果得出,细胞分裂素的种类及浓度对不定芽增值的影响差异显著,外植体的影响差异不显著,但茎腋芽消毒易于根茎芽且茎腋芽量比较大,因此茎腋芽是理想的外植体。本试验初步探索出射干不定芽诱导的最佳培养基为MS+BA 2.0 mg/L+NAA 0.5 mg /L+糖6%+琼脂5%,丛生芽数最多,为207个,增殖率高达690%。生根和移栽参照前期本课题组张慧英等报道的生根培养基1/2 MS+NAA 1.0 mg/L+糖2%+琼脂5%和移栽方法。
[1]中国科学院中国植物志编辑委员会.中国植物志第十六卷第一分册[M].北京:科学出版社,1985:131-133.
[2]刘合刚,刘国杜.射干速生高效栽培技术[J].中草药,2001,32(8):749-751.
[3]高山林.药用植物遗传育种的现状与展望[J].世界科学技术——中医药现代化,2001,3(6):58-62.
[4]张慧英,薛延军,张耀华,等.射干叶片愈伤组织诱导及植株再生研究[J].中药材,2010,33(2):176-178.
[5]张耀华,张慧英,薛艳霞.射干试管根茎诱导的研究[J].中草药,2008,39(6):910-913.
[6]王晓炜,宋波,姜云清,等.射干幼茎愈伤组织及试管苗培养的研究[J].山东科学,2014,27(4):33-37.
(本栏目责任编辑:周忠燕)
The Establishment Rapid Propagation System of Genuine Medicinal MaterialsBelamcandachinensis(L.) DC.
XUEYanxia1,2,ZHANGHuiying1,GUOHui3,HONGDengwei1,2,LIUFang1,2
2016-04-28
广西科技开发项目(编号:桂科重135501-5-12)。
薛艳霞(1982—),女,山西人;在读博士研究生,研究方向:生物技术育种;E-mail:59859511@qq.com。
刘 芳(1975—),女,广西人;副教授,博士;E-mail:liufang1975@163.com。
10.16590/j.cnki.1001-4705.2016.09.131
S 567
A
1001-4705(2016)09-0131-03
