鸡全基因组选择信号筛选研究进展
2016-12-02王志鹏景军红周萌
王志鹏,景军红,周萌
(1.农业部鸡遗传育种重点试验室,哈尔滨 150030;2.黑龙江省普通高等学校动物遗传育种与繁殖重点试验室,哈尔滨 150030;3.东北农业大学动物科学技术学院,哈尔滨 150030)
鸡全基因组选择信号筛选研究进展
王志鹏1,2,3,景军红1,2,3,周萌1,2,3
(1.农业部鸡遗传育种重点试验室,哈尔滨 150030;2.黑龙江省普通高等学校动物遗传育种与繁殖重点试验室,哈尔滨 150030;3.东北农业大学动物科学技术学院,哈尔滨 150030)
人工选择对家鸡驯化及品种形成具有重要作用,基因组上留有选择痕迹。随着基因组技术和选择信号检测方法完善,在基因组上检测选择信号成为进化生物学领域研究热点。文章主要描述选择信号定义,总结检测选择信号的重要统计方法,分析鸡基因组选择信号检测结果,以期为鸡全基因组领域研究提供参考。
鸡;基因组;选择信号
王志鹏,景军红,周萌.鸡全基因组选择信号筛选研究进展[J].东北农业大学学报,2016,47(10):100-106.
Wang Zhipeng,Jing Junhong,Zhou Meng.Genome-wide scan of selection signatures in chicken[J].Journal of Northeast Agricultural University,2016,47(10):100-106.(in Chinese with English abstract)
鸡起源于雉科原鸡属,家鸡简称Gallus domes⁃ticus。研究表明,南亚、东南亚和我国北方地区是重要家鸡起源地[1]。原鸡经长期自然选择和人工选择已产生形态迥异、各具特色的品种,主要包括蛋用型、肉用型、兼用型、观赏型、药用型等。鸡种选育历史不同,体型、外貌、羽色及生产性状方面差异显著。由于人工或自然选择干预,生物群体在世代传递过程中,某种基因型个体比例变化,基因
组上会相应留下明显特征,即选择信号。目前,利用高密度SNP标记、重测序数据等DNA的多态信息已在鸡基因组中筛选出多个存在选择信号区域。本文主要描述选择信号定义,总结检测选择信号的重要统计方法,分析已报道的鸡基因组选择信号检测结果,归纳分析相关研究进展,以期为鸡全基因组领域研究提供参考。
1 选择性扫除和“搭车”效应
中性进化理论认为,新突变需长时间在群体中达到较高频率,突变位点周围的连锁不平衡程度因重组发生衰减降解[2]。基因组上绝大多数未受选择的位点始终处于随机漂变状态,彼此间连锁不平衡易衰减。但选择作用下,群体有利等位基因频率则在较短时间内达到较高值,重组作用受一定程度抑制而不能对长范围单倍型实质性降解。选择作用下的连锁不平衡造成选择位点附近中性位点基因频率增加,形成长范围单倍型纯合。这种由选择作用造成部分染色体片段多态性降低现象称为选择性扫除(Selective Sweep)[3]。受选择作用的有利基因座位周围中性位点由于连锁关系其频率迅速增加,这种现象称为“搭车”效应(Hitchhik⁃ing Effect)[4]。选择性扫除和“搭车”效应从不同角度反映选择作用所致基因组变化。基于选择性扫除和“搭车”效应,筛选基因组选择信号,成为群体遗传学领域研究热点。
2 基因组选择信号检测方法
根据所用基因组信息来源差异,选择信号检测方法分为基因频率谱方法、连锁不平衡方法和基于群体分化方法等,各算法可检测选择事件、试验群体及算法简述见表1。
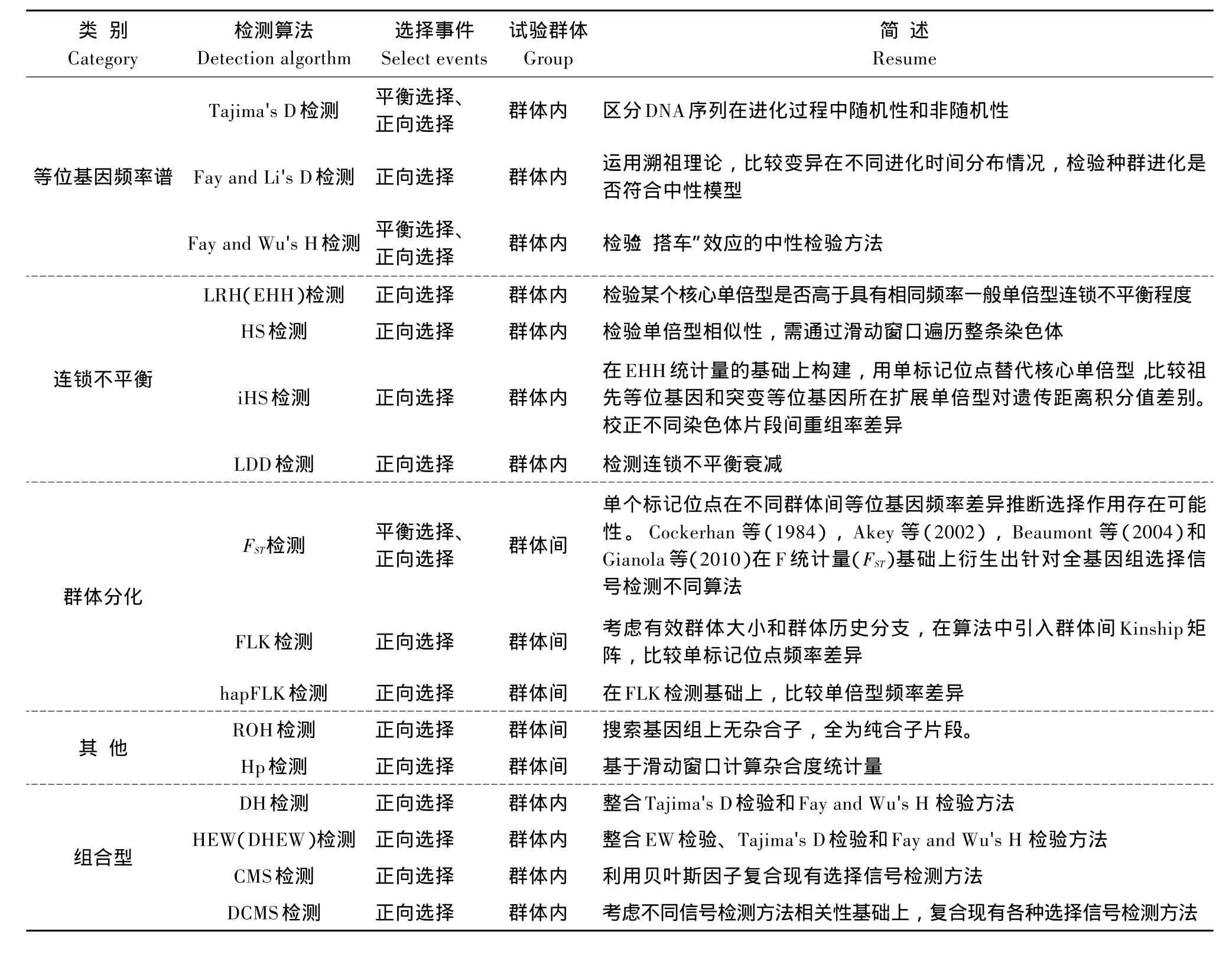
表1 选择信号检测方法Table 1Approaches for detecting genome-wide selection signatures
2.1 基于等位基因频率谱检测选择信号方法
基因频率谱是指各频率等位基因占总等位基因数比例[5]。中性理论认为基因组上存在广泛遗传多态位点,当突变发生时,突变位点频率维持在较低水平。当基因组上出现有利突变时,自然选择发生作用,实现选择性扫除或“搭车”效应。早期经典方法如Tajima's D检测、Fay and Li's D检测、Fay and Wu's H检测等通过检测等位基因在基因组上目标区域内出现的频繁程度特征决定该基因是否受到选择。
2.2 基于连锁不平衡检测选择信号方法
研究表明,如群体经历正向选择,则基因组上有利突变位点频率很快提升,同时与该有利突变位点连锁的周围位点由于“搭车”效应,频率也会在群体中增加。且由于经历时间短,位点间连锁关系尚未被重组事件破坏,存在较长LD区域。该区域长度与正向选择强度正相关[6]。这种特征为检测基因组上是否发生正向选择提供有效突破点。基于此,已研发多个检测算法,如LRH[6],HS,iHS[7],LDD[8]等。
2.3 基于群体分化检测选择信号方法
选择可使群体出现分化。特别是当同种不同亚群间不同等位基因同时受到选择时,分化现象加速。F统计量(FST)是反映群体结构变化统计量。主要基于遗传多态性数据,通过估计亚种群间与整个种群平均杂合性差异,刻画群体结构分化程度。FST受突变、遗传漂变、近亲交配、选择作用或Wahlund效应等因素影响。但在中性进化条件下,FST主要由遗传漂变和迁移等因素影响,如种群中一个等位基因由于对特定环境适合度较高而经历适应性选择,其频率升高增大种群分化水平,产生较高FST值。如果不同群体同一位点基因频率差异显著大于中性进化条件下期望值,则认为该位点存在选择作用。目前,除FST统计量外,FLK检测、hapFLK检测等统计量已应用于检测群体分化。
上述选择信号检验统计量不同算法间相关程度不同。Grossman等认为,假如每个选择信号检测方法揭示不同信息来源选择性扫除,那么复合多个选择信号检测方法将有利于提高选择信号检测效力[9]。目前,已有多个研究通过复合多种选择信号检测方法在基因组范围内筛选出潜在选择信号,以期提高选择信号检测准确性和精确度。Zeng等提出DH检验即整合Tajima's D检验和Fay and Wu's H检验方法[10]。DH检验可提高选择检测特异性,降低种群历史等因素敏感度。Zeng等在DH基础上,整合Ewens-Watterson算法(EW),提出DHEW检验,该算法对重组率变化不敏感[11]。Grossman等利用贝叶斯因子复合现有各选择信号检测方法,将该法定义为CMS[9]。Ma等在考虑各不同信号检测方法相关性基础上,提出去相关复合统计量法(DCMS)[12];Utsunomiya等合并统计量P值,提出meta-SS法[13];Randhawa等考虑统计量排序信息,提出CSS法[14]。
3 鸡基因组选择信号筛选研究进展
早期驯化和近现代育种实践对鸡种、体型外貌、行为习惯、生产性能影响显著,基因组相应变化。随着芯片和重测序技术发展,可在基因组层面上检测这种变化,揭示选育、基因与表型间关系。目前,已利用商用蛋鸡、商用肉鸡、双向选择品系鸡、地方鸡种等群体的12、60和600 k SNP数据和重测序数据,在基因组上检测选择信号或基因。试验利用的群体、数据、检测方法及检测到的选择信号均有差异,见表2。结合结构基因组和功能基因组学研究结果对选择信号区域注释分析,发现这些选择信号区域内存在一些与外貌性状、生长性状、体脂性状、繁殖和蛋品质性状、抗病性状等相关的重要基因。
3.1 外貌性状相关基因
鸡的羽色是确定鸡品种重要特征。研究发现位于1号染色体SOX10(SRY(Sex determining region Y)-box 10)基因影响鸡的羽色[27]。Gholami等在3个商品蛋鸡中检测发现SOX10基因受较强选择作用[25]。鸡肤色主要有黄色、白色、黑色等。Rubin等[15],Elferink等[21],Qanbari等[28]和Ma等[12]利用不同群体和不同检测算法,均发现位于24号染色体上影响鸡黄皮肤的BCDO2基因[29]受较强人工选择。Ma等检测到影响黑色素或色素沉积的MC1R(Melanocortin 1 receptor,位于11号染色体),DCT(Dopachrome tautomerase,位于1号染色体),TYR(Tyrosinase,位于1号染色体),OSTM1(Osteope⁃trosis associated transmembrane protein 1,位于3号染色体)基因受到选择[12]。鸡冠组织是鸡皮肤的重要衍生物,起散热等作用,根据形态差异可分为
单冠、玫瑰冠、豆冠、羽毛冠等。Qanbari等利用FST算法、iHS算法等通过检测商业白壳蛋鸡和褐壳蛋鸡测序数据,发现SOX5基因(SRY(Sex deter⁃mining region Y)-box 5,位于1号染色体)影响鸡豆冠尺寸及形态,且该基因在现代鸡种中受极强人工选择。GJD2基因(Gap junction protein delta 2,位于5号染色体)、SMPD3基因(Sphingomyelin phosphodiesterase 3,位于11号染色体)分别影响视力[30]和矮小形态[31],Qanbari等研究发现这些影响鸡外貌特点基因均受较强人工选择[28]。
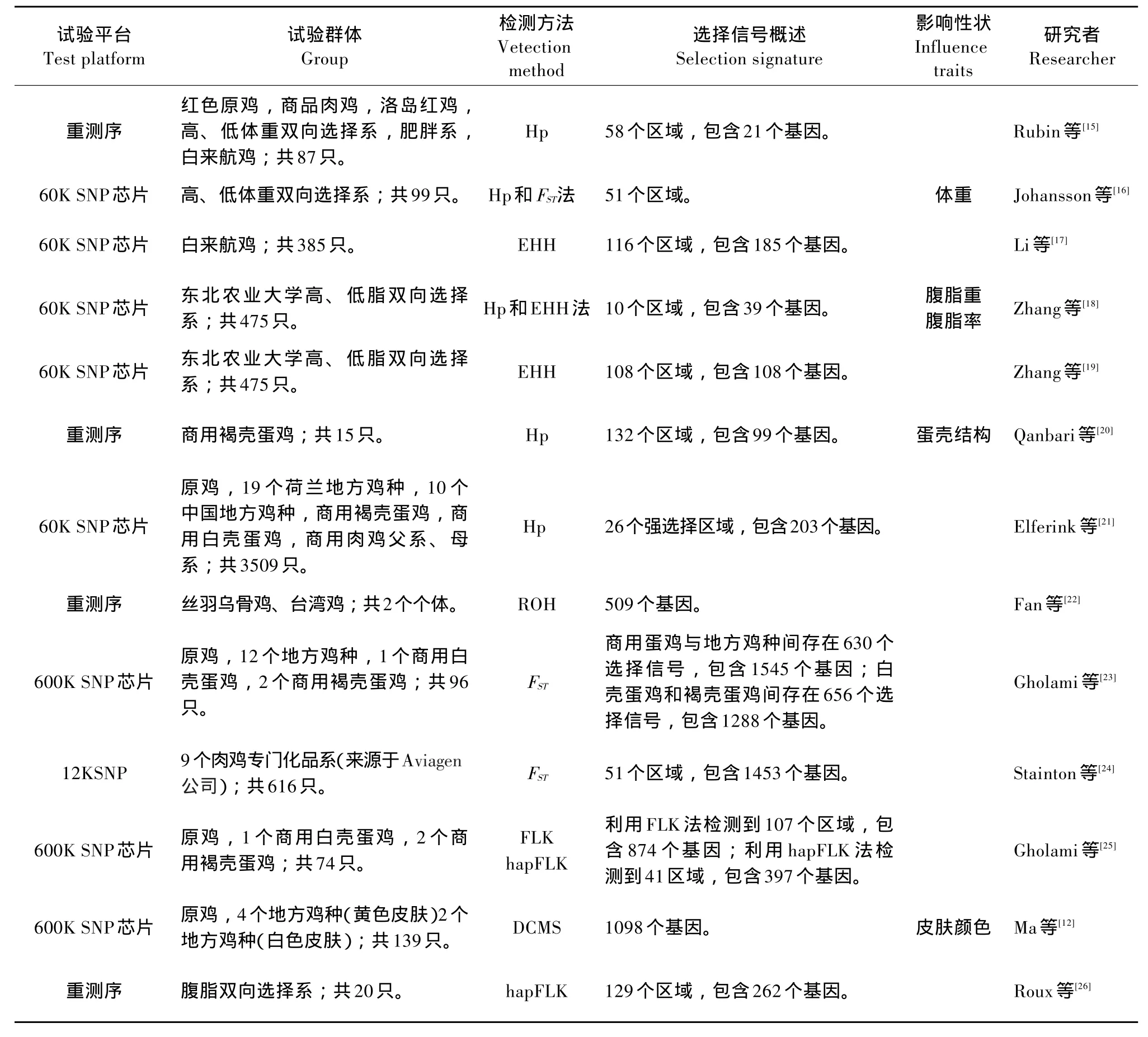
表2 鸡基因组上选择信号筛选研究Table 2Summary of selection signatures surveys in chicken genome
3.2 生长性状相关基因
鸡生长性状主要指鸡体重等性状。现已培育出专门化商用鸡品种。利用鸡种和地方鸡种为试验材料,在鸡基因组上定位大量影响鸡生长性状QTLs,并对多个重要候选基因展开功能研究。目前,已发现有很多基因影响鸡体重,主要包括位于1号染色体的IGF1(Insulin-like growth factor 1),位于3号染色体的CAPN1(Calpain 1)、TGFB2(Transforming growth factor,beta 2),位于5号染色体的IGF2(Insulin-like growth factor 2),位于8号染色体LEPR(Leptin receptor gene),位于10号染色体的IGF-1R(Insulin-like growth factor 1 receptor),位于27号染色体的IGF2BP1(Insulin-like growth factor 2 mRNA binding protein 1)、IGFBP4(Insulin-like
growth factor binding protein 4)、STAT5B(Signal transducer and activator of transcription 5B),位于28号染色体的INSR(Insulin receptor)等基因。Qanbari等利用商用鸡的重测序数据,基于位点的杂合度发现IGF1、INSR、LEPR等基因受选择影响[20];Rubin等也利用重测序数据检测到IGF1和INSR在更多鸡种基因组上留有选择痕迹[15]。Gholami等利用原鸡、多地鸡种和商用鸡种的600K SNP数据检测到CAPN1、TGFB2、IGF2、IGF2BP1等基因受人工选择[23]。Stainton等利用来源于Aviagen公司的9个肉鸡专门化品系的12K SNP数据也检测到IGF2BP1在基因组上存在选择痕迹[24]。Gholami等利用原鸡和商用鸡的600K SNP数据检测到IGF-1R、STAT5B等基因受较强选择作用[25]。目前检测到影响鸡体重的部分QTL或基因受强烈人工选择,由此推断鸡基因组会针对体重性状所施加的人工选择做出反应,并在基因组上留下选择痕迹。
3.3 体脂性状相关基因
随着肉鸡生长速度和肉产量显著提高,体脂性状逐渐成为肉鸡育种重点考虑性状之一。利用QTL定位、基因芯片、全基因组关联分析等技术平台定位到众多影响体脂性状基因。通过QTLdb数据库[34]检索,截止目前,在鸡上已定位380个与体脂性状相关QTLs。利用GWAS平台也定位到多个影响鸡体脂性状的遗传标记和重要基因。通过选择信号检测研究,发现多个通过上述定位方法筛选到的基因,也受较强选择作用。Zhang等利用东北农业大学腹脂双向选择系,在鸡基因组上发现位于1号染色体的IGF1(Insulin-like growth factor 1)、TRPC4(Transient receptor potential cation channel, subfamily C,member 4)、RB1(Retinoblastoma 1)、MAOA(Monoamine oxidase A)、MAOB(Monoamine oxidase B)、MYO7A(Myosin VIIA),位于3号染色体的EHBP1(EH domain binding protein 1),位于4号染色体的BBS7(Bardet-Biedl syndrome 7)、LRP2BP(LRP2 binding protein),位于7号染色体的LRP1B(Low-density lipoprotein receptor-related protein 1B),位于10号染色体的MYO9A(Myosin IXA),位于11号染色体的ESRP2(Epithelial splic⁃ing regulatory protein 2)、FTO(Fat mass and obesity associated),位于18号染色体的PRPSAP1(Phos⁃ phoribosyl pyrophosphate synthetase-associated pro⁃tein 1)和位于Z染色体的PCSK1(Proprotein conver⁃tase subtilisin/kexin type 1)基因等与脂肪组织代谢相关基因受较强选择[18,19]。Fan等在2个中国鸡种基因组上也检测到ESRP2基因受到选择[22]。LEPR(Leptin receptor,位于8号染色体)在食欲与能量消耗等生物学过程起重要作用。Twito等发现在LEPT基因上的SNP在蛋鸡和肉鸡群体间基因频率差异显著,与人工选择相关[32]。MXD4(MAX di⁃merisation protein 4,位于4号染色体)是抑癌基因,GWAS研究发现该基因与鸡腹脂重相关[33]。Stainton等在9个肉鸡品系基因组上发现LEPR和MXD4基因受较强选择作用[24]。Gholami等检测到影响腹脂重PRKAB2(Protein kinase,AMP-activated,beta 2 non-catalytic subunit,位于8号染色体)基因受到选择[23]。Roux等通过选择信号筛选,发现受选择作用的PARK2(Parkin RBR E3 ubiquitin protein li⁃gase,位于3号染色体)基因是促进鸡肥胖调控关键因子,JAG2(Jagged 2,位于5号染色体)基因是抑制鸡肥胖调控关键因子[26]。
3.4 繁殖与蛋品质性状相关基因
繁殖性状是鸡重要经济性状,产蛋量和蛋品质等性状是蛋用型鸡育种重点。通过QTLdb数据库[34]检索,截至目前,在鸡上已定位491个与繁殖和蛋品质性状相关的QTLs。已有研究表明PRL基因(Prolactin,位于2号染色体)影响鸡产蛋量与就巢行为,Li等[17]和Qanbari等[20]发现该基因受到选择作用。SPP1(Secreted phosphoprotein 1,位于4号染色体)与蛋壳质量相关[35],Qanbari等[20]和Ghola⁃mi等[23]发现该基因也受到较强选择作用。CALB1(Calbindin 1,位于2号染色体)与畸形蛋壳相关;NCOA1(Nuclear receptor coactivator 1,位于3号染色体),SREBF2(Sterol regulatory element binding transcription factor 2,位于1号染色体)和RALGA⁃PA1(Ral GTPase activating protein,alpha subunit 1,位于5号染色体)分别与开产日龄,就巢性和产蛋量相关。Qanbari等[20]和Gholami等[23]在鸡基因组上检测到上述基因受到选择。
3.5 抗病性状相关基因
通过QTLdb数据库[34]检索,截止目前,在鸡上已经定位561个与抗病性状相关QTLs。其中SLC11A1基因(Solute carrier family 11(Proton-cou⁃
pled divalent metal ion transporter),member 1,位于7号染色体)可抑制沙门氏杆菌传染[36-37],Qanbari等在基因组上也检测到该基因受较强选择作用[20]。除上述区域外,通过检测选择信号在基因组上也定位到一些与鸡疾病发生相关其他基因,如Li等在基因组上检测到LHX2(LIM homeobox2,位于17号染色体)和SFRP1(Secreted frizzled-related protein 1,位于22号染色体)基因受选择,且这些基因参与WNT信号通路,与癌症发生相关[17]。
4 展望
学者长期重点针对鸡生长、体脂、繁殖、蛋品质、抗病、饲料报酬性状等开展高强度选育。在鸡基因组上也遗留大量选择痕迹。利用候选基因法、QTL定位及全基因组关联等方法检测到大量影响上述重要经济性状的遗传标记、重要基因和QTL,且发现部分区域或基因的确受较强人工选择作用。说明传统依赖于表型数据选育的人工选择在鸡基因组进化上具有重要作用,验证了传统选择方法在遗传基础上改良重要经济性状的作用。随着基因组测序技术快速发展,高效获取海量鸡基因组数据,整合选择信号分析、全基因组关联分析和生物信息学分析将是筛选、鉴定影响重要经济性状基因策略。由于目前所用选择信号检测方法在算法设计上使用的信息来源不一,检测效率存在差异,如果在统计算法设计上充分利用群体各类信息源,完善检测方法,检测功效将显著提高。总之,在基因定位研究中引入选择信号检测分析结果,将更有利于筛选影响重要经济性状的关键基因。
[1] Xiang H,Gao J,Yu B,et al.Early Holocene chicken domestica⁃tion in northern China[J].Proc Natl Acad Sci USA,2014,111 (49):17564-17569.
[2] Stephens J C,Reich D E,Goldstein D B,et al.Dating the origin of the CCR5-Delta32 AIDS-resistance allele by the coalescence of haplotypes[J].Am J Hum Genet,1998,62(6):1507-1515.
[3] Biswas S,Akey J M.Genomic insights into positive selection[J]. Trends Genet,2006,22(8):437-446.
[4] Smith J M,Haigh J.The hitch-hiking effect of a favourable gene [J].Genet Res,1974,23(1):391-403.
[5] Bustamante C D,Wakeley J,Sawyer S,et al.Directional selection and the site-frequency spectrum[J].Genetics,2002,159(4): 1779-1788.
[6] Sabeti P C,Reich D E,Higgins J M,et al.Detecting recent posi⁃tive selection in the human genome from haplotype structure[J]. Nature,2002,419(6909):832-837
[7] Voight B F,Kudaravalli S,Wen X,et al.A map of recent positive selection in the human genome[J].PLoS Biol,2006,4(3):72.
[8] Wang E T,Kodama G,Baldi P,et al.Global landscape of recent inferred Darwinian selection for Homo sapiens[J].Proc Natl Acad Sci U S A.,2006,103(1):135-140.
[9] Grossman S R,Shlyakhter I,Karlsson E K,et al.A composite of multiple signals distinguishes causal variants in regions of posi⁃tive selection[J].Science,2010,327(5967):883-886.
[10] Zeng K,Fu Y X,Shi S,et al.Statistical tests for detecting positive selection by utilizing high-frequency variants[J].Genetics,2006, 174(3):1431-1439.
[11] Zeng K,Shi S,Wu C I.Compound tests for the detection of hitch⁃hiking under positive selection[J].Mol Biol Evol,2007,24(8): 1898-1908.
[12] Ma Y L,Ding X D,Qanbari S,et al.Properties of different selec⁃tion signature statistics and a new strategy for combining them[J]. Heredity,2015,115(5):426-436.
[13] Utsunomiya Y T,Pérez O'Brien A M,Sonstegard T S,et al.Detect⁃ing loci under recent positive selection in dairy and beef cattle by combining different genome-wide scan methods[J].PLoS One, 2013,8(5):64280.
[14] Randhawa I A,Khatkar M S,Thomson P C,et al.Composite selec⁃tion signals can localize the trait specific genomic regions in multi-breed populations of cattle and sheep[J].BMC Genet,2014 (15):34.
[15] Rubin C J,Zody M C,Eriksson J,et al.Whole-genome resequenc⁃ing reveals loci under selection during chicken domestication[J]. Nature,2010,464(7288):587-591.
[16] Johansson A M,Pettersson M E,Siegel P B,et al.Genome-wide effects of long-term divergent selection[J].PLoS Genet.,2010,6 (11):e1001188.
[17] Li D F,Liu W B,Liu J F,et al.Whole-genome scan for signa⁃tures of recent selection reveals loci associated with important traits in White Leghorn chickens[J].Poult Sci,2012,91(8):1804-1812.
[18] Zhang H,Hu X,Wang Z,et al.Selection signature analysis impli⁃cates the PC1/PCSK1 region for chicken abdominal fat content[J]. PLoS One,2012,7(7):40736.
[19] Zhang H,Wang S Z,Wang Z P,et al.A genome-wide scan of se⁃lective sweeps in two broiler chicken lines divergently selected for abdominal fat content[J].BMC Genomics,2012,13:704.
[20] Qanbari S,Strom T M,Haberer G,et al.A high resolution ge⁃nome-wide scan for significant selective sweeps:an application to pooled sequence data in laying chickens[J].PLoS One,2012,7 (11):49525.
[21] Elferink M G,Megens H J,Vereijken A,et al.Signatures of selec⁃tion in the genomes of commercial and non-commercial chicken breeds[J].PLoS One,2012,7(2):32720.
[22] Fan W L,Ng C S,Chen C F,et al.Genome-wide patterns of genet⁃ic variation in two domestic chickens[J].Genome Biol Evol,2013, 5(7):1376-1392.
[23] Gholami M,Erbe M,Gärke C,et al.Population genomic analyses based on 1 million SNPs in commercial egg layers[J].PLoS One, 2014,9(4):94509.
[24] Stainton J J,Haley C S,Charlesworth B,et al.Detecting signa⁃tures of selection in nine distinct lines of broiler chickens[J].An⁃im Genet.,2015,46(1):37-49.
[25] Gholami M,Reimer C,Erbe M,et al.Genome scan for selection in structured layer chicken populations exploiting linkage disequi⁃librium information[J].PLoS One,2015,10(7):0130497.
[26] Roux P F,Boitard S,Blum Y,et al.Combined QTL and selective sweep mappings with coding SNP annotation and cis-eQTL analy⁃sis revealed PARK2 and JAG2 as new candidate genes for adipos⁃ity regulation[J].G3(Bethesda),2015,5(4):517-529.
[27] Gunnarsson U,Kerje S,Bed'hom B,et al.The Dark brown plum⁃age color in chickens is caused by an 8.3-kb deletion upstream of SOX10[J].Pigment Cell Melanoma Res,2011,24(2):268-274.
[28] Qanbari S,Seidel M,Strom TM,et al.Parallel selection revealed by population sequencing in chicken[J].Genome Biol Evol.2015, 7(12):3299-3306.
[29] Eriksson J,Larson G,Gunnarsson U,et al.Identification of the yellow skin gene reveals a hybrid origin of the domestic chicken[J]. PLoS Genet,2008,4(2):1000010.
[30] Hornbeak D M,Young T L.Myopia genetics:A review of current research and emerging trends[J].Curr Opin Ophthalmol.2009,20 (5):356-362.
[31] Stoffel W,Jenke B,Blöck B,et al.Neutral sphingomyelinase 2 (smpd3)in the control of postnatal growth and development[J]. Proc Natl Acad Sci USA,2005,102(12):4554-4559.
[32] Twito T,Madeleine D,Perl-Treves R,et al.Comparative genome analysis with the human genome reveals chicken genes associated with fatness and body weight[J].Anim Genet,2011,42(6):642-649.
[33] Sun Y,Zhao G,Liu R,et al.The identification of 14 new genes for meat quality traits in chicken using a genome-wide association study[J].BMC Genomics,2013,14:458.
[34] Hu Z L,Park C A,Reecy J M.Developmental progress and cur⁃rent status of the Animal QTLdb[J].Nucleic Acids Res,2016,44 (1):827-833.
[35] Arazi H,Yoselewitz I,Malka Y,et al.Osteopontin and calbindin gene expression in the eggshell gland as related to eggshell abnor⁃malities[J].Poult Sci,2009,88(3):647-653.
[36] Calenge F,Kaiser P,Vignal A,et al.Genetic control of resistance to salmonellosis and to Salmonella carrier-state in fowl:A review [J].Genet Sel Evol,2010,42:11.
[37] Li X,Yang Y,Zhou F,et al.SLC11A1(NRAMP1)polymorphisms and tuberculosis susceptibility:Updated systematic review and meta-analysis[J].PLoS One,2011,6(1):15831.
Genome-wide scan of selection signatures in chicken
WANG Zhipeng1,2,3,
JING Junhong1,2,3,ZHOU Meng1,2,3(1.Key Laboratory of Chicken Genetics and Breeding,Ministry of Agriculture,Harbin 150030,China;2.Key Laboratory of Animal Genetics,Breeding and Reproduction,Education Department of Heilongjiang province,Harbin 150030,China;3.School of Animal Science and Technology,Northeast Agricultural University,Harbin 150030,China)
Artificial selection played an important role during chicken domestication and subsequent breed formation.So the imprints of selection episodes had been left within chicken genome.With the advances in genomics and the development of methods to detect selection signatures,the elucidation of these selection signatures had been of interest issue on the fields of evolutionary biology and population genetics.The aims of this review were to describe the definition of selection signatures on chicken genome, to present the main statistical methods used to detect selection signature,and to summarize some recent results on the selection footprint in chicken.This review should offer
to the researchers in the related fields.
chicken;genome-wide;selection signatures
S831;Q78
A
1005-9369(2016)10-0100-07
时间2016-10-28 13:22:52[URL]http://www.cnki.net/kcms/detail/23.1391.S.20161028.1322.006.html
2016-05-15
国家高技术研究发展计划项目(863计划)(2013AA102501);国家自然科学基金项目(31101709);东北农业大学学术骨干项目(15XG14);东北农业大学博士科研启动基金项目(2010RCB29)
王志鹏(1979-),男,副教授,博士,研究方向为动物分子数量遗传学。E-mail:wangzhipeng@neau.edu.cn
