化学平衡常数的考查视角
2016-12-01安徽省砀山中学
安徽省砀山中学 董 顺
化学平衡常数的考查视角
安徽省砀山中学董顺

化学平衡常数K能定量地描述可逆反应进行的限度,K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,即该反应进行得越完全;反之,就越不完全。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最终达到平衡时,各生成物平衡浓度的化学计量数次幂的乘积与各反应物平衡浓度的化学计量数次幂的乘积的比值是个常数,用K表示,这个常数叫化学平衡常数。
在书写平衡常数表达式时,需注意以下问题:
①在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL,水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。对于非水溶液中的反应,溶剂的浓度同样是常数。
②当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”看成常数,在平衡常数表达式中,不写固体的浓度。
③化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同,但是这些平衡常数可以相互换算。
视角一 平衡常数K与化学平衡移动的关系
例1(2014年上海卷)只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是()。
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
解析K只受温度的影响,温度不变而改变其他条件平衡可能移动,但K不变,故D选项错误。
答案D。
视角二 考查K的表达式及K与温度的关系
例2(2015年全国卷)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应为
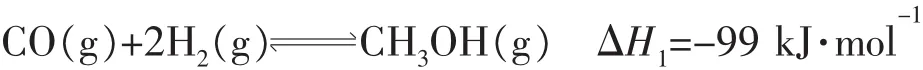
回答下列问题:
该反应的化学平衡常数K表达式为_____________ _;图中能正确反映平衡常数K随温度变化关系的曲线为_______ _(填曲线标记字母),其判断理由是_________________。

解析化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物平衡浓度化学计量数次幂之积与反应物平衡浓度化学计量数次幂之积的比值,则反应的化学平衡常数K表达式为;由于正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,因此a正确。
例3对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)CO(g)+3H2(g)ΔH=+206.2 kJ/mol的Kp=______ _;随着温度的升高,该平衡常数_______(填“增大”、“减小”或“不变”)。
视角三 考查相关化学反应K之间的关系
例4(2014年山东卷)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) ΔH1<0 (Ⅰ),平衡常数为K1;
2NO(g)+Cl2(g)2ClNO(g)ΔH2<0 (Ⅱ),平衡常数为K2。
则4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______ _(用K1、K2表示)。
解析某方程式各物质系数变为原来的n倍,则其平衡常数变为原来的n次方倍;某方程式由另两个方程式相加得到,则其平衡常数为另两个方程式平衡常数的乘积;某方程式由另两个方程式相减得到,则其平衡常数为另两个方程式平衡常数的商。将题干中已知的两个方程式做如下处理:(Ⅰ)×2-(Ⅱ)可得4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),其平衡常数。
视角四 考查K的计算
例5(2015年全国卷)Bodensteins研究了下列反应:

在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
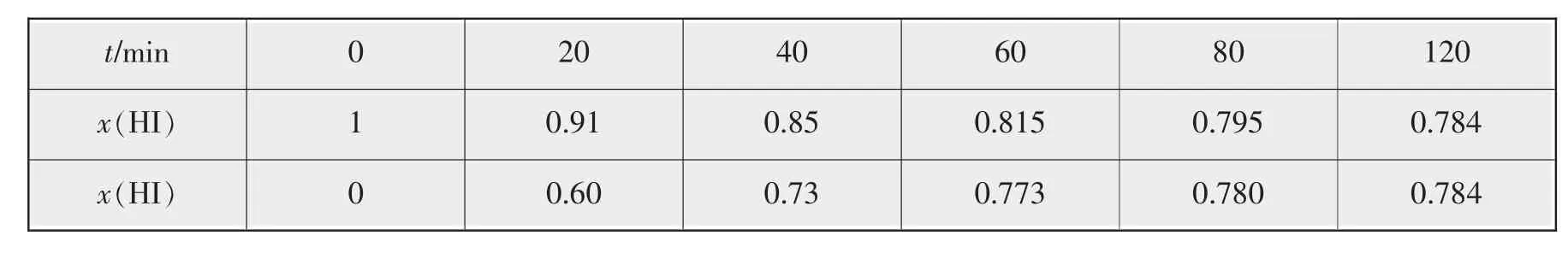
t/min 0 20 40 60 80 120 x(HI) 1 0.91 0.85 0.815 0.795 0.784 x(HI) 0 0.60 0.73 0.773 0.780 0.784
根据上述实验结果,该反应的平衡常数K的计算式为_______。
解析两组数据分别是从正、逆两个方向开始反应的数据,按第一组数据计算,设开始加入的HI为a mol,达到平衡时转化的HI为x mol,则
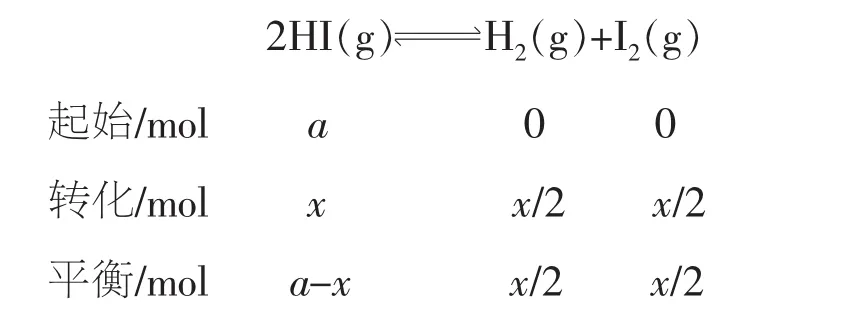
例6(2015年重庆卷)羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+ H2(g)K=0.1,反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是()。
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S的物质的量为7 mol
D.CO的平衡转化率为80%
解析升高温度,H2S浓度增加,表明平衡逆向移动,该反应的正反应是放热反应,A项错误。通入CO后,正反应速率应该是立即增大,而不是逐渐增大,B项错误。

设该容器的体积为V,则有,解得n=7,C项正确。CO的平衡转化率=100%=20%,D项错误。
答案C
视角五 根据K与Qc的大小关系判断平衡移动的方向及计算平衡转化率α
浓度商Qc为任意时刻生成物浓度化学计量数次幂之积与反应物浓度化学计量数次幂之积的比值。某化学反应处于平衡状态时,Qc=K,改变条件使Qc≠K,平衡被破坏,反应向正向(或逆向)进行,之后重新建立平衡。
Qc<K,反应正向进行,平衡正向移动;
Qc=K,反应处于平衡状态;
Qc>K,反应逆向进行,平衡逆向移动。
例7温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据如表所示:
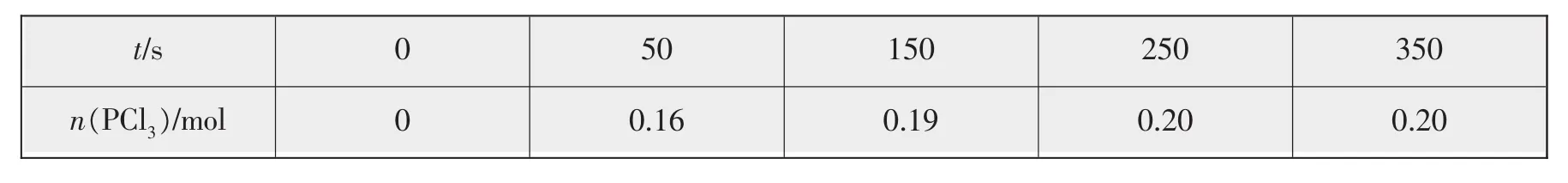
t/s 0 50 150 250 350 n(PCl3)/mol 0 0.16 0.19 0.20 0.20
下列说法正确的是()。
A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v正>v逆
D.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
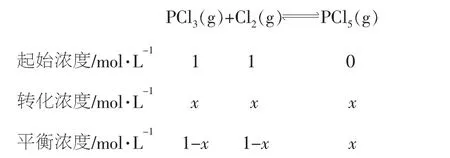
答案C
