毕赤酵母异源表达几丁质酶对大豆核盘菌的生防潜能分析
2016-11-30张福丽和玉婷张可陈晨刘畅樊小宁
张福丽+和玉婷+张可+陈晨+刘畅+樊小宁
摘 要:将来自于棘孢木霉的几丁质酶基因整合到了毕赤酵母基因组中,并对表达产物进行了生防潜能分析。结果表明,pH值为6和温度为40 ℃时几丁质酶活性最高,表达产物能够显著抑制大豆核盘菌的生长,并通过诱导ROS积累和抗性酶活性提高大豆对核盘菌的抗性。
关键词:几丁质酶;异源表达;酶学特性;生防潜能
中图分类号:S476 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.11.002
Abstract: Chitinase from Trichoderma viride was expressed in Pichia pastoris, and the biocontrol potential was analyzed. The results showed that Chitinase had the highest activity when pH was 6 and temperature was 40 ℃. Furthermore, Chitinase significantly inhibited the growth of Sclerotinia sclerotiorum and improved the resistance to sclerotiorum by inducing ROS accumulation and the activity of resistant enzymes.
Key words: Chitinase; heterologous expression; biocontrol potential
大豆(Glycine max (L.) Merrill)是世界上重要的植物油和蛋白来源。核盘菌(Sclerotinia sclerotiorum (Lib.) de Bary)引起的大豆菌核病是一种世界性的大豆病害,是影响大豆产量的第二大病害因素[1]。与化学防治相比,生物防治可以有效克服污染环境、危害人畜健康等缺点,并因此成为当前植物病害防治研究的热点之一。
木霉(Trichoderma spp.)是世界上公认的生防菌,抗真菌代谢物在木霉的生防功能中起着重要作用。几丁质酶就是一类重要的抗真菌代谢物,能够水解真菌细胞壁的主要成分几丁质[2-3],从而抑制真菌的生长。已有研究表明,该基因的表达能够增强植物对多种病原菌的抗性。与非转基因植株相比,表达木霉几丁质酶的转基因烟草(Nicotiana tabacum)和土豆(Solanum tuberosum)对交链孢霉(Alternaria alternata)、茄链格孢(Alternaria solani)和灰葡萄孢菌(Btrytis cinerea)、立枯丝核菌(Rhizoctonia solani)[4],苹果(Malus pumila)对黑星病菌(Venturia inaequalis)[5],柠檬(Citrus limon)对茎点霉(Phoma tracheiphila)和灰霉病菌(Botrytis cinerea)[6]的抗性都显著增强,表明几丁质酶对于增强植物的抗病性具有重要作用。笔者研究了毕赤酵母异源表达的棘孢木霉几丁质酶对大豆核盘菌的生防机制,为几丁质酶应用于植物病害防治提供理论依据。
1 材料和方法
1.1 材 料
PDA培养基:土豆200 g,葡萄糖20 g,琼脂粉15 g,pH 值6.0定容至1 L;几丁质酶基因(Tachi)来自于棘孢木霉(T. asperellum),酵母表达载体pPIC9K本实验室保存。
1.2 方 法
1.2.1 毕赤酵母表达载体构建 在棘孢木霉几丁质酶基因(Tachi)的CDS序列两端引入BamHI和KpnI酶切位点,进行PCR扩增并回收目的片段。采用BamHI和KpnI双酶切,将目的片段连入pPIC9K载体,获得pPIC9K-Tachi重组质粒,并对重组质粒进行PCR和双酶切检测。根据pPIC9K载体的多克隆位点和Tachi基因序列设计并合成以下引物序列:Chi1:5—ATCGGAATTCATGGTCCCTCAGTCTCGAGCC—3 EcoRI (划线部分为BamHI酶切位点);Chi25—CGATGGTACCTTATTCGTCAAGCCCTCTCTT—3(划线部分为KpnI酶切位点)。
1.2.2 pH值和温度对几丁质酶活性的影响 在分析pH值和温度对几丁质酶活性的影响时,将酶液分别加入不同pH值(3,4,5,6,7,8,9)的磷酸缓冲液中,首先找出最适pH值,然后在最适pH值条件下,反应温度分别设定为20,30,40, 50,60 ℃,分别测定温度对酶活性的影响。酶活性测定参照文献[7]的方法。
1.2.3 几丁质酶抑菌活性测定 将培养在PDA培养基上的大豆核盘菌菌块用打孔器切成直径为5 mm的菌盘,接种到含有几丁质酶液的PDA培养基平板的中央,28 ℃培养5 d后,测量菌盘生长直径,同时以菌盘接种到不含粗酶液的为对照。抑菌率=(对照菌块直径-处理菌块直径)/对照菌块直径×100%。
1.2.4 抗性酶活性及H2O2和O2-含量测定 12 d的大豆幼苗用几丁质酶液诱导1 d后接种病原菌S.sclerotiorum孢子悬液(1×106孢子·mL-1),26 ℃培养3 d后进行H2O2和O2-含量测定,4 d后测定抗性酶活性。POD和SOD活性测定采用文献[8-9]的方法。H2O2和O2-含量测定分别采用Mukherjee和Choudhuri的方法[10]。
1.2.5 数据统计分析 采用SPSS 17.0进行数据分析,P<0.05表示差异显著。
2 结果与分析
2.1 几丁质酶酵母表达载体的构建及酵母转化子鉴定
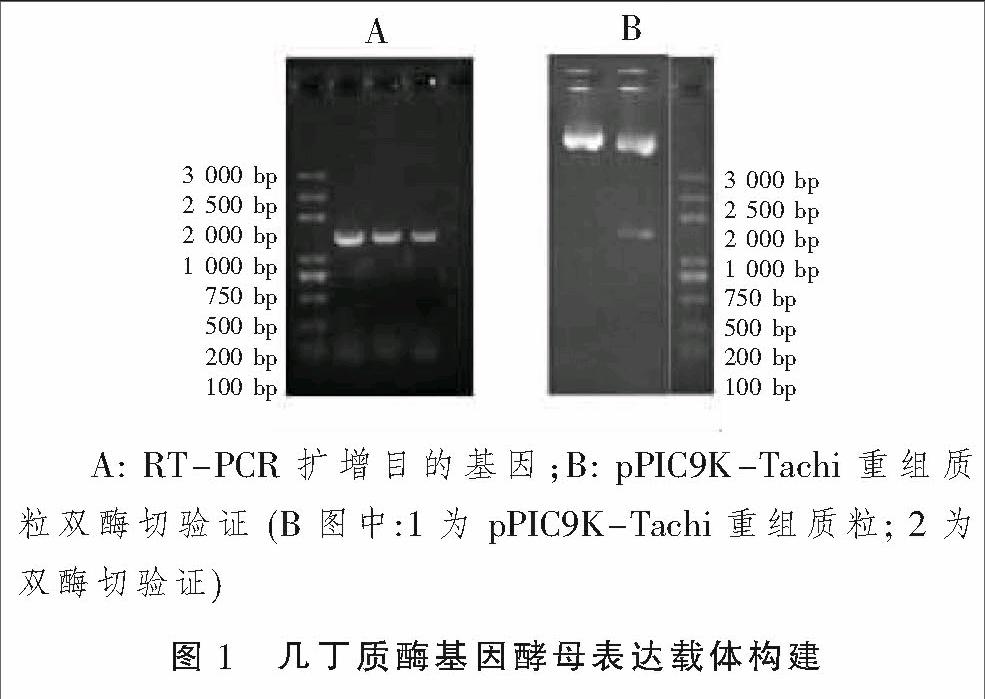
RT-PCR扩增得到全长1 194 bp TachiCDS序列,PCR扩增产物和酵母表达载体pPIC9K分别用BamHI和KpnI双酶切并进行连接后,得到pPIC9K-Tachi重组质粒。采用PCR的方法用载体构建引物从转化子中扩增出了大小为1 000~2 000 bp的片断(图1A),初步验证了目的基因连接到了表达载体。提取质粒,再用BamHI和KpnI双酶切后电泳检测目的基因片断,进一步验证了几丁质酶基因构建到pPIC9K表达载体中,后经过对所构建载体的序列测定,证实了几丁质酶Tachi基因已成功构建到酶母表达载体pPIC9K。
2.2 pH值和温度对几丁质酶活性的影响
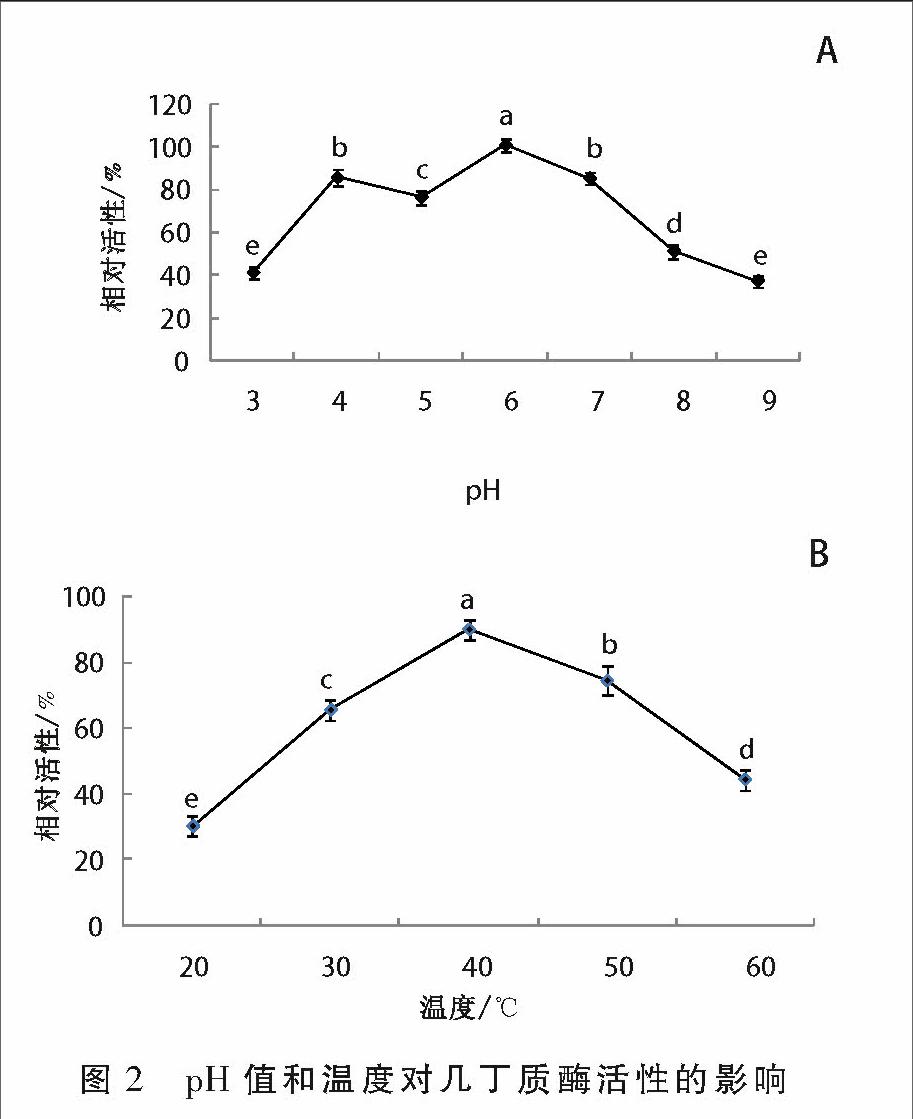
pH值对酶活的影响如图2A所示,在pH值3~9的范围内,几丁质酶均具有一定活性,但pH值为6时酶活性最高。温度对几丁质酶活性的影响如图2B如示,在温度20~60 ℃范围内几丁质酶均有活性,在40 ℃时几丁质酶酶活性最高。
2.3 几丁质酶对大豆核盘菌的生长抑制作用
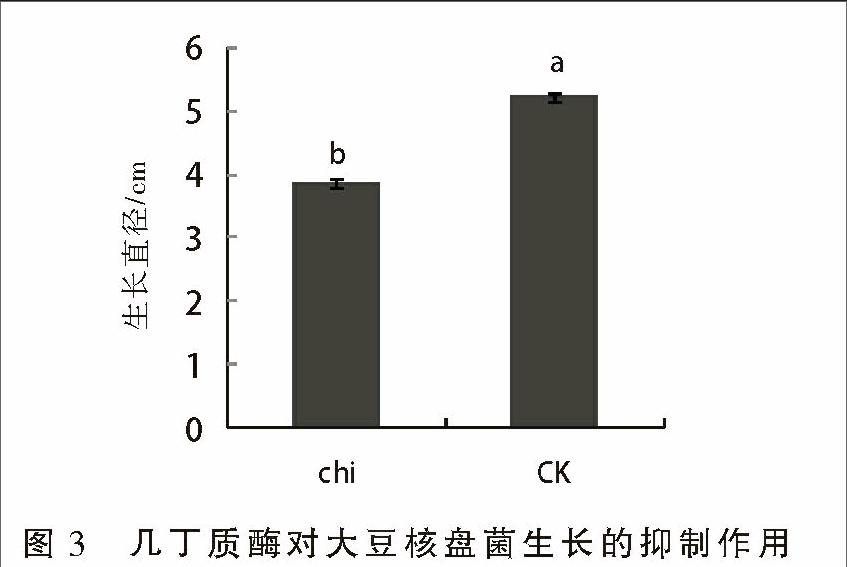
如图3所示,毕赤酵母表达的几丁质酶对大豆病原核盘菌具有明显的抑制作用,培养5 d后,添加几丁质酶的培养基上核盘菌的生长直径仅为3.86 cm,而对照培养基上核盘菌的直径达到5.23 cm,差异显著。
2.4 几丁质酶处理诱导了病原胁迫下ROS在大豆中的积累和抗性酶活性
几丁质酶处理增加了病原胁迫下ROS在大豆幼苗中的积累(图4)。病原胁迫前,水处理和几丁质酶分别处理的大豆ROS含量并没有产生显著区别(P<0.05)。病原胁迫条件下,水和几丁质酶处理大豆的ROS含量均有明显增加,但是水处理的大豆中ROS含量增加较少,与几丁质酶处理植株之间有显著区别(P<0.05)。
为了研究抗性酶在清除过多ROS方面的作用,对大豆叶片的抗性酶(POD和SOD)活性进行了测定。结果表明,几丁质酶处理诱导了大豆叶片抗性酶活性的提高,其中POD活性在几丁质酶处理和非处理大豆植株之间具有显著区别(P<0.05)。病原S. sclerotiorum胁迫后大豆叶片的抗性酶活性进一步提高,但几丁质酶预处理的植株中抗性酶的活性提高较快,与无菌水预处理植株间形成显著区别(P<0.05)。以上结果表明,几丁质酶处理诱导了大豆植株抗性酶活性的提高,进而有效清除了病原S. sclerotiorum胁迫下ROS在大豆植株内的过量积累。
2.5 几丁质酶处理减轻了病原胁迫对大豆的伤害
从图5可以看出,几丁质酶处理减少了大豆植株MDA含量和降低了电导率。病原胁迫前,几丁质酶处理和非处理植株间的MDA和电导率并没有显著区别,而在病原胁迫情况下,几丁质酶预处理大豆植株的电导率和MDA含量显著低于对照植株(P<0.05),表明几丁质酶预处理诱导了大豆对病原S. sclerotiorum的抗性,进而减轻了病原胁迫对大豆细胞的伤害。
3 结论与讨论
电导率是反映植物抗逆性强弱的指标之一,植物组织外渗液电导率的大小反映了胁迫条件下植物质膜受损伤的程度[11-12]。本研究表明,与对照相比,几丁质酶预处理后再进行病原胁迫,大豆幼苗的电导率显著较低,表明几丁质酶诱导了大豆对核盘菌的抗性,减弱了病原胁迫对大豆质膜的伤害。病原胁迫下,植物体内ROS代谢加强,产生的过氧化物自由基引起膜脂过氧化。丙二醛是植物细胞膜脂过氧化最重要的产物之一,它的产生能加剧植物细胞膜的损伤,是植物抗性生理研究中的一个常用指标,其含量的高低反映了膜脂质过氧化程度、植物细胞膜系统受损程度以及植物的抗逆性。MDA通过与酶蛋白发生链式反应聚合,使膜系统变性,造成膜脂流动性降低,影响膜结合酶的功能,引起膜伤害[13-14]。本研究中,与对照相比,几丁质酶预处理显著降低了大豆植株中丙二醛含量,表明几丁质酶预处理提高了大豆植物对核盘菌的抗性,减弱了病原胁迫对大豆细胞膜的伤害。
生物胁迫造成植物体内ROS的快速大量积累,而过多的ROS的存在会对植物细胞造成伤害,为了有效对抗这种氧化胁迫,植物形成了一套有效的ROS清除系统,其中抗性酶在这一系统中起着重要作用。前人的研究表明,来自于绿木霉(T.virens)的几丁质酶基因通过增加ROS积累、POD活性和萜类化合物含量,以及增加防御相关基因的表达,提高了对病原菌立枯丝核菌Rhizoctonia solani的抗性[15],这与笔者的研究结果一致。
总之,几丁质酶预处理提高了ROS的积累,进而诱导了抗性酶活性,最终减轻了病原胁迫对大豆植株造成的伤害,表明来自于棘孢木霉的几丁质酶对大豆核盘菌具有一定的生防潜能。
参考文献:
[1]ZHAO X,HAN Y,LI Y,et al.Loci and candidate gene identification for resistance to Sclerotinia sclerotiorum in soybean (Glycine max L. Merr.) via association and linkage maps[J].The plant journal : for cell and molecular biology,2015,82(2):245-255.
[2]LINTHORST H. Pathogenesis-related proteins of plants[J]. Critical reviews in plant sciences, 1991,10(2): 123-150.
[3]LORITO M, SCALA F. Microbial genes expressed in transgenic plants to improve disease resistance[J]. Journal of plant pathology, 1999, 81(2): 73-88.
[4]LORITO M,WOO S L,GARCIA I,et al.Genes from mycoparasitic fungi as a source for improving plant resistance to fungal pathogens[J].Proceedings of the national academy of sciences of the United States of America,1998,95(14):7860-7865.
[5]BOLAR J P,NORELLI J L,WONG K W,et al.Expression of endochitinase from Trichoderma harzianum in transgenic apple increases resistance to apple scab and reduces vigor[J].Phytopathology,2000,90(1):72-77.
[6]GENTILE A,DENG Z, MALFA S L,et al.Enhanced resistance to Phoma tracheiphila and Botrytis cinerea in transgenic lemon plants expressing a Trichoderma harzianum chitinase gene[J].Plant breeding,2007,126(2):146-151.
[7]MCCREATH K J,GOODAY G W.A rapid and sensitive microassay for determination of chitinolytic activity[J].Journal of microbiology methods,1992,14(4):229-237.
[8]刘萍,李明军,李成伟.植物生理学实验技术[M].北京:科学出版社,2007.
[9]蔡庆生.植物生理学实验[M].北京:中国农业大学出版社,2013.
[10]MUKHERJEE S P, CHOUDHURI M A. Implications of water stress-induced changes in the levels of endogenous ascorbic acid and hydrogen peroxide in vigna seedlings[J]. Physiologia plantarum,1983, 58(2): 166-170.
[11]邱全胜, 李林, 梁厚果,等. 水分胁迫对小麦根细胞质膜氧化还原系统的影响[J].植物生理学报, 1994(2): 145-151.
[12]张林刚,邓西平.小麦抗旱性生理生化研究进展[J].干旱地区农业研究,2000,18(3):87-92.
[13]陈少裕.膜脂过氧化与植物逆境胁迫[J].植物通报,1989,6(4):211-217.
[14]王宝山. 生物自由基与植物膜伤害[J]. 植物生理学通讯, 1988 (2): 12-16.
[15]KUMAR V,PARKHI V,KENERLEY C M,et al.Defense-related gene expression and enzyme activities in transgenic cotton plants expressing an endochitinase gene from Trichoderma virens in response to interaction with Rhizoctonia solani[J].Planta,2009,230(2):277-291.
