糖尿病痛性周围神经病的临床及神经电生理特征
2016-11-30张俊清王亚春乌日乐
张俊清+王亚春+乌日乐
【摘要】 目的 观察糖尿病痛性周围神经病的临床及神经电生理特征。方法 60例临床表现为肢体疼痛且确诊为2型糖尿病的患者, 均进行四肢神经传导检测(NCS)、躯体感觉诱发电位(SEP)、皮肤交感反应(SSR)、F波、H反射及肌电图(EMG)检测, 以本室的正常值为标准进行判断。结果 SSR异常率(81.7%)高于其他检测(P<0.05), 其次为感觉神经传导检测(SNCS)(43.3%)、运动神经传导检测(MNCS)(35.0%), EMG(6.7%)最低。结论 SSR、NCS是糖尿病痛性周围神经病变诊断的敏感指标。
【关键词】 糖尿病;痛性周围神经病;神经电生理
DOI:10.14163/j.cnki.11-5547/r.2016.27.007
【Abstract】 Objective To observe clinical and nerve electrophysiological characteristics of diabetic painful peripheral neuropathy. Methods A total of 60 patients with diagnosed type 2 diabetes mellitus and limb pain symptoms received detection by limb nerve conduction studies (NCS), body sensory evoked potential (SEP), sympathetic skin response (SSR), F wave, H reflex and electromyography (EMG), with standard by normal value. Results SSR showed higher abnormal rate (81.7%) than other tests (P<0.05), followed by sensory nerve conduction studies (SNCS) (43.3%), moter nerve conduction studies (MNCS) (35.0%) and EMG (6.7%). Conclusion SSR and NCS are sensitive indexes in diagnosis of diabetic painful peripheral neuropathy.
【Key words】 Diabetes; Painful peripheral neuropathy; Nerve electrophysiology
糖尿病周围神经病(DPN)是糖尿病慢性进展中最常见的并发症之一, 临床表现因损害的神经不同而各异, 其临床发病率可达50%~90%, 而用神经电生理学的改变来判断, 其发病率可达80%~100%[1]。糖尿病周围神经病患者中, 有一部分患者主要表现为从脚开始出现的疼痛和感觉异常, 疼痛多为隐痛、刺痛、灼烧痛, 夜间尤甚, 部分患者表现为单神经痛, 称其为糖尿病痛性周围神经病。疼痛不仅严重影响患者的生活质量, 也大大增加社会的负担。本文分析糖尿病痛性周围神经病的临床及神经电生理特征, 以利于早期诊断及治疗, 报告如下。
1 资料与方法
1. 1 一般资料 选取本院2012~2015年内分泌科、神经内科住院及门诊60例临床表现为肢体疼痛且确诊为2型糖尿病的患者。均符合1999年WHO认可的2型糖尿病诊断标准, 空腹血糖≥7.0 mmol/L和(或)糖负荷后2 h血糖≥11.1 mmol/L。除外慢性炎性脱髓鞘性多发性神经根周围神经病、营养缺乏、中毒、异常球蛋白血症、肝功能不全、肾功能不全、甲状腺功能减退、恶性肿瘤、结缔组织病、感染性疾病以及遗传病等引起的周围神经病。男36例, 女24例, 年龄39~80岁, 平均年龄60.2岁, 糖尿病病程3个月~30年。患者均有肢体麻木、疼痛, 3例患者伴有面神经麻痹, 21例患者有肢体疲乏无力症状, 7例患者伴有行走不稳症状。
1. 2 方法 采用丹麦制造丹迪4通道EMG诱发电位仪, 室温保持22~28℃, 对所有患者进行运动神经传导检查, 包括双侧正中神经、尺神经、腓总神经、胫神经, 检查内容包括运动神经传导速度(MNCV)、运动末端潜伏期(DL)、波幅;感觉神经传导检查, 包括双侧正中神经、尺神经、腓浅神经、腓肠神经, 检查内容包括感觉神经传导速度(SNCV)、起始潜伏时、波幅;F波潜伏时检测, 包括正中神经、胫神经;H反射潜伏时检测;SSR检查, 记录起始潜伏时及波幅;SEP检测, 包括正中神经、胫神经, 正中神经记录周围N9及中枢N13、P15、N20电位, 胫神经记录周围N8及中枢N18、P40和N45电位的潜伏期及波幅。EMG:记录自发电位、轻收缩运动单位时限及大力募集相。所有电生理结果均与本实验室年龄匹配的正常值进行比较, 判断是否存在异常。
1. 3 统计学方法 采用SPSS13.0统计学软件对数据进行统计分析。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
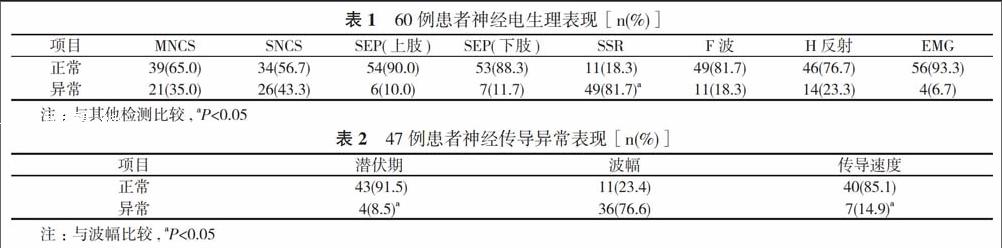
2. 1 神经电生理表现 SSR异常率(81.7%)高于其他检测, 差异具有统计学意义 (P<0.05), 其次为SNCS(43.3%)、MNCS (35.0%);病程短的患者主要表现为H反射潜伏期的异常;SEP异常率相对低, 多出现在痛性周围神经病合并有行走不稳的患者;EMG(6.7%)最低, 多出现在伴有疲乏无力的患者。见表1。
2. 2 神经传导异常表现NCS异常以轴索损害为著, 表现为传导波幅减低(占76.6%), 部分以脱髓鞘损害为著, 表现为潜伏时延长, 传导速度减慢(占23.4%)。见表2。
3 讨论
痛性周围神经病分为原因不明确的自发性周围神经痛, 以及继发于某些疾病的周围神经痛, 继发于感染, 如格林巴利综合征;继发于肿瘤如副肿瘤综合征;继发于中毒, 如药物中毒、酒精中毒;继发于代谢性疾病, 如甲状腺功能亢进症、糖尿病等。而糖尿病周围神经病是糖尿病常见并发症之一, 是痛性周围神经病的常见原因, 以疼痛为主要表现, 属于神经病理性疼痛的一种, 痛性周围神经病的发病机理复杂, 包括有Na+通道功能异常, 导致异常冲动反复发作;周围神经损伤, 再生感受器叠加疼痛刺激, 使疼痛持续反复发作。而糖尿病痛性周围神经病除以上发病机制外, 血糖过高是一个重要因素, 高血糖可使位于施万细胞内的醛糖还原酶活性增加, 从而增加了高渗物质山梨醇和果糖的浓度, 诱导氧化应激增加、内皮功能失调, 造成水钠潴留, 导致神经元代谢异常和DNA损害, 致使细胞水肿、变性、坏死, 并引起神经纤维脱髓鞘及轴索变性。炎症和葡萄糖代谢终末产物对于疼痛的发生也很关键[2, 3]。病变早期, 主要影响管痛觉的小神经纤维, 病程较长的患者, 可伴有或不伴有管深感觉的大纤维病变。疼痛包括自发性疼痛与诱发性疼痛, 自发性疼痛指持续或间歇出现的刺痛、酸痛、跳痛、触痛、痉挛样疼痛、烧灼样痛、电击痛、撕裂样痛等; 诱发性指感觉过敏、感觉倒错、感觉异常、感觉过度等[4]。患者大多表现为肢体远端对称性疼痛, 且和受损的神经长度有关, 越远端的神经, 损害越早。多数隐匿起病, 自下向上进展, 下肢重于上肢, 远端重于近端。早期以小纤维损害为著, 主要症状包括从脚开始出现的疼痛和感觉异常, 多为隐痛、刺痛、灼烧痛, 夜间明显。后期大纤维损害时出现共济失调、行走不稳、易跌倒等。部分病程长的糖尿病患者可出现上肢神经局部卡压病变, 引起肢体麻木疼痛不适, 如一侧或双侧腕管综合征、一侧或双侧肘管综合征等。此外, 糖尿病患者还可能出现肋间神经痛、腰骶神经痛等多种单神经痛。与无痛性周围神经病变相比, 其更加影响患者的生活质量和身心健康。
典型的糖尿病感觉运动性多神经病累及大小神经纤维, 如果电生理检查证实存在神经传导异常, 那么可以明显提高诊断准确性。但是常规运动或SNCV测定主要反映大的有髓神经纤维变化, 并非诊断痛性周围神经病的特异手段。学者证实2型糖尿病早期相关周围神经病主要累及感觉小纤维[5]。小纤维神经病是痛性周围神经病的一个亚型, 累及直径较小的神经纤维, 导致疼痛, 因为这些患者在早期大的神经纤维不受累, 所以一般的运动感觉神经传导检查无法发现异常, 需皮肤活检或感觉神经定量检查明确, 但感觉定量检查缺乏定位功能, 皮肤活检属有创检查, 不易开展。SSR是人体在接受突然的刺激后, 自主神经出现的反应, 主要是交感神经传出的纤维冲动所致的汗腺分泌。其中枢段包括下丘脑、脑干、边缘系统和脊髓中间侧柱, 其周围段包括交感神经节、节前纤维和节后纤维以及皮肤和汗腺。SSR能够检测小纤维特别是C 类无髓纤维的电生理特点, 可以客观评价自主神经系统功能状态。本研究发现, 糖尿病痛性周围神经病患者SSR异常率高, 可达81.7%, 可作为糖尿病痛性周围神经病的常规检测项目。纵向研究显示在2型糖尿病早期, 在大的有髓神经纤维异常出现之前就可见 C 类纤维的异常[6, 7]。在疾病早期, H反射异常率较高, 临床上常常遇到疼痛剧烈、烧灼难耐的患者经NCS、SEP检测都不能发现神经病变, 此时, SSR及H反射往往有异常发现。
本研究显示, SSR异常率(81.7%)高于其他检测, 差异具有统计学意义 (P<0.05), 其次为SNCS(43.3%)、MNCS(35.0%);病程短的患者主要表现为H反射潜伏期的异常;SEP异常率相对低, 多出现在痛性周围神经病合并有行走不稳的患者;EMG(6.7%)最低, 多出现在伴有疲乏无力的患者。对于病程长的患者, 神经传导异常率高, 尤其以感觉神经异常率高, 下肢重于上肢, 以轴索损害为著[8]。而SEP异常常出现于伴有步态不稳患者。EMG异常率低, 患者多伴有乏力且运动神经轴索损害重。本研究中还发现, MNCV、SNCV和SSR、SEP、F波、H反射检测方法对不同的临床症状既有针对性, 又有部分交叉, 如运动神经、感觉神经传导检查异常有时叠加了体感诱发电位、SSR、F波、H反射的异常。如果运动神经、感觉神经传导检查正常时, SSR检测更具有针对性。
综上所述, 在临床工作中, 医生要根据糖尿病周围神经病患者不同的临床表现, 有目的、有针对性的选择应用一种或几种不同的神经电生理检测技术, 来提高糖尿病痛性周围神经病诊断的阳性率, 从而全面完整地评价糖尿病引起的痛性周围神经病。
参考文献
[1] 林厚维, 丁文龙. 糖尿病性神经病变的机理. 解剖科学进展, 2005, 11(3):244-247.
[2] Lupachyk S, Watcho P, Obrosov AA, et al. Endoplasmic reticulum stress contributes to prediabetic peripheral neuropathy. Exp Neurol, 2013, 247(3):342-348.
[3] Sugimoto K, Yasujima M, Yagihashi S. Role of advanced glycation end products in diabetic neuropathy. Curr Pharm Des, 2008, 14(10): 953-961.
[4] Treede RD, Jensen TS, Campbell JN, et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology, 2008, 70(18):1630-1635.
[5] Divisova S, Vlckova E, Hnojcikova M, et al. Prediabetes/early diabetes-associated neuropathy predominantly involves sensory small fibres. J Peripher Nerv Syst, 2012, 17(3):341-530.
[6] Myers MI, Peltier AC, Li J. Evaluating dermal myelinated nerve fibers in skin biopsy. Muscle Nerve, 2013, 47(1):1-11.
[7] Smith AG, Ramachandran P, Tripp S, et al. Epidermal nerve innervation in impaired glucose tolerance and diabetes-associated neuropathy. Neurology, 2001, 57(9):1701-1704.
[8] 党静霞. 肌电图诊断与临床应用.第2版. 北京:人民卫生出版社, 2013:291-293.
[收稿日期:2016-07-29]
