水貂犬瘟热病毒RT-PCR检测方法建立及应用
2016-11-29于红鸽山东省即墨市畜牧兽医局266100
于红鸽 (山东省即墨市畜牧兽医局266100)
水貂犬瘟热病毒RT-PCR检测方法建立及应用
于红鸽 (山东省即墨市畜牧兽医局266100)
水貂犬瘟热病毒 (Canine distemper virus,CDV)属于副黏病毒科 (Paramyxoviridae)麻疹病毒属 (Morbillivirus)。形状多种,病毒直径大小多在150~300nm[1]。本实验通过RTPCR技术检测了水貂病料中犬瘟热病毒的感染情况,建立具有快速、灵敏的RT-PCR检测方法。
1 材料与方法
1.1 材料
1.1.1 参考毒株
犬瘟热CDV-3弱毒株。
1.1.2 试剂
DNAzol Regent、TRIzol LS?Reagent、RNA提取试剂盒;rTaqDNA ploymerase、 dNTPs、 AMV Reverse Transcriptase、Rnase-Inhibitor、 DNA Marker(DL2000); Agarose 琼脂糖;异丙醇、无水乙醇、DEPC水、氯仿、琼脂粉等。
1.1.3 仪器设备
超净工作台、台式高速冷冻离心机、PCR扩增仪 (Alpha Unit Black Assembly PCR、PTC-200)、42℃可调恒温水浴锅、高速离心机、微波炉、电子天平、DYY-Ⅲ-7型、DYY-Ⅲ-8B核酸电泳仪、紫外凝胶成像系统[2]。
1.1.4 检测的组织病料来源及病料采集方法
某新建貂场饲养水貂1600只,其中44日龄断奶幼貂1100只,2016年4月23日突然发病176只,死亡114只。
无菌操作剪取1.0~2.0g病料,加少量灭菌PBS(含青霉素、链霉素),注意边研磨边加液氮,防止RNA被降解。用PBS按1∶4稀释成悬液,-20℃反复冻融3次,4℃10000r/min离心10min,取上清,-70℃保存。
1.2 方法步骤
1.2.1 引物设计与合成
根据GenBank中CDV-3N蛋白基因序列,用Primer软件设计了特异性引物,扩增引物:CDV-3-P1(5′TAGGTTAGGGCTGTGGCCTT3′); CDV-3-P2 (5′CCGCACCTTCGGATATACTG3′)。
1.2.2 CDV的RNA提取
1.5ml离心管中加入 250μl组织液;加 TRIzol LSR Reagent750μl,颠倒 6~8 次,4℃静止 5min; 加 200μl氯仿充分震荡,在4℃冰箱,静止10min;4℃离心12000转15min;取上清液500μl,转入新EP管,加等量的异丙醇,颠倒6~8次 (-70℃冰箱中静置45min),充分沉淀核酸;4℃离心12000转15min,弃上清液;加入75%冷乙醇 (DEPC配置)1000μl,离心5min,弃上清液,干燥核酸;加20μlDEPC水溶解-20℃保存,备用。
1.2.3 CDV RNA的反转录
CDV反转录反应 (RT-PCR)总体积为 20μl:5×Buffer4μl,M-MLV(反转录酶)0.5μl,RNase inhibitor 0.5μl,RT 引物 1μl,2.5mM dNTP2.5μl,DEPC 灭菌水 8.5μl,病毒RNA模板3μl,混匀42℃水浴1h,70℃5min灭活反转录酶。得到cDNA模板,-20℃保存备用。
1.2.4 CDV PCR的反应条件的优化及体系的建立
最适模板量确定:分别以2、3、4、5、6、7和8μl反转录的cDNA为模板,对扩增产物进行琼脂糖凝胶电泳观察,保持其他试剂浓度及反应条件不变,确立最佳模板浓度。最适引物浓度确定:在PCR反应体系中分别加入上、下游引物(20μmol/μl) 0.1、 0.3、 0.5、 0.7、 1.0μl,通过琼脂糖凝胶电泳进行对扩增产物观察,确立最佳引物浓度。最佳退火温度确定:分别以47、49、51、53、55和 57℃退火温度进行PCR反应,通过琼脂糖凝胶电泳进行对扩增产物的观察,确立最佳退火温度。CDV最佳反应体系:总体积25μl,10×Buffer2.5μl,dNTP Mixture(2.5mmol/L)2μl,P1+P2 0.5μl+0.5μl,Taq0.5μl,灭菌双蒸水 17μl,DNA 模板 2μl。 最佳扩增条件:95℃预变性 5min,94℃变性 30s,51℃退火 40s,72℃延伸2min,共30个循环,72℃终延伸10min。
在PCR仪中进行扩增:95℃预变性5min;94℃变性30s,51℃退火40s,72℃延伸2min,循环数30次;72℃终延伸10min。对PCR产物进行琼脂糖凝胶电泳:用TAE缓冲液配制1%琼脂糖凝胶,琼脂糖加热溶化后加入溴化乙锭 (EB,10mg/ml)至终浓度0.5μg/μl,混匀,制成电泳凝胶板待用。取3μl扩增产物加3μl6×Loading Buffer(上样缓冲液)混匀,加入上样孔,同时以标准DNA分子量 (DL-2000 Marker)为对照,100V电泳30min,紫外凝胶成像系统观察分析结果。
1.3 CDV PCR检测方法的特异性、敏感性、重复性试验
1.3.1 RT-PCR特异性试验
分别取犬瘟热病毒 (CDV)、犬冠状病毒 (CCV)反转录产物及犬细小病毒 (CPV)抽提的DNA,用已建立的方法进行扩增,验证本方法的特异性。
1.3.2 RT-PCR敏感性试验
从疫苗中抽提CDV-3的RNA,用DEPC水将RNA依次进行10-1~10-7倍稀释,分别进行RT-PCR检测,确定其敏感性。
1.3.3 RT-PCR重复性性试验
用已建立的RT-PCR检测方法对用免疫胶体金试纸跟RT-PCR同检测为水貂犬瘟热病毒为阳性的病料进行重复检测3次,验证本方法的重复性和稳定性。
1.4 RT-PCR的临床应用
从储存水貂病料中随机取2份病料,分别用胶体金和RT-PCR方法检测。
2 结果
2.1 RT-PCR检测方法反应条件的确定
以CDV-3株为模板,利用设计的特异性引物进行RTPCR反应。显示扩增得到与预期目的条带大小相符的特异性片段。经过不同条件,优化PCR反应体系,确定采用2μl的模板量,上、下游引物各0.5μl,退火温度为51℃进行扩增。以优化的PCR反应的最佳条件进行PCR扩增并进行凝胶电泳,在287bp处得到清晰可见的目的条带。
2.2 CDV PCR检测方法的特异性、敏感性、重复性试验结果
2.2.1 特异性试验结果
RT-PCR能从提取的核酸中扩增出287bp特异条带,其他泳道的病毒:犬细小病毒 (CPV)、犬冠状病毒 (CCV)扩增结果为阴性,说明本引物特异性好 (见图1)。

图1 RT-PCR特异性实验结果
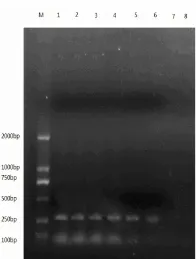
图2 RT-PCR敏感性实验结果

图3 RT-PCR重复性实验结果
2.2.2 敏感性试验结果
对不同浓度CDV-3RNA进行RT-PCR扩增,显示该RT-PCR方法最低能检出约稀释浓度10~5倍的病毒RNA(见图 2)。
2.2.3 重复性试验结果
3次重复操作RT-PCR方法检测结果一致,表明方法稳定可靠 (见图3)。
2.3 临床收集样品检测结果
本试验RT-PCR检测方法比免疫胶体金法敏感度高,结果准。
[1]高娃,杨敬,陈振文,等.犬瘟热病毒分子生物学研究进展[J].中国比较医学杂志,2004,14(4):241-244.
[2]殷震,刘景华.动物病毒学[M].第2版.北京科学出版社,1997,16(7):329-330.
于红鸽 (1989.9-),女,山东省即墨市人,大学本科,助理兽医师,主要从事动物疾病防控、动物疾病诊断工作。
