马鞭草总黄酮对肝癌HepG-2细胞凋亡的影响
2016-11-24任丽平李先佳梁树才王文宝孙民振
任丽平 李先佳 梁树才 毛 讯 王文宝 孙民振
(漯河医学高等专科学校药理教研室,河南 漯河 462002)
马鞭草总黄酮对肝癌HepG-2细胞凋亡的影响
任丽平 李先佳1梁树才1毛 讯 王文宝 孙民振
(漯河医学高等专科学校药理教研室,河南 漯河 462002)
目的 探讨马鞭草总黄酮(TFV)对肝癌HepG-2 细胞增殖和凋亡的影响。方法 MTT法检测TFV对肝癌HepG-2 细胞增殖的影响,流式细胞仪检测细胞周期和凋亡水平,Western 印迹法检测核因子(NF)-κB p65和IκB-α蛋白表达情况。结果 与阴性对照组比较,不同浓度TFV能明显抑制HepG-2 细胞的生长(P<0.01),呈浓度和时间依赖性。TFV作用于HepG-2 细胞24 h 后,HepG-2 G0/G1期细胞比例下降,S期和G2/M期细胞百分率增加(P<0.05),诱导细胞凋亡效果明显(P<0.01),能明显的降低NF-κBp65表达,升高IκB-α蛋白表达 (P<0.05)。结论 TFV能抑制HepG-2 细胞的增殖,诱导细胞凋亡,机制可能与促进IκB-α蛋白表达,下调NF-κBp65蛋白表达有关。
肝癌;HepG-2细胞;马鞭草总黄酮;细胞增殖;细胞凋亡
近年来,肝癌的发病率逐年呈上升的趋势,严重影响患者的生活质量,手术治疗及放疗、化疗等非手术治疗方案都不理想,而中医对该病的治疗取得了一定成就〔1〕。马鞭草为马鞭草科植物马鞭草的全草或带根全草,味苦性凉,具有抗癌、抗早孕和免疫调节作用。研究表明,马鞭草富含黄酮类化合物〔2〕。本研究以肝癌HepG-2细胞为研究对象,采用不同浓度马鞭草总黄酮(TFv)对人肝癌HepG-2细胞株给药,观察对人肝癌HepG-2细胞株增殖与凋亡作用的影响,探讨TFV对人肝癌细胞HepG-2细胞株抑制作用可能的机制。
1 材料与方法
1.1 药物与试剂 TFV由漯河医专天然药物化学教研室提供(纯度为90%),溶于二甲基亚砜(DMSO)中,完全培养基稀释成不同浓度,过滤除菌4℃保存。MTT细胞增殖检测试剂盒购自碧云天生物技术研究所;碘化丙啶(PI)购自Invitrogen;DMEM、胰酶购自Gibco公司;其余试剂为分析纯试剂。
1.2 细胞及培养 HepG-2 细胞株由漯河医专分子生物学实验室传代保种。10%小牛血清的DMEM液中,37℃,5%CO2培养传代,用0.25%胰蛋白酶-EDTA消化贴壁细胞。
1.3 方法
1.3.1 TFV对肝癌HepG-2细胞的毒性作用 取对数期的HepG-2细胞,细胞浓度调整至5×104个/ml,取100 μl接种于96孔板,贴壁后24 h同步化,去除培养液。实验设阴性对照组、TFV组(50、100、200、300、400、500、600 mg/L),空白对照组(不加细胞只加培养液),每孔200 μl,每组3个复孔。37℃、5% CO2条件下培养24 h,检测前4 h加入MTT (5 mg/ml)15 μl/孔,4 h后吸去培养液,加入DMSO 150 μl/孔,震荡10 min,酶联免疫检测仪于570 nm检查光密度值,计算抑制率。
1.3.2 MTT法测定TFV对肝癌HepG-2细胞增殖的影响 取对数期的HepG-2细胞,细胞浓度调整至5×104个/ml,取100 μl接种于96孔板,贴壁后24 h同步化,去除培养液。实验设阴性对照组、阳性对照组(0.3 μmol/L 5-FU)、TFV组(100、150、200 mg/L)和溶媒对照组(0.1%DMSO培养基),空白对照组(不加细胞只加培养液),每孔200 μl,每组3个复孔。37℃、5%CO2条件下培养24、48 h,检测前方法同上。
1.3.3 细胞形态学观察 参照1.3.2法设置阴性对照组、阳性对照组、TFV组(100、150、200 mg/L)。培养48 h时分别于倒置显微镜下观察细胞形态。
1.3.4 流式细胞术检测TFV对肝癌HepG-2细胞周期及细胞凋亡的影响 参照1.3.2法设置阴性对照组、阳性对照组、TFV组(100、150、200 mg/L)、空白对照组。培养24 h后,将悬浮和贴壁细胞收集于1.5 ml EP管中,4℃的70% 冰乙醇固定24 h后,经PI染色,EPICS-XL型流式细胞仪进行细胞周期分析。Annexin V/PI双染色法检测细胞凋亡情况。
1.3.5 Western 印迹方法检测NF-κB p65和IκB-α蛋白的表达 参照1.3.2法设置阴性对照组、阳性对照组、TFV组(100、150、200 mg/L)和空白对照组。细胞培养24 h后终止培养,常规方法提取蛋白质,Bradford 法测定总蛋白的量。SDS-PAGE凝胶电泳,并转移至PVDF膜,室温封闭 1 h。5%山羊血清(PBS 稀释)封闭,室温孵育 60 min;加入 1∶300 稀释(1% BSA-PBS 稀释)的 NF-κBp65和IκBα一抗,1∶500 稀释的 β-actin,4℃孵育过夜,加入抗 NF-κBp65和IκBα 二抗(1∶3 000)和β-actin 二抗(1∶5 000),室温孵育1 h。行ECL反应,显色。以同一泳道NF-κBp65、 IκBα和 β-actin 条带灰度值比反映蛋白表达水平。
1.4 统计学方法 采用SPSS15.0统计软件进行χ2检验及方差分析。
2 结 果
2.1 TFV对肝癌HepG-2细胞的毒性作用 TFV对 HepG-2 细胞有明显的细胞毒性作用,药物的浓度-抑制率曲线呈 S形,符合 Logistic曲线。根据生长抑制率采用综合法计算半数抑制量 IC50,MTT 结果显示TFV对 HepG-2 细胞的 IC50值为 229.04 mg/L。
2.2 TFV对HepG-2生长速度及凋亡的影响 与阴性对照组比较,TFV组抑制HepG-2细胞的增长明显,并具有浓度依赖性,其中200 mg/L浓度抑制效果尤其明显(P<0.01),与HepG-2阳性对照组比较差异无统计学意义(P>0.05)。而0.1%DMSO对HepG-2细胞的增长影响较小。与阴性对照组比较,TFV可以促进HepG-2细胞凋亡(P<0.01,P<0.05),且具有浓度依赖性,其中200 mg/L浓度促进效果明显(P<0.01),与阳性对照组无差异(P>0.05)。见表1。
2.3 细胞形态学观察 阴性对照组和溶媒对照组HepG-2细胞增殖旺盛,排列整齐,细胞饱满,呈现星形或梭形,折光度好;而TFV组和阳性对照组细胞与阴性对照组比较,形态改变明显,细胞间隙增加,细胞排列混乱,细胞体积明显发生改变,胞内颗粒增加,部分细胞脱落,数目减少,细胞碎片增加。其中TFV组伴随浓度变化更加明显。见图1。
2.4 TFV对HepG-2细胞周期的影响 经 TFV处理24 h,与阴性对照组相比,G0/G1 期细胞百分数逐渐减少,而 S期的细胞百分数逐渐增加(P<0.05或<0.01),同时 G2/M 期的细胞百分数也逐渐增加(P<0.05),并具有浓度依赖性,说明TFV 能造成HepG-2细胞S期和G2/M期阻滞。见表2。

表1 TFV对HepG-2生长速度的影响
与阴性对照组比较:1)P<0.01,2)P<0.05;下表同

图1 TFV对HepG-2生长形态的影响(HE,×200)
2.5 TFV对HepG-2细胞NF-κBp65、IκB-α蛋白表达的影响 TFV处理24 h之后,HepG-2细胞中NF-κBp65的蛋白表达量较阴性对照组NF-κBp65蛋白表达量明显下降(P<0.05或P<0.01),TFV组HepG-2细胞中IκB-α蛋白表达水平较阴性对照组IκB-α蛋白表达水平明显升高(P<0.05或P<0.01),并呈浓度依赖性,与阳性对照组比较无差异(P>0.05)。见表2、图2。

表2 TFV对HepG-2细胞周期的影响
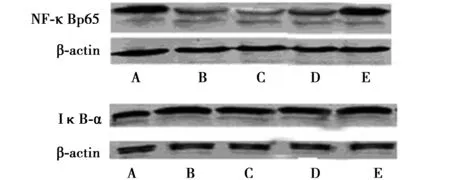
A:阴性对照组;B:阳性对照组;C、D、E:200、150、100 mg/L TFV组 图2 TFV对细胞NF-κBp65、IκB-α蛋白表达的影响
3 讨 论
肝癌是常见的恶性肿瘤,发病率和病死率较高,并出现上升趋势。目前手术治疗及放疗、化疗等已取得较大进展,但治疗后高复发和高转移率影响治疗效果。因此,采用天然、安全和高效低毒的天然药物进行抗癌治疗具有重要意义〔3〕。TFV为天然的抗炎抗肿瘤药物,具有抗癌、抗肿瘤、消心脑血管疾病、抗炎镇痛、调节免疫力、降血糖、治疗骨质疏松、抑菌抗病毒、抗氧化、抗衰老、抗辐射等作用〔4〕。
本实验提示TFV能显著抑制肝癌HepG-2 细胞的生长,诱导部分细胞凋亡,产生碎片或变小。这与朱利群等〔5〕研究结果一致,显示TFV对癌细胞的增殖抑制及凋亡促进作用。本研究结果表明TFV可能通过某种方式影响了HepG-2 细胞DNA的合成或造成DNA的损伤,最终导致DNA复制不完全,提示可通过阻滞HepG-2细胞的周期并诱导细胞凋亡。
细胞凋亡是一个错综复杂的过程,而诱导肿瘤细胞凋亡在抗肿瘤治疗中具有重要作用。NF-κBp65、IκB-α蛋白表达在细胞凋亡中发挥重要作用,NF-κB为核转录因子,以同源或异源二聚体形式存在,多数为p50和p65组成的二聚体组成参与了肿瘤的发生发展〔6〕,调控细胞的增殖、分化、凋亡以及恶性转化,其活性受到 IκB的抑制,在某些刺激因素刺激下IκB 可发生磷酸化而失活,NF-κB被激活,并进入细胞核结合于特异基因,调控基因进行表达,参与细胞周期和 DNA 复制,上调存活基因或抑制促凋亡因子,保护细胞免于凋亡〔7〕。IκB 是NF-κB强抑制物,已证实NF-κB 的活化对肿瘤细胞抵抗凋亡是必需的〔8〕,而IκB可通过抑制 NF-κB 活性而抑制体外实体瘤细胞的生长,并导致肿瘤发生率明显减低,说明 NF-κB 和 IκB 的表达失衡是肿瘤发生的关键〔9〕。本研究结果提示TFV能通过这增加 IκB的表达、抑制IκB的降解、抑制NF-κB活性来调控HepG-2细胞的增殖,通过对细胞周期和DNA复制的影响,下调编码抗凋亡作用的细胞因子,诱导HepG-2细胞的凋亡。
综上所述,TFV明显抑制人肝癌HepG-2细胞增殖,通过对细胞周期和DNA复制的影响,细胞周期阻滞在S和G2/M期,推测TFV通过影响NF-κB 和 IκB 的表达诱导人肝癌HepG-2细胞凋亡,具有明显的体外抗肝癌活性。
1 Brustmann H,Naude S.Expression of topoisomerase Ⅱ alpha,Ki-67 proliferating cell nuclear antigen,p53 and argyrophilic nuclear organizer regions in vulvar squamous lesions 〔J〕.Gynecol Oncol, 2002;86(2):192.
2 金伟军,张志东.马鞭草的研究进展〔J〕.时珍国医国药,2007;18(3):693-4.
3 Jemal A,Bray F,Center MM,etal.Global cancer statistics 〔J〕.CA:Cancer J Clin,2011;61(2):69-90.
4 黄锁义,罗建华,刘 娇,等.超声波提取马鞭草总黄酮及鉴别〔J〕.时珍国医国药,2007;18(6):1464-5.
5 朱利群,徐 珊,罗 莉,等.马鞭草有效成分对人绒毛膜癌耐药细胞株JAR/VP16的逆转作用研究〔J〕.南京医科大学学报(自然科学版),2007;27(5):419-23.
6 刘小玉,冯义朝.胃癌及癌前病变中COX-2和NF-κBp65蛋白表达及其相关性研究〔J〕.西部医学,2013;25(2):201-4.
7 Lopez-Guerra M,Colomer D.NF-kappaB as a therapeutic target in chronic lymphocytic leukemia〔J〕.Expert Opin Ther Targets,2010;14(3):275-88.
8 李 健,杜 芳,齐义军,等.食管癌及癌前病变中NF-κB p65/p50蛋白的表达〔J〕.临床与实验病理学杂志,2006;22(5):560-2.
9 卓 佳,陈柏坤,薛向阳,等.核因子-κB p65和IκB-α在宫颈癌中的表达及意义〔J〕.温州医学院学报,2005;35(3):182-4.
〔2015-04-13修回〕
(编辑 苑云杰/曹梦园)
河南省高等学校青年骨干教师资助计划项目(No.2015GGJS-288);漯河医学高等专科学校2015年度基础科学研究项目(No.2015-S-LMC03)
1 漯河医学高等专科学校生化教研室
任丽平(1984-),女,讲师,硕士,主要从事药理药效研究。
R966
A
1005-9202(2016)19-4721-03;
10.3969/j.issn.1005-9202.2016.19.022
