HPLC法测定雷贝拉唑钠肠溶片有关物质
2016-11-19赵晓群
赵晓群
(海南省药品检验所,海南 海口 570216)
HPLC法测定雷贝拉唑钠肠溶片有关物质
赵晓群
(海南省药品检验所,海南 海口 570216)
该研究用反相高效液相色谱法测定了雷贝拉唑钠肠溶片的有关物质。方法采用的色谱柱为ODS-3 5 μm 4.6 mm×150 mm(岛津);以乙腈-甲醇-水-三乙胺(300:100:600:5,用磷酸调节pH值至7.0)为流动相;流速为1.0 mL/min;检测波长为215 nm;柱温为室温;进样量10 μL。雷贝拉唑主峰与各已知杂质峰分离度良好。本方法能有效地控制雷贝拉唑钠肠溶片的有关物质。
雷贝拉唑钠肠溶片;有关物质;HPLC
雷贝拉唑钠肠溶片(Rabeprazole Sodium Enteric-coated Tablets)在临床上主要用于胃溃疡、十二指肠溃疡、吻合口溃疡、反流性食管炎、卓-艾(Zollinger-Ellison)综合征(胃泌素瘤)。雷贝拉唑钠(Rabeprazole Sodium)收载于新药转正标准73册[1],采用HPLC测定有关物质,未对单个杂质进行控制。国内其他已公开相关文献也未对单杂进行研究控制[2-4]。日本药典[5]收载了该品种,有关物质采用等度洗脱法,也未进行单个杂质控制。为此,通过上述的色谱条件,进行摸索研究及优化,确定本品的色谱条件,本实验建立了采用加校正因子的主成分自身对照法进行测定,更准确的测定雷贝拉唑钠肠溶片中各杂质的含量。
1 实 验
1.1 仪器与试药
SPD-M20A、 LC-20AT,岛津公司;CBM-20Alite,SCL类型;LC-solution色谱工作站; AB135-S型电子天平。
雷贝拉唑钠肠溶片,海南中化联合制药工业股份有限公司(规格:20 mg,批号:20120401、20120402、20120403);雷贝拉唑钠对照品(纯度93.1%),中国食品药品检定研究院(批号:100658-201102)。
杂质A、B、C、D、E、F对照品(均为LGC对照品):
杂质A批号618.02.07.02(雷贝拉唑硫化物,化学名:2-{[4-(3-Methoxypropoxy)-3-methylpyridine-2-yl]methylthio}-1H-benzimidazole;含量:96.5%);
杂质B批号618.03.07.01(雷贝拉唑砜,化学名:2-[[4-(3-Methoxypropoxy)-3-methyl-pyridin-2-yl]methylsulfonyl]benzoimidazole;含量:99.6%);
杂质C批号618.04.07.01(雷贝拉唑N-氧化物,化学名:Rabeprazole N-Oxide;含量:97.1%);
杂质D批号618.05.07.01(雷贝拉唑砜N-氧化物,化学名:2-[[[4-(3-Methoxypropoxy)-3-methyl-1-oxido-2-pyridinyl]methyl]sulfonyl]-1H-benzimidazole;含量:99.5%);
杂质E批号7982(雷贝拉唑巯代杂质,化学名:2-Mercaptobenzimidazole;含量:99.8%);
杂质F批号618.07.09.02(雷贝拉唑氯代杂质,化学名:2-Chloromethyl-3-methyl-4-(3-methoxypropoxy)pyridine hydrochloride;含量:99.5%)。
乙腈、甲醇为色谱纯,三乙胺、磷酸、氢氧化钠均为分析纯,水为纯化水。
1.2 方法
1.2.1 色谱条件
色谱柱:ODS-3 5 μm 4.6×150 mm (岛津),流动相为乙腈-甲醇-水-三乙胺(300:100:600:5)(用磷酸调节pH值至7.0);检测波长为215 nm;进样量10 μL,柱温为室温;流速为1.0 mL/min。
1.2.2 溶液的配制
(1)供试品溶液 取本品5片,置200 mL量瓶中,加0.1 mol/L 的氢氧化钠溶液40mL,超声溶解,放冷至室温,加甲醇稀释至刻度,摇匀,在3000 rpm下离心10 min,取上清液作为供试品溶液。
(2)对照溶液 精密量取供试品溶液1 mL,置100 mL量瓶中,加混合溶剂[0.1 mol/L氢氧化钠:甲醇(4:1)]稀释至刻度,作为对照溶液。
(3)对照品溶液 ①雷贝拉唑对照品溶液:精密称取对照品适量,加混合溶剂[0.1 mol/L氢氧化钠:甲醇(4:1)]溶解并稀释成约含100 μg/mL的溶液(母液);精密量取母液1 mL,置10 mL量瓶中,用混合溶剂[0.1 mol/L氢氧化钠:甲醇(4:1)]稀释成约10 μg/mL的溶液(定位液)。②杂质A溶液:精密称取杂质A适量,加乙腈溶解并稀释成约含100 μg/mL 的溶液(母液);精密量取母液1 mL,置10 mL量瓶中,用乙腈稀释成约10 μg/mL的溶液(定位液)。③杂质B溶液:精密称取杂质B适量,加乙腈溶解并稀释成约含100 μg/mL 的溶液(母液);精密量取母液1 mL,置10 mL量瓶中,用乙腈稀释成约10 μg/mL的溶液(定位液)。④杂质C溶液:精密称取杂质C适量,加乙腈溶解并稀释成约含100 μg/mL的溶液(母液);精密量取母液1 mL,置10 mL量瓶中,用乙腈稀释成约10 μg/mL的溶液(定位液)。⑤杂质D溶液:精密称取杂质D适量,加乙腈溶解并稀释成约含100 μg/mL的溶液(母液);精密量取母液1 mL,置10 mL量瓶中,用乙腈稀释成约10 μg/mL的溶液(定位液)。⑥杂质E溶液:精密称取杂质E适量,加乙腈溶解并稀释成约含100 μg/mL的溶液(母液);精密量取母液1 mL,置10 mL量瓶中,用乙腈稀释成约10 μg/mL的溶液(定位液)。⑦杂质F溶液:精密称取杂质F适量,加甲醇溶解并稀释成约含100 μg/mL的溶液(母液);精密量取母液 1 mL,置10 mL量瓶中,用甲醇稀释成约10 μg/mL的溶液(定位液)。⑧混合溶液:精密量取上述①至⑦的母液各1 mL,同置于20 mL量瓶中,加混合溶剂[0.1 mol/L氢氧化钠:甲醇(4:1)]稀释至刻度,摇匀,即得。
1.3 方法学验证
1.3.1 系统适用性试验
取上述“1.2.2”项下(3)对照品溶液中的溶液,分别精密量取10 μL,注入液相色谱仪中,记录色谱图。试验结果见图1及表1。
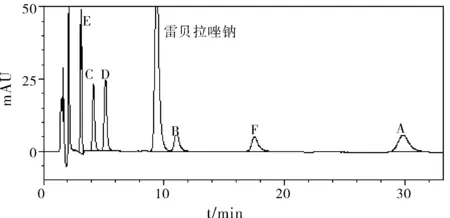
图1 系统适用性结果
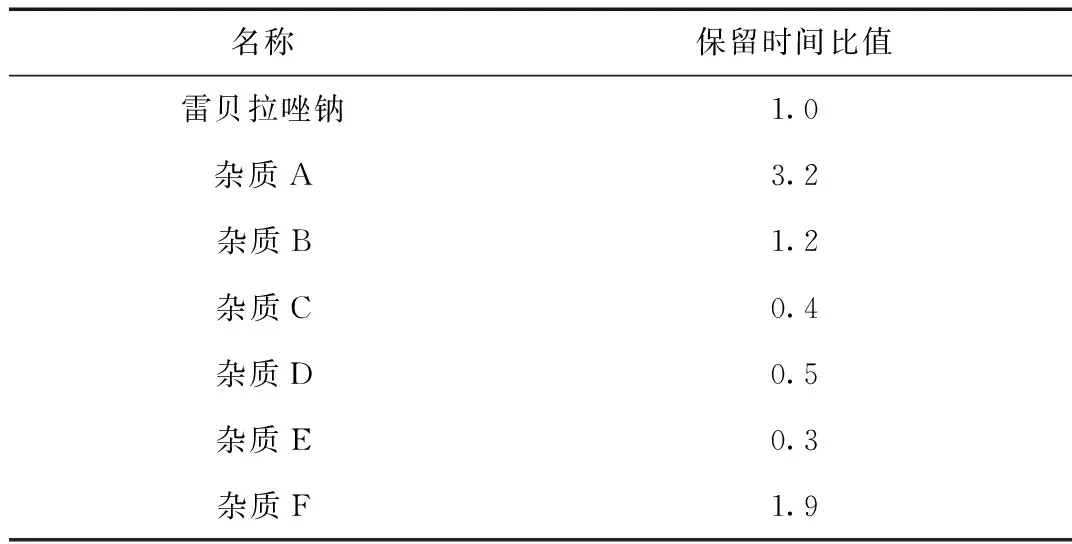
名称保留时间比值雷贝拉唑钠1.0杂质A3.2杂质B1.2杂质C0.4杂质D0.5杂质E0.3杂质F1.9
1.3.2 专属性试验
(1)未破坏试验 取本品细粉约300 mg,置50 mL量瓶中,加0.1 mol/L氢氧化钠10 mL,加甲醇稀释至刻度,摇匀,在3000 rpm下离心10 min,取上清液。
(2)强碱破坏试验 取本品细粉约300 mg,置50 mL量瓶中,加0.1 mol/L氢氧化钠10 mL,放置1 h,加甲醇稀释至刻度,摇匀,在3000 rpm下离心10 min,取上清液。
(3)强酸破坏试验 取本品细粉约300 mg,置50 mL量瓶中,加0.1 mol/L盐酸10 mL,放置1 min,加0.1 mol/L氢氧化钠20 mL,加甲醇稀释至刻度,摇匀,在3000 rpm下离心10 min,取上清液。
(4)强光破坏试验 取本品细粉约300 mg,置50 mL(无色)量瓶中,置紫外灯下照射2 h,加0.1 mol/L氢氧化钠10 mL,加甲醇稀释至刻度,摇匀,在3000 rpm下离心10 min,取上清液。
(5)高温破坏试验 取本品细粉约300 mg,置50 mL量瓶中,加0.1 mol/L氢氧化钠10 mL,在水浴加热1 h,放凉至室温,加甲醇稀释至刻度,摇匀,在3000 rpm下离心10 min,取上清液。
(6)强氧化破坏试验 取本品细粉约300 mg,置50 mL量瓶中,加0.01 mol/L高锰酸钾溶液5 mL,放置5 min,加0.1 mol/L氢氧化钠10 mL,加甲醇稀释至刻度,摇匀,在3000 rpm下离心10 min,取上清液。
分别精密量取上述溶液各10 μL,注入液相色谱仪中,记录色谱图。
结果表明,本品在上述条件下均有不同程度的破坏,在强酸及高温破坏条件下破坏较明显;破坏产生的降解产物与雷贝拉唑钠峰达到基线分离,雷贝拉唑钠主峰与各已知杂质峰均未检出不纯物,各峰的峰纯度均良好;在各个波长点进行杂质峰比较,最终选择215 nm的波长能够检出最多杂质,本品专属性较好。因此,采用上述色谱条件可满足本品中的有关物质测定的要求。
1.3.3 检测限试验
分别精密量取“1.2.2”项下(3)对照品溶液中的雷贝拉唑钠对照品定位溶液及各杂质对照品溶液适量,加混合溶剂[0.1 mol/L氢氧化钠:甲醇(4:1)]溶解并稀释制成定位溶液,再逐级等比稀释定位溶液,并精密量取上述溶液10 μL注入液相色谱仪,记录色谱图。
结果表明:雷贝拉唑钠检测限为15.01 ng(S/N≈3);杂质A检测限为15.02 ng(S/N≈3);杂质B检测限为4.41 ng(S/N≈3);杂质C的检测限为7.73 ng(S/N≈3);杂质D的检测限为16.04 ng(S/N≈3);杂质E的检测限为2.02 ng(S/N≈3);杂质F的检测限为7.94 ng(S/N≈3)。
1.3.4 校正因子的测定
精密量取“1.2.2”项下(3)对照品溶液中的雷贝拉唑钠对照品定位溶液及各杂质对照品溶液适量,按上述测定方法进行测定。结果见表2。
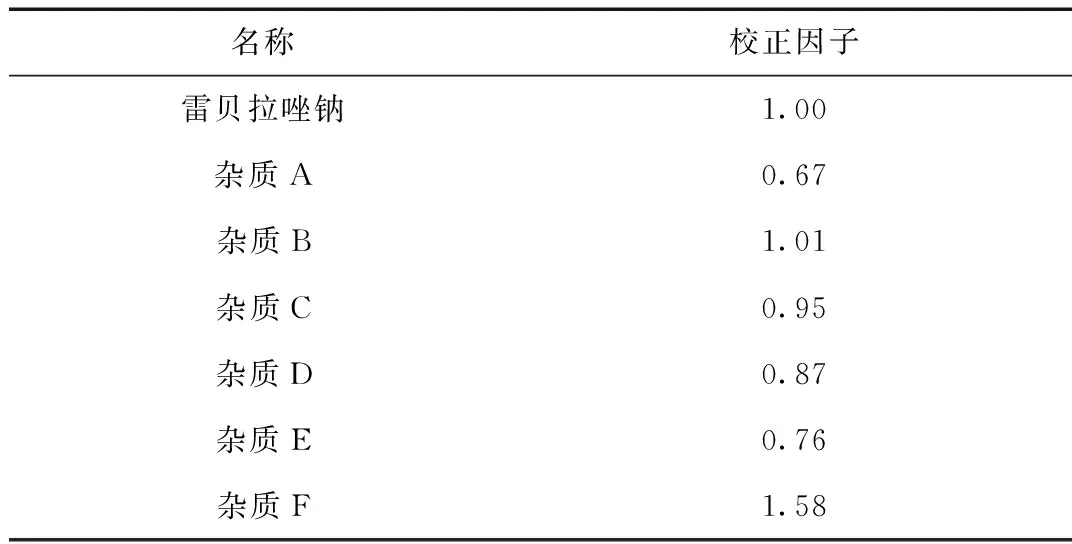
表2 校正因子计算结果
1.3.5 自身对照进样精密度试验
取“1.2.2”项下(3)对照品溶液中的混合溶液,精密量取10 μL注入液相色谱仪,连续进样6次,记录色谱图。结果见表3。
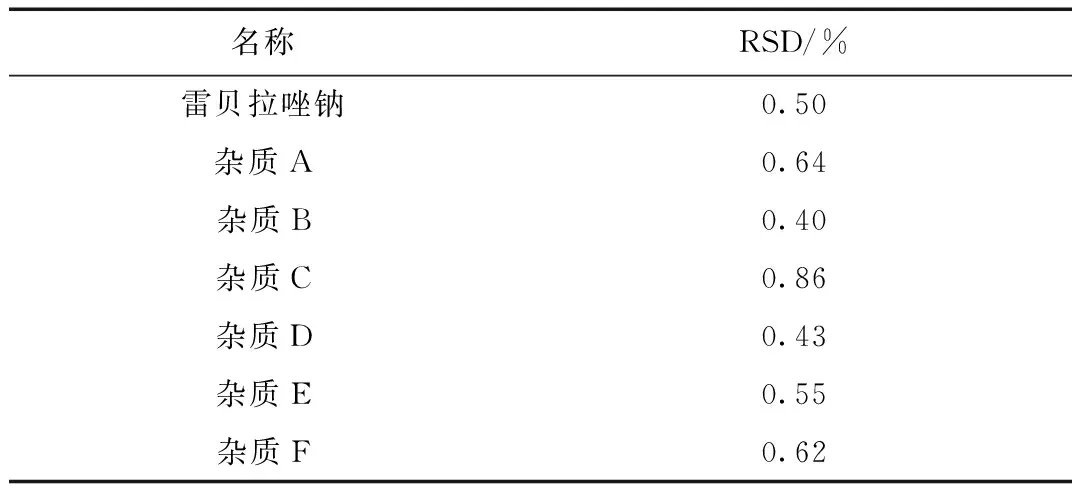
表3 进样精密度试验
结果表明,上述对照品及杂质溶液的进样精密度RSD(%)小于2.0%,能满足本品的有关物质测定的要求。
1.3.6 重复性试验
按“1.2.2”项溶液的制备方法,平行制备6份供试品溶液,按上述的测定方法测定,精密量取10μl注入液相色谱仪,记录色谱图。结果表明,本品有关物质测定6份重复性较好,该色谱条件可满足有关物质测定的要求。
1.3.7 溶液稳定性试验
取上述同一份供试品溶液,按上述的测定方法测定,每2 h测定1次,连续测定5次,试验结果表明,本品溶液在8 h内不稳定,部分杂质随时间的延长而增大,因此,本品有关物质测定需临用新制。
1.3.8 耐用性试验
分别采用不同的色谱条件,照“1.2.1”项下方法测定各杂质的相对保留时间,结果表明,不同色谱柱进行测定时,各杂质的相对保留时间均符合规定。不同色谱柱进行测定时不影响本品的有关物质的检测。结果见表4。
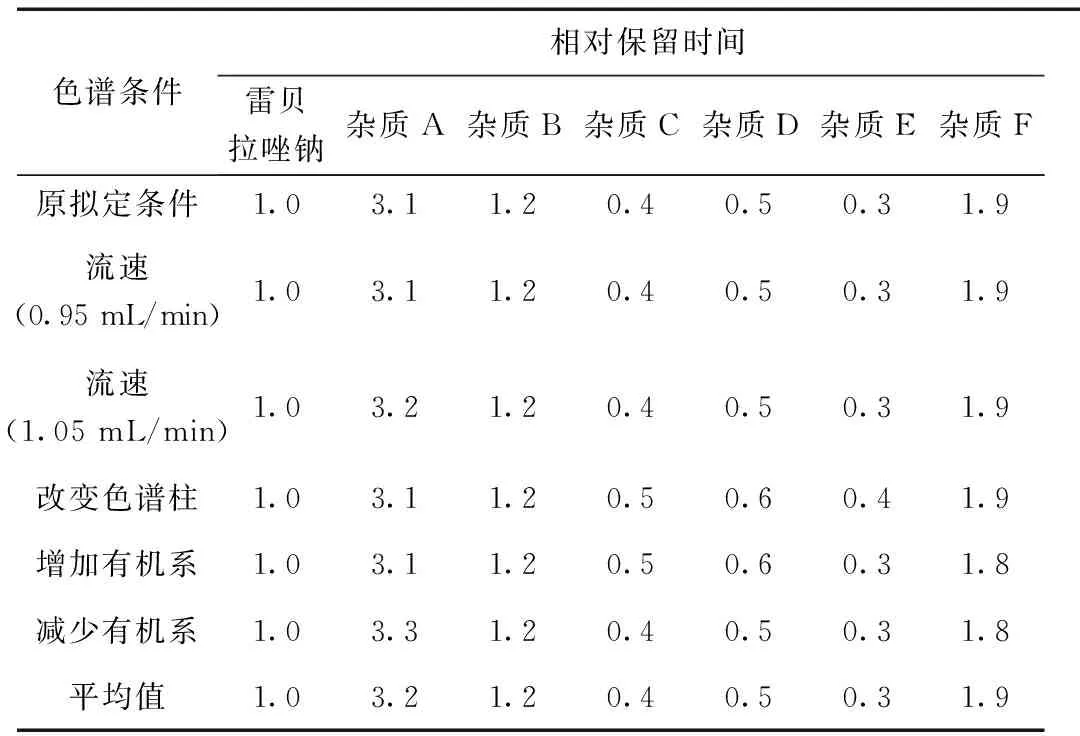
表4 耐用性试验结果
2 结果与讨论
取三批供试品分别按上述方法要求测定,结果见表5。

表5 有关物质测定结果
由表5结果可知:
(1)雷贝拉唑钠肠溶片国家药品标准和文献中有关物质测定方法,未对已知杂质进行研究控制[1-5]。本文通过色谱条件的摸索研究及方法的优化,证明采用等度衡流洗脱法,可以满足各个杂质的分离及控制。
(2)参照国家药品标准雷贝拉唑钠肠溶片{WS1-(X-117)-2006Z}[1]、JP(16)标准[5],测定波长均为290 nm,通过专属性试验,分别在不同的测定波长下比较检出杂质峰的个数,证明本品在215 nm波长处能够检出最多杂质峰,且检出量也是最大,最终选择215 nm作为本品的测定波长。
(3) 检查有关物质最常用的方法是不加校正因子的主成分自身对照法,但当杂质的校正因子超出0.9~1.1范围时,测定结果已不能真实反映样品质量,不宜采用此法[6]。经分析测定,雷贝拉唑钠已知杂质A~F中,只有杂质B及杂质C,校正因子在0.9~1.1的范围,不需校正,其他的均超出了0.9~1.1的范围,应对结果加以校正,才能真实反映样品质量。
3 结 论
本方法采用的高效液相色谱法作为测定方法,经方法学验证,雷贝拉唑钠及各已知杂质均达到良好分离,不干扰检测,灵敏度高、专属性强、重复性较好。
[1] 国家药品新药转正标准第73册雷贝拉唑钠肠溶片{WS1-(X-117)-2006Z} [S].2010:149-150.
[2] 肖扬帆, 张娜, 陈延祥,等. HPLC法测定雷贝拉唑钠肠溶片的含量和有关物质[J]. 药学研究, 2010, 29(8):472-474.
[3] 马延, 王媛, 畅瑞苗,等. HPLC法测定雷贝拉唑钠肠溶微丸的有关物质[J]. 中国生化药物杂志, 2015, 35(4):165-168.
[4] 裴晓丽, 刘明月, 张小山,等. HPLC测定雷贝拉唑钠原料的含量及有关物质[J]. 中国药学杂志, 2004, 40(8):631-631.
[5] JP XVI,2011:1332-1333;
[6] 国家药典委员会.中华人民共和国药典(四部)[S].北京:中国医药科技出版社,2015.
HPLC Determination of Related Substances in Rabeprazole Sodium Enteric-coated Tablets
ZHAOXiao-qun
(Hainan Province Institute of Drug Control, Hainan Haikou 570216, China)
An RP-HPLC method for the determination of related substances in Rabeprazole Sodium Enteric-coated Tablets was established. The chromatographic analysis was performed on C18(4.6 mm×150 mm,5 μm)column. Acetonitrile-mehanol-water-triethylamine (300:100:600:5) mixtures (adjusted with phosphoric acid to pH 7.0) was applied as mobile phase.The flow rate was 1.0 mL/min.The detection wavelength was at 215 nm. The column temperature was room temperature,with 10 μL injection volume. Rabeprazole sodium and its specified related substances could be well separated. This method can be applied to control the related substances of Rabeprazole Sodium Enteric-coated Tablets.
Rabeprazole Sodium Enteric-coated Tablets; relative substances; HPLC
赵晓群(1979-),女,硕士,主管药师,研究方向:药物检验和药品研发。
R927.2
A
1001-9677(2016)020-0096-04
