荧光分析法测定芒果叶总黄酮含量的研究*
2016-11-19卢秋榕韦迎春曾雪霞
卢秋榕,韦迎春,黎 慧,曾雪霞,李 梅
(右江民族医学院药学院,广西 百色 533000)
荧光分析法测定芒果叶总黄酮含量的研究*
卢秋榕,韦迎春,黎 慧,曾雪霞,李 梅
(右江民族医学院药学院,广西 百色 533000)
采用荧光分析法测定芒果叶中总黄酮含量。根据Al3+与黄酮类化合物形成稳定的荧光络合物,以芦丁为标样,采用低共熔溶剂作为提取溶剂,对芒果叶总黄酮进行微波辅助提取,选择激发波长λex=436 nm、发射波长λem=483 nm条件下,测定四种品种的芒果叶中总黄酮含量。该方法检测限为0.12 μg/mL,线性范围在0.16~0.80 μg/mL之间,线性方程为:y=11.41+1789.2x,线性相关系数为r=0.9989,回收率为97.2%~102.5%,相对标准差(RSD)为1.39%。荧光分光光度法测定芒果叶中总黄酮含量准确度较高,操作简便,成本低。
芒果叶;总黄酮;荧光光谱法
有“果王”之称的芒果属漆树科植物,其色、香、味、形极佳,是五大热带名果之一[1],也是热带亚热带地区常用于出口的水果之一[2-3]。芒果叶富含黄酮类化合物、槲皮素、芒果苷、异芒果苷、抗坏血酸、鞣质等多种化学成分[3-4]。黄酮类化合物具有抗氧化、抗癌、抗血管增生、消炎、抗变应性、和抗病毒等药理作用[5-8],许多以黄酮类成分为主的制剂已作为成药上市。目前,作为主要原料芒果叶部分已用于生产中成药芒果止咳片[9],然而芒果叶资源尚未得到充分的利用与开发。因此,对芒果叶中主要的黄酮类成分进行研究有着更深远的现实意义与应用前景。
对芒果叶中总黄酮的质量控制研究有利于芒果叶的质量稳定性和可控性,确保临床用药的安全性和有效性。分光光度法根据黄酮与Al3+形成稳定的配合物,产生特征的吸收光谱而进行测定。由于芒果叶中成分比较复杂,其中可能含有的酚类物质,对吸光度值的测定产生干扰,进而对实验结果的准确性产生影响[10-11]。本文根据黄酮类化合物与Al3+形成稳定的荧光配合物,用荧光光度法测定总黄酮的含量[12-14]。该方法操作简便,成本低,准确、灵敏度高,具有良好的分析应用前景,广泛用于植物中总黄酮含量的测定具有潜在的应用。
1 实 验
1.1 主要仪器与试剂
1.1.1 仪器
XH-100A微波萃取仪,北京祥鹄科技发展有限公司; RF-5301PC荧光分光光度计,日本津岛;DF-101S集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司;DHG-9240电热鼓风干燥箱;HP-01D无油真空泵,天津恒奥科技发展有限公司;普力菲尔FST-III-20纯水机;BSBT223S型电子天平;XS205DU十万分之一天平;NNJ-100万能粉碎机,浙江省永康市景雄不锈钢制品、PHSJ-4F pH计,上海仪电科学仪器股份有限公司。
1.1.2 样品与试剂
芒果叶,采摘于广西百色市田东县农场,经鉴定为漆树科植物芒果的叶。洗净,于65 ℃烘干,粉碎过80目筛,备用。
芦丁标准品,北京世纪奥科生物技术有限公司;氯化胆碱、氯化铜二水、氯化铁四水,生工生物工程(上海)股份有限公司;乙二醇、乳酸,成都市科龙化工试剂厂;乙醇,天津市北联精细化学品开发有限公司;蔗糖,天津市大茂化学试剂厂;甘油,天津市光复精细化工研究所;柠檬酸,天津市化学试剂供销公司;硝酸铝、氯化钾、氯化镁、氯化钙、醋酸、醋酸钠,汕头市西陇化工有限公司,以上所用的试剂均为分析纯;实验用水为超纯水。
1.2 实验方法
1.2.1 溶液的配置
芦丁标准溶液的配置:精密称取10 mg芦丁标准品,用乙醇溶液溶解,并定容至50 mL,配置成0.2 mg/mL的标准溶液。准确吸取标准溶液0,0.3,0.6,0.9,1.2,1.5 mL,分别加入12.5%的Al(NO3)3溶液0.5 mL,pH=3.8的醋酸-醋酸钠缓冲液0.25 mL,用60%的乙醇溶液定容至2.5 mL,摇匀,即配制得标准溶液。
样品溶液的制备:采用含水量30%、摩尔比1:3、固液比1:90 g/mL的氯化胆碱/乙二醇体系为提取溶剂,按照微波提取工艺参数:功率为500 W、提取温度为65 ℃、提取时间为10 min,对芒果叶总黄酮进行微波辅助提取。经抽滤后,取0.10 mL的提取液,加入12.5%的Al(NO3)3溶液0.5 mL,pH=3.8 的醋酸-醋酸钠缓冲液0.25 mL,用提取溶剂定容至2.5 mL,摇匀,即配制得样品溶液。
1.2.2 总黄酮含量的荧光检测条件
选择激发光谱通带3 nm,发射光谱通带5 nm,激发波长λex=436 nm,发射波长λem=483 nm,并在此条件下测定芦丁标准工作溶液的荧光强度,以浓度为横坐标,荧光强度为纵坐标作图,绘制标准曲线,然后在此相同的条件下测定提取的样品总黄酮的荧光强度,再用回归方程求取含量。
1.2.3 芒果叶总黄酮提取率的计算

式中:X——样品液所测吸光值所对应的标准溶液曲线上的浓度,μg/mL
V0——定容的样品液体积,此处为50 mL
V1——测吸光值时所吸取样品液的体积,此处为0.1 mL
V2——测吸光值时的样品液体积,此处为2.5 mL
m——芒果叶重量,mg
2 结果与讨论
2.1 荧光化合物的激发及发射光谱
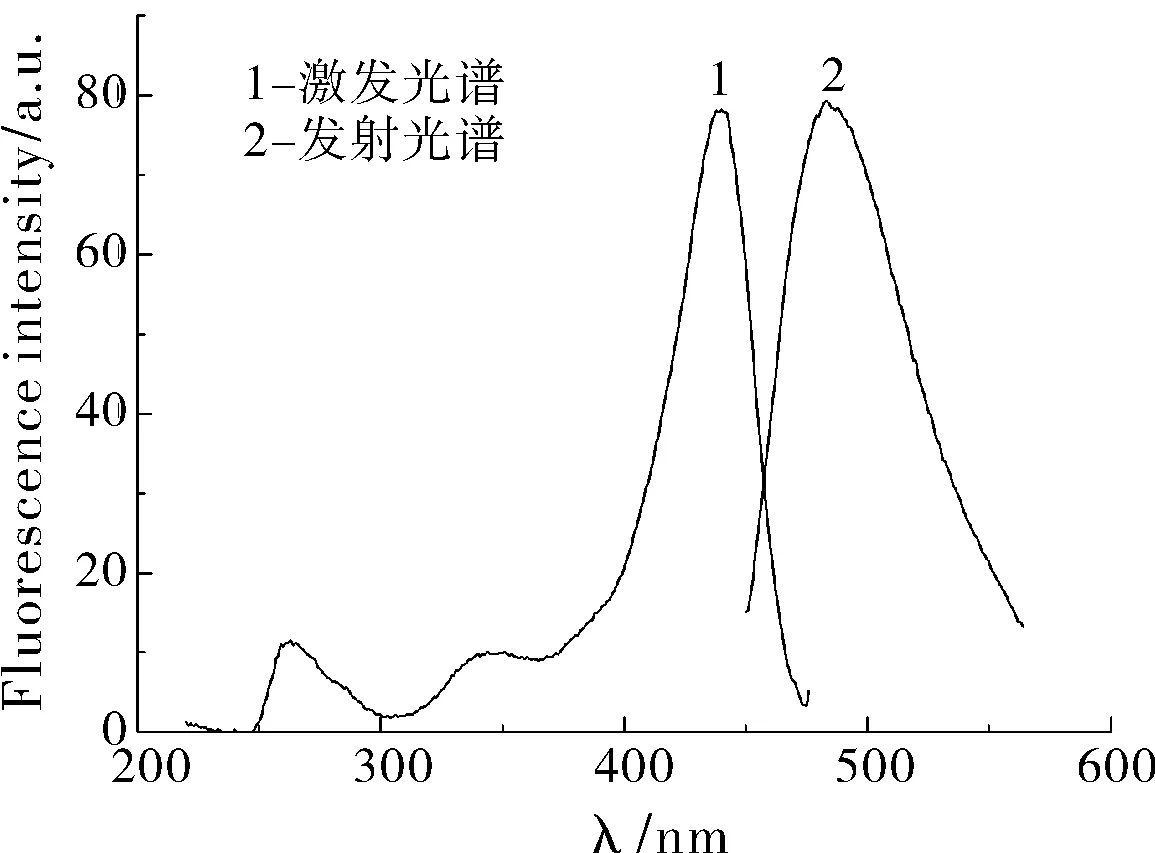
图1 荧光化合物的激发和发射光谱图
根据上述的光谱扫描条件,对芦丁标准工作溶液进行激发及发射光谱扫描。激发及发射光谱如图1所示,本文选择的激发光谱为 436 nm,发射光谱为483 nm。
2.2 荧光测定条件的优化
2.2.1 硝酸铝的加入量
黄酮类化合物与Al3+可生成稳定的荧光配合物,本实验分别对用量为5.0%、7.5%、10.0%、12.5%、15%的Al(NO3)3溶液0.5 mL进行了考察,加入12.5% AlCl3溶液0.5 mL时荧光强度最大。因此,本实验选择12.5%的Al(NO3)3,加入量为0.5 mL。
2.2.2 pH值的影响
pH值影响配合物的形成和荧光强度。溶液呈酸性时,溶液荧光强度较大,本实验对pH 3.8~6.2进行了优化。当pH为3.8时,溶液荧光强度值最大,因此,实验选择pH=3.8的醋酸-醋酸钠缓冲液。
2.2.3 静置时间的影响
在不同的时间5、10、15、20、30 min分别测定芦丁对照品溶液的荧光强度。10 min后溶液的荧光强度有平缓下降趋势,综合考虑样品制备时间,因此,选择反应10 min为最佳的测定时间。
2.2.4 金属离子的干扰实验
实验对一些常见的金属离子进行了干扰测定。结果表明,溶液中加入100倍的Ca2+、Mg2+、K+对总黄酮的测定无影响,然而100倍的Fe3+、Cu2+对测定有干扰。
2.3 校准曲线及方法的检出限
在本实验优化的条件下,按实验方法测定了芦丁的标准曲线。实验结果如图2所示,溶液的荧光强度与芦丁浓度在0.16~0.80 μg/mL内具有良好的线性关系,相关系数r=0.9989,线性回归方程为y=11.41+1789.2x,式中:y为荧光强度,x为芦丁的浓度(μg/mL)。方法的检出限(3σ,σ=S0/S,S0为空白溶液多次测量的标准偏差;S为标准曲线的斜率)为0.12 μg/mL。
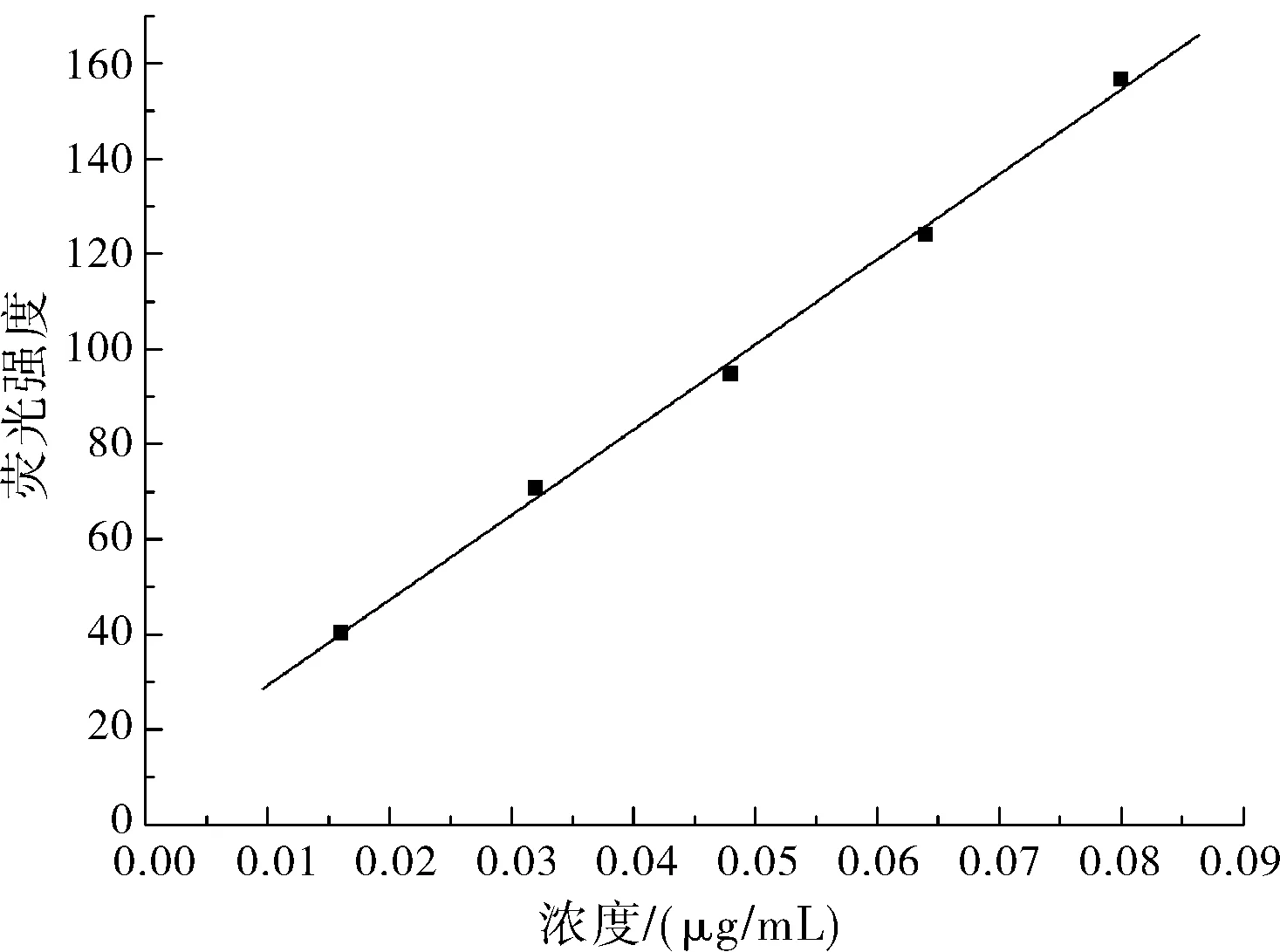
图2 芦丁标准曲线
2.4 样品测定及回收率实验
按照实验方法测定百色地区产的四种芒果叶中的总黄酮含量,对提取的样品溶液进行平行测定(n=3),结果如表1所示。
往经处理后的桂七芒果叶样品溶液中加入不同浓度的芦丁对照品,计算其回收率,其结果如表2所示。由表2可知,本方法测定桂七芒果叶中总黄酮含量的平均回收率在97.2%%~102.5%之间,实验结果较为准确,说明本方法可行。
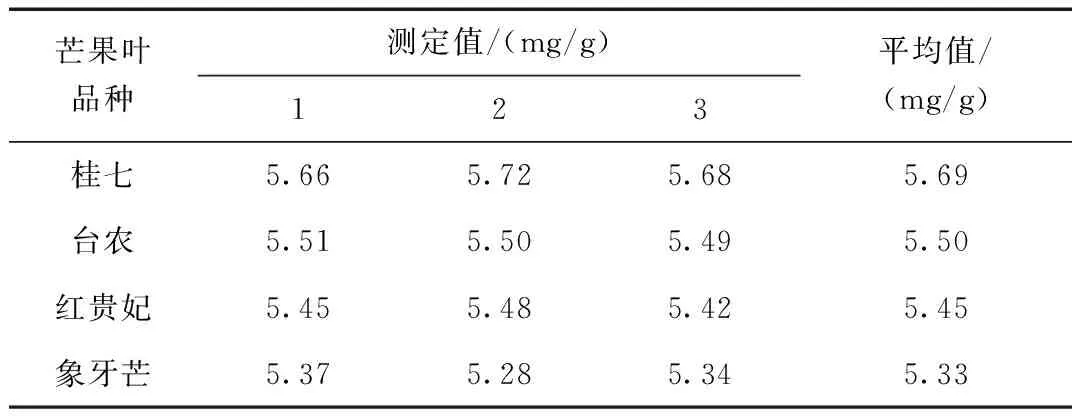
表1 四种品种芒果叶总黄酮含量
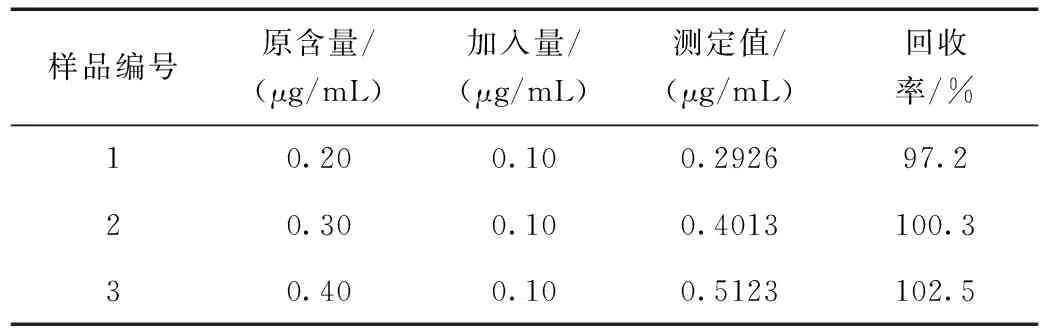
表2 桂七芒果叶样品回收率实验结果
3 结 论
广西百色地区盛产芒果,芒果树种植广泛,而芒果叶中含有丰富的黄酮类化合物,因此,芒果叶具有良好的开发和利用价值。
本研究以百色地区产芒果叶为原料,利用微波辅助低共熔溶剂提取芒果叶的总黄酮,通过荧光分光光度法测定芒果叶中总黄酮的含量,排除了芒果叶中可能含有的酚类物质直接用铝离子显色分光光度法测定总黄酮的干扰,方法准确度和精密度均较高,线性关系和重现性较好,操作简便,分析成本低,具有良好的潜在的分析应用前景。
[1] 唐玉莲,黎海妮,刘海花,等.芒果叶中总黄酮的提取及含量测定[J].右江民族医学院学报, 2006, 28(1): 8-10.
[2] 唐燕青,丘丹萍,罗泳林,等. 芒果叶总皂苷提取工艺的优化研究[J].化工技术与开发,2009, 38(7):18-19.
[3] HECP. Nutritive diagnosis and technology of prevention and cure in tablet of mango leaves[J]. Plant Doctor, 2001, 14(6):18.
[4] Zhong H J,Martin A K Williams,David M Goodall,et al. Capillary electrophoresis studies of pectins [J]. Carbohydrate Research, 1998, 308:1-8.
[5] 乌兰格日乐,白海泉,翁慧.黄酮的抗氧化活性研究进展[J].内蒙古民族大学学报:自然科学版, 2008, 23(3): 277-279.
[6] 晨曦,李伟杰,金鑫,等.甜罗勒提取物的抗氧化作用以及心血管疾病治疗研究[J].中西医结合心血管病杂志, 2014, 13(2): 132-135.
[7] 朱晓莹,林瑶,黄锁义,等.薏苡茎叶提取物的体外抗肿瘤活性研究[J].时珍国医国药, 2014, 25(4):782-783.
[8] Shibano M,Baba K. The potential to reduce postprandial hyperglycemia of Commelina communis vat. hoensis[J]. Foods & Food Ingred Jpn, 2004, 209(6): 465.
[9] 戴航,侯小涛,周丽霞,等.正交试验法优选芒果叶中槲皮素的提取工艺[J].广西中医药,2006, 29(5): 54-55.
[10]中国科学院植物研究所编.中国高等植物图鉴[M].北京:科学出版社,1985:170.
[11]魏永生,王永宁,石玉平,等.分光光度法测定总黄酮含量的实验条件研究[J].青海大学学报, 2003, 21(3): 61-63.
[12]夏锦尧.实用荧光分析法[M].北京:中国人民公安大学出版社, 1993: 116-124.
[13]Brown S B.分子发光分析法[M].祝大昌,陈剑,朱世盛(译).上海:复旦大学出版社, 1985:21-52.
[14]庞志功,汪宝琪,杨云.西藏雪莲花中总黄酮含量测定研究[J]. 化学研究与应用, 1995, 7(1): 102-104.
Determination of Total Flavanoid in Leaves of Mango by Spectrofluorimetry*
LUQiu-rong,WEIYing-chun,LIHui,ZENGXue-xia,LIMei
(Pharmaceutical College,Youjiang Medical University for Nationalities,Guangxi Baise 533000, China)
A method of determining total flavone in leaves of mango by spectrofluormietry was established. Taking rutin as standard sample and using deep eutectic solvents(DESs) as extractic solvents and microwave-assisted extraction of total flavonoids from leaves of mango, total flavanoid content leaves of various mango was determined by spectrofluormietry at the excitation wavelength of 436 nm and the emission wavelength of 483 nm. The detection limit was 0.12 mg/mL, in the linear range of 0.16 and 0.80 mg/mL with the regression equation of y=11.41+1789.2x, correlativity was 0.9989, RSD was 1.39%. The method of determining the total flavone content in leaves of mango by fluorescence spectrofluormietry had high accuracy, and it was easy to operate with low cost.
leaves of mango; total flavonoid; spectrofluorimetry
广西高校右江流域特色民族药研究重点实验室开放课题(NO: xzdsysyy2015309); 2016年度广西大学生创新创业训练计划项目(NO: 201610599029)。
卢秋榕(1995-),女,学生,主要研究方向:药物分析与检测。
李梅。
O657.3
A
1001-9677(2016)020-0085-03
