拟南芥ERF转录因子基因应答非生物胁迫表达模式1)
2016-11-19赵金玲姚文静姜廷波周博如
赵金玲 姚文静 姜廷波 周博如
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
拟南芥ERF转录因子基因应答非生物胁迫表达模式1)
赵金玲 姚文静 姜廷波 周博如
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
以122条拟南芥(Arabidopsisthaliana)ERF转录因子家族基因为研究对象,用RT-qPCR检测其应答盐胁迫情况,分析15个盐胁迫敏感基因在盐、干旱和ABA胁迫条件下的表达模式。在盐胁迫条件下,有36个基因上调表达,42个基因下调表达,44个基因无明显变化。其中,15个盐胁迫敏感基因在不同胁迫条件下表现出不同的表达模式。在盐胁迫条件下,15个ERF基因的表达水平随胁迫时间的延长均表现出明显升高,在36和72 h两个时间点达到极显著水平。在ABA胁迫条件下,15个ERF基因中大多数表达水平提高。在干旱胁迫下,15个ERF基因表达水平均随胁迫时间延长有所提高,在48 h达到最高。AT1G06160、AT1G21910、AT2G35700、AT4G17490、AT4G39780和AT5G61890等6个基因在非生物胁迫条件下表达模式相似,表明其可能参与相似的基因调控途径。其他9个ERF基因在非生物胁迫下表现出不同的表达模式,表明其可能参与不同基因调控途径。
拟南芥;ERF基因家族;基因表达;非生物胁迫
ERF亚家族是AP2/ERF超家族的一员,含有一个单一的AP2/ERF域,在植物的生命周期中发挥着重要作用[1]。ERF亚家族可以分为2个亚类:CBF/DREB亚类和ERF亚类[2]。CBF/DREB亚类成员可以识别干旱和冷诱导响应元件(DRE/CRT,A/GCCGAC),在植物应答非生物胁迫过程中起重要的作用[3-4]。ERF亚家族成员可以识别GCC-box(AGCCGCC),在植物应答生物胁迫过程中发挥作用[5]。随着人类经济活动的日趋频繁,土壤盐渍化、干旱等现象日益严重,成为限制植物生长发育的主要因素,严重制约了农业生产。了解植物应答各种非生物胁迫的机制,可以为人们改良植物抗逆性和培育植物新品种提供新思路。拟南芥是植物研究的重要模式植物,于2000年完成基因组测序。本研究以122条拟南芥ERF转录因子基因为研究对象,分析其在NaCl、ABA、PEG 3种非生物胁迫下的表达模式。为今后研究拟南芥ERF家族基因的功能提供参考。
1 材料与方法
1.1 拟南芥ERF家族基因筛选与系统进化
从植物转录因子数据库PlantTFDB 3.0中得到122条拟南芥ERF转录因子家族基因序列,用NCBI(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)提供的ORF查找器鉴定基因的开放阅读框。用MEGA5.0和neighbor-joining(NJ)方法[6]构建系统发育树。用ExPaSy提供的在线Protparam软件(http://web.expasy.org/protparam/)进行氨基酸数目、分子质量、理论等电点、脂肪族氨基酸数和蛋白质疏水性分析。
1.2 拟南芥培养与胁迫处理
拟南芥生态型为Columbia(Col-1)。拟南芥种子经4 ℃春化24 h后,均匀地播种于营养土中,7 d后移栽到花盆中。培养条件为:温度(22±2)℃,光照强度3.2×104lx,16 h光照/8 h黑暗,相对湿度65%~75%。30 d后将4组拟南芥分别施以ABA(100 μmol/L)、NaCl(150 mmol/L)、PEG(6000)(20%)和浇水(对照)处理,在0、6、12、24、36、48、72 h,7个时间点采集叶片置于液氮,然后放置于冰箱中-80 ℃保存,用于后续RNA提取及RT-qPCR分析。
1.3 RNA提取和RT-qPCR分析
用天泽基因柱式植物RNAout试剂盒提取RNA,用NanoDrop 1000(Thermo Scientific)分光光度计测定RNA浓度和质量。用PrimeScriptTMRT reagent Kit(TaKaRa)合成cDNA。用SYBR○RPremix Ex TaqTMП(TaKaRa)进行实时荧光定量PCR分析,3个技术和3个生物学重复。以ACTIN(JM986590)基因为内参设计引物(ACTF:5’-CCCAGTGTTGTTG GTAGGCCAAGAC-3’和ACTR:5’-CATAGCGGGAGAGTTAAAGGTCTC-3’)。根据拟南芥ERF基因序列设计各个基因特异性引物。用ABI 7500 Real-time PCR system(Applied Biosystems)进行定量PCR。反应总体积为20 μL,反应体系为:10 μL的SYBR Premix Ex TaqTM II(TaKaRa),0.4 μL的ROX Reference Dye II(TaKaRa),正向和反向引物各0.4 μmol/L,2 μL的cDNA模板(相当于20 ng的总RNA)。反应程序为:预变性95.0 ℃ 30 s,变性95.0 ℃ 5 s,退火/延伸60.0 ℃ 30 s,35个循环。从60~95 ℃的温度逐渐增加的过程中记录荧光值。根据△CT法计算基因相对表达水平[7-8]。
2 结果与分析
2.1 拟南芥应答盐胁迫ERF基因的筛选
RT-qPCR检测结果表明,122个拟南芥ERF转录因子家族基因在盐胁迫条件下,有36个(29.5%)基因上调表达,42个(34.4%)基因下调表达,44个(36.1%)基因表达无明显变化。其中,14个基因(11.48%)上调2~4倍,10个基因(8.20%)上调4~8倍,7个基因(5.74%)上调8~16倍,3个基因(2.46%)上调16~32倍,2个基因(1.64%)上调32倍。
从78个应答盐胁迫的拟南芥ERF基因中选出对盐胁迫高度敏感的基因,分别为F值在10倍以上的9个基因(AT1G21910、AT1G22985、AT1G43160、AT2G25820、AT2G38340、AT4G34410、AT5G05410、AT5G61890、AT5G64750)和F值在0.4倍以下的6个基因(AT1G06160、AT1G44830、AT1G49120、AT2G35700、AT4G17490、AT4G39780)。首先分析这15个盐胁迫敏感基因所编码蛋白的理化性质,发现这些蛋白的氨基酸数为159~391,分子质量为17.54~42.81 ku,等电点在4.86~9.62,脂肪系数为42.94~71.21,蛋白质的疏水性系数为-1.037~-0.439。用MEGA 5.2对这些蛋白的AP2/ERF结构域进行序列比对,发现所有蛋白均含有保守的AP2/ERF结构域(图1)。

图1 15个ERF转录因子基因多序列比对
2.2 ERF基因在不同胁迫下的表达模式
利用RT-qPCR分析15个盐敏感ERF基因在盐、干旱和ABA胁迫条件下的表达模式。发现15个ERF基因表达水平,总体上表现为对NaCl和ABA胁迫比较敏感,而对PEG胁迫的敏感性相对较低(图2)。在NaCl胁迫条件下,这些基因表达水平从胁迫6 h开始升高,分别在36和72 h出现2个峰值,这15个基因的表达水平表现出昼夜波动性较大的特点。在ABA胁迫条件下,这些基因表达水平先急剧升高达到峰值,然后在12~36 h逐渐降低,而后逐渐升高至72 h达到峰值。在PEG胁迫条件下,这些基因表达水平表现为升高趋势,但不同胁迫时间的差异不明显。
根据15个盐敏感ERF基因在0、6、12、24、36、48、72 h等7个时间点的表达水平绘制热图(图3),可以将15个基因划分为两组:低表达组和高表达组,低表达组包括AT1G43160、AT1G06160、AT1G49120、AT5G61890、AT5G64750、AT2G25820、AT1G44830、AT1G22985、AT2G38340等9个基因,高表达组包括AT1G21910、AT4G34410、AT4G39780、AT4G17490、AT5G05410、AT2G35700等6个基因。在干旱和ABA胁迫条件下低表达组与高表达组的基因组成有所变化,其高表达组中基因数量减少,PEG胁迫条件下高表达的基因数量最少。但AT1G21910和AT5G61890在3种胁迫条件下表达水平均较高。
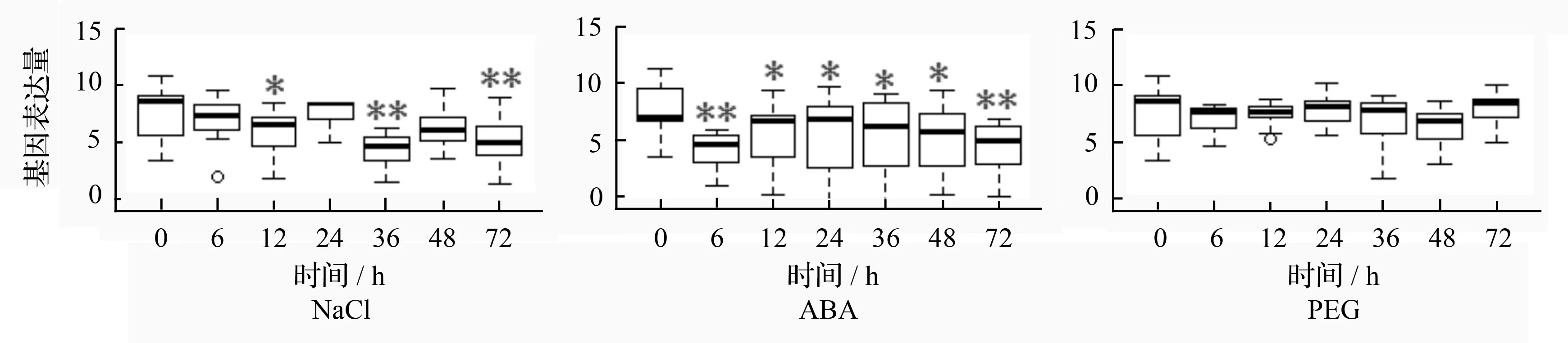
图2 15个ERF家族基因在不同胁迫条件下表达水平

图3 15个ERF家族基因在不同时间点的表达水平绘制热图
3 结论与讨论
植物生长在自然条件下,为适应和抵御各种逆境,进化出各种信号转导通路及胁迫响应途径。植物转录因子与顺式作用元件互作在植物响应逆境胁迫的过程中起着非常重要的作用[9-11]。在WRKY家族[12]、MYB家族[13]、bZIP家族[14-15]和ERF家族[16-17]等转录因子基因中包含许多逆境胁迫相关基因。ERF家族是植物中最大的转录因子家族,在响应环境胁迫和植物生长的过程中均起重要作用[18]。本研究分析122个拟南芥ERF转录因子基因应答盐胁迫情况,发现有78个基因应答盐胁迫,44个基因对盐胁迫无明显应答。其中,15个盐胁迫敏感ERF基因在NaCl胁迫条件下,基因表达水平随时间的延长均有明显的升高,并在36和72 h两个时间点达到极显著水平。植物ERF家族基因中甘蔗(SaccharumL.)SodERF3[19]、水稻(OryzasativaL.)OsEREBP1和OsEREBP2[20]、大麦(HordeumvulgareL.)HvRAF[21]、甘薯(DioscoreaesculentaBurkill)IbERF1和IbERF2[22]等对盐胁迫均有应答反应,过量表达胁迫相关ERF基因可提高了植物的耐盐性。但有些ERF基因虽已知能够响应盐胁迫,例如水稻ERF基因EsE1在盐胁迫下诱导表达,但其作用机制尚不明确[23]。
ABA信号通路包括信号转导和转录因子[24-25],ABA在植物发育过程和适应环境刺激中发挥关键作用。在ABA处理条件下,15个拟南芥ERF基因在6 h时表达量达到最大,而后逐渐降低,但相对于对照组仍然达到显著水平,在处理72 h时表达量又升高到极显著水平。基因在表达时间上的差异性可能与基因表达的途径及调控机制有关,在逆境胁迫条件下,通过调节ABA诱导基因,使其在合适的时间表达,有效提高植物的抗逆性。15个ERF基因中的大多数在ABA诱导下表达水平提高,表明这些基因可能参与ABA依赖型应激反应。
在干旱胁迫下,15个ERF基因表达模式相似,都是随时间延长有所升高,并在48 h达到最高。研究表明ERF转录因子家族能够增加植物的耐旱性,TSRF1蛋白通过调控增加效应基因的表达,增强水稻幼苗的渗透性和耐旱能力[26]。甘蔗的SodERF3蛋白,使烟草增强干旱胁迫耐受性[19]。在本研究中AT1G06160,AT1G21910,AT2G35700,AT4G17490,AT4G39780和AT5G61890等6个基因响应非生物胁迫的表达模式相似,表明其可能参与相同的基因表达调控网络。其他9个ERF家族基因在非生物胁迫下显示不同的表达模式,表明其可能参与不同的基因调控途径。
[1] NAKANO T, SUZUKI K, FUJIMURA T, et al. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiology,2006,140(2):411-432.
[2] SAKUMA Y, LIU Q, DUBOUZET J G, et al. DNA-binding specificity of the ERF/AP2 domain of arabidopsis DREBs, transcription factors involved in dehydration-and cold-inducible gene expression[J]. Biochemical & Biophysical Research Communications,2002,290(3):998-1009.
[3] YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought, low-temperature, or high-salt stress[J]. Plant Cell,2010,6(2):251-264.
[4] THOMASHOW M F. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Physiology & Plant Molecular Biology,1999,50(4):571-599.
[5] HAO D Y, OHME-TAKAGI M, SARAI A. Unique mode of GCC box recognition by the DNA-binding domain of ethylene-responsive element-binding factor (ERF domain) in plant[J]. Journal of Biological Chemistry,1998,273(41):26857-26861.
[6] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology & Evolution,2011,28(10):2731-2739.
[7] ANTONOV J, GOLDSTEIN D A, BALTZER A, et al. Reliable gene expression measurements from degraded RNA by quantitative real-time PCR depend on short amplicons and a proper normalization[J]. Laboratory Investigation,2005,85(8):1040-1050.
[8] PINELES B L, ROMERO R, MONTENEGRO D, et al. Distinct subsets of microRNAs are expressed differentially in the human placentas of patients with preeclampsia[J]. American Journal of Obstetrics & Gynecology,2007,196(3):1-6.
[9] DIETZ K J, VOGEL M O, VIEHHAUSER A. AP2/EREBP transcription factors are part of gene regulatory networks and integrate metabolic, hormonal and environmental signals in stress acclimation and retrograde signalling[J]. Protoplasma,2010,245(1/2/3/4):3-14.
[10] SHINOZAKI K, YAMAGUCHI-SHINOZAKI K, SEKI M. Regulatory network of gene expression in the drought and cold stress responses[J]. Current Opinion in Plant Biology,2003,6(5):410-417.
[11] ZHANG H W, HUANG Z J, XIE B Y, et al. The ethylene-, jasmonate-, abscisic acid-and NaCl-responsive tomato transcription factor JERF1 modulates expression of GCC box-containing genes and salt tolerance in tobacco[J]. Planta,2005,220(2):262-270.
[12] ZHOU Q Y, TIAN A G, ZOU H F, et al. Soybean WRKY-type transcription factor genes, GmWRKY13, GmWRKY21, and GmWRKY54, confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants[J]. Plant Biotechnology Journal,2008,6(5):486-503.
[13] HIROSHT A, URAO T, ITO T, et al. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB) function as transcriptional activators in abscisic acid signaling[J]. Plant Cell,2003,15(1):63-78.
[14] HOBO T, KOWYAMA Y, HATTORI T. A bZIP factor, TRAB1, interacts with VP1 and mediates abscisic acid-induced transcription[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(26):15348-15353.
[15] KANG J Y, CHOI H I, IM M Y, et al. Arabidopsis basic leucine zipper proteins that mediate stress-responsive abscisic acid signaling[J]. Plant Cell,2002,14(14):343-357.
[16] CHAKRAVARTHY S, TUORI R P, D’ASCENZO M D, et al. The tomato transcription factor Pti4 regulates defense-related gene expression via GCC box and non-GCC box cis elements[J]. Plant Cell,2004,15(12):3033-3050.
[17] KIZIS D, LUMBRERAS V, PAGS M. Role of AP2/EREBP transcription factors in gene regulation during abiotic stress[J]. FEBS Letters,2001,498(2/3):187-189.
[18] RIECHMAN J L, HEARD J, MARTIN G, et al. Arabidopsis transcription factors: genome-wide comparative analysis among eukaryotes[J]. Science,2000,290:2105-2110.
[19] TRUJILLO L E, SOTOLONGO M, MENÉNDEZ C, et al. SodERF3, a novel sugarcane ethylene responsive factor (ERF), enhances salt and drought tolerance when overexpressed in tobacco plants[J]. Plant & Cell Physiology,2008,49(4):512-525.
[20] SERRA T S, FIGUEIREDO D D, CORDEIRO A M, et al. OsRMC, a negative regulator of salt stress response in rice, is regulated by two AP2/ERF transcription factors[J]. Plant Molecular Biology,2013,82(4/5):439-455.
[21] JUNG J, WON S Y, SUH S C, et al. The barley ERF-type transcription factor HvRAF confers enhanced pathogen resistance and salt tolerance in Arabidopsis[J]. Planta,2007,225(3):575-588.
[22] KIM Y H, JEONG J C, PARK S, et al. Molecular characterization of two ethylene response factor genes in sweetpotato that respond to stress and activate the expression of defense genes in tobacco leaves[J]. Journal of Plant Physiology,2012,169(11):1112-1120.
[23] ZHANG L, LI Z, QUAN R, et al. An AP2 domain-containing gene, ESE1, targeted by the ethylene signaling component EIN3 is important for the salt response in Arabidopsis[J]. Plant Physiology,2011,157(2):854-865.
[24] FINKELSTEIN R R, GAMPALA S S, ROCK C D. Abscisic acid signaling in seeds and seedlings[J]. Plant Cell,2002,14(Suppl):15-45.
[25] HIMMELBACH A, YANG Y, GRILL E. Relay and control of abscisic acid signaling[J]. Current Opinion in Plant Biology,2003,6(5):470-479.
[26] QUAN R, HU S, ZHANG Z, et al. Overexpression of an ERF transcription factor TSRF1 improves rice drought tolerance[J]. Plant Biotechnology Journal,2010,8(4):476-488.
Expression Pattern ofERFGene Family fromArabidopsisthalianain Response to Abiotic Stress//
Zhao Jinling, Yao Wenjing, Jiang Tingbo, Zhou Boru(State Key Laboratory of Tree Genetics and Breeding, Northeast Forestry University, Harbin 150040, P. R. China)//
Journal of Northeast Forestry University,2016,44(10):41-44.
The expression of 122 ArabidopsisERFtranscription factor genes under salt stress were detected by RT-qPCR, and the expression patterns of 15 salt-sensitive genes under salt, drought and ABA stress were analyzed. Under salt stress, 36 genes were up-regulated, 42 genes were down-regulated, and 44 genes had no significant change. Among them, 15 salt-sensitive genes showed different expression patterns under different abiotic stress. Under salt stress, the expression level of 15ERFgenes with the increasing of stress time was significantly increased, reaching a significant level at 36 h and 72 h. Under the ABA stress, expression level in most of 15ERFgene was increased. Under drought stress, expression levels of 15 ERF gene were increased with the stress time prolonged, reaching the highest point at 48 h.AT1G06160,AT1G21910,AT2G35700,AT4G17490,AT4G39780 andAT5G61890 genes were with the similar expression patterns under abiotic stresses, indicating that it may be involved in similar gene regulation pathways. The other 9ERFgenes under abiotic stress showed different expression patterns, indicating that it may be involved in different pathways of gene regulation.
Arabidopsisthaliana;ERFgene family; Gene expression; Abiotic stress
赵金玲,女,1989年11月生,林木遗传育种国家重点实验室(东北林业大学),硕士研究生。E-mail:zhaojinling0943@163.com。
周博如,林木遗传育种国家重点实验室(东北林业大学),副教授。E-mail:boruzhou@yahoo.com。
2016年3月7日。
Q78;S332.1
1)卓越农林人才教育培养计划改革试点项目;国家“863”课题(2013AA102701)。
责任编辑:潘 华。
