青枯雷尔氏菌特征菌株高效离子交换色谱快速分离条件的优化
2016-11-17郑雪芳朱育菁陈德局
郑雪芳, 刘 波, 朱育菁, 陈德局
(福建省农业科学院农业生物资源研究所, 福建 福州 350003)
研究论文
青枯雷尔氏菌特征菌株高效离子交换色谱快速分离条件的优化
郑雪芳, 刘 波*, 朱育菁, 陈德局
(福建省农业科学院农业生物资源研究所, 福建 福州 350003)
建立了高效离子交换色谱和紫外检测系统快速分离青枯雷尔氏菌的细菌色谱方法。通过比较青枯雷尔氏菌悬浮在哌嗪-HCl缓冲体系和双蒸水后的菌体数变化及细胞形态变化,分析该缓冲液对青枯雷尔氏菌生长活性及细胞表面特性的影响。结果表明,青枯雷尔氏菌悬浮在平衡缓冲液、洗脱缓冲液和双蒸水中的菌体数量无明显差异,分别为6.467×109、6.267×109和6.233×109cfu/mL。透射电镜观察发现,3种溶液处理后,青枯雷尔氏菌均保持完整的细胞结构。研究了缓冲液pH值、流速及菌体细胞浓度对青枯雷尔氏菌色谱分离效果的影响,确定青枯雷尔氏菌的最佳色谱分离条件为:缓冲液pH值为8.0,流速为2 mL/min,菌体浓度大于1.0×108cfu/mL且小于1.0×1010cfu/mL。该分离条件缩短了分离时间,提高了分离效率,为快速分离青枯雷尔氏菌提供了一种有效的手段,同时也为细菌等微生物的分离提供了新途径。
高效离子交换色谱;分离;青枯雷尔氏菌;细胞表面特性
由青枯雷尔氏菌(Ralstoniasolanacearum)引起的植物青枯病是一种毁灭性土传病害,主要发生在热带和亚热带地区[1]。青枯雷尔氏菌寄主范围广,可侵染54个科450多种植物[2]。危害较重、分布较广的寄主有番茄、茄子、辣椒、马铃薯、花生、生姜等,近年又陆续报道在桑树、桉树、木麻黄等木本植物及大豆、南瓜、三叶草等草本植物上也发现了青枯病[3]。青枯病是危害最大、分布最广、造成损失最重的植物病害之一,一般田块发病率为25%~30%,严重时可达80%~100%[4]。随着全球气候变暖,在世界范围内,青枯病发生危害呈现出越来越重的趋势。
青枯雷尔氏菌是极易变异的细菌,自然状态下的致病力分化严重[5],其原因是存在不同致病力菌株混杂的现象[6],经继代培养和回接植株经常会出现菌株致病力分化现象[7],以往研究者认为这是青枯雷尔氏菌变异性高、致病性不稳定的原因。传统的平板划线、稀释培养、毛细管电泳等分离、纯化方法很难获得高纯度的青枯雷尔氏菌[8]。根据青枯雷尔氏菌菌体小((0.5~0.8) μm×(1.3~2.2) μm)的特性及其单细胞表面化学组成和所带电荷的不同,以强阴离子交换树脂SuperQ-650C(粒径50~100 μm)为介质,可以对不同致病力的青枯雷尔氏菌进行色谱分离,很好地解决了培养基无法有效分离、纯化的问题[9]。由于该色谱体系分离到的各组分不是化合物而是青枯雷尔氏菌活细胞,因此简称为细菌色谱[10,11]。以往的研究表明,用细菌色谱分离一株细菌约需要1 h。陈昭华等[12]利用离子交换色谱分离、表征对数期金黄色葡萄球菌的色谱行为,整个洗脱过程需要60 min;林娟等[13]以及林营志[14]应用高效离子交换色谱分离一株青枯雷尔氏菌需55 min;余谦[10]和Zheng等[11]对不同致病力青枯雷尔氏菌的色谱分离仍需55 min,未解决分离效率问题。尽管以往的研究解决了细菌的色谱分离,但是效率很低,影响了该方法的有效应用。本研究旨在优化高效离子交换色谱分离条件,提高分离效率。
在一定的条件下,细菌在宏观上是一个带电的颗粒,细菌表面带有羧基、磷酸基和氨基等较大的基团,在不同的pH条件下会发生电离,从而使细菌表面带上不同的电荷[15],与离子交换树脂的吸附能力也不同,因此可以通过高效离子交换色谱进行分离、纯化[13]。20世纪70年代,Daniels[16]利用强阴离子交换色谱、Marquis等[17]利用阳离子交换色谱柱实现了对不同细菌的分离。但由于受到条件的局限,当时对细菌的分离、纯化使用的是常压色谱柱,不但分离时间过长,而且极易染菌。近些年来,随着色谱技术和各种新型分离材料的开发,为应用色谱技术分离细菌提供了可能,如谢俊斌[18]使用高效液相色谱对活的细菌进行了分离,成功地对木糖氧化无色杆菌、普通大肠杆菌、短小芽孢杆菌等不同属的细菌进行了色谱分离。本课题组[11]在前期研究中,利用高效离子交换色谱快速分离了青枯雷尔氏菌的强致病力和无致病力菌株,并对一株强致病力菌株FJAT-1925和一株无致病力菌株FJAT-1957进行了色谱纯化。
青枯雷尔氏菌的高效离子交换色谱分离效果受多种因素的影响,主要有:(1)细菌自身表面活性。细菌表面所带电荷决定其与树脂之间的吸附能力,同时细菌的形态和大小也影响其分离效果[13]; (2)缓冲液的pH值。缓冲液的pH值决定了细菌细胞表面带电物质电离的程度,缓冲液的pH值离细菌的等电点越近,细菌细胞表面所带的电荷就越少,与树脂的吸附能力就越小,反之就越大[15]; (3)流速。流速既不能太大也不能太小,流速太小,分析时间长,影响分离效果;流速太大,影响色谱柱的使用寿命[19]; (4)细菌浓度。在色谱柱饱和的吸附范围内,菌体细胞样本不同浓度对特征峰的峰高、峰宽以及峰面积有一定的影响[10]。
本研究以青枯雷尔氏菌强致病力菌株FJAT-91为试验材料,研究了缓冲液对青枯雷尔氏菌细胞表面特性的影响,分析了缓冲液pH值、流速和菌体浓度对青枯雷尔氏菌色谱分离效果的影响,建立了青枯雷尔氏菌色谱分离的最优化条件。
1 实验部分
1.1 仪器及材料
高效液相色谱仪(Agilent HPLC 1100,美国Agilent公司)、紫外-可见分光光度计(UV-2550,日本岛津公司)、高速冷冻离心机(Eppendorf 5418R,德国Eppendorf公司)、超净工作台(SW-CJ-1F,苏州安泰空气技术有限公司)、恒温培养箱(BI-250AG,施都凯仪器设备有限公司)、透射电镜(HT7700,日本日立公司)。
青枯雷尔氏菌强致病力菌株FJAT-91分离自番茄青枯病病株,由福建省农业科学院农业生物资源研究所菌种库收集并保存。青枯雷尔氏菌鉴别培养基为2,3,5-氯化三苯基四氮唑(TTC)培养基,成分为:1%(质量分数,下同)蛋白胨、0.1%水解酪蛋白、0.5%葡萄糖、1.8%琼脂和0.05% 2,3,5-氯化三苯基四氮唑;液体培养基为SP (sucrose peptone)培养基,成分为2%蔗糖、0.5%蛋白胨、0.05% KH2PO4和0.002 5% MgSO4。青枯雷尔氏菌高效离子交换色谱分离所需平衡缓冲液(A液): 0.02 mol/L哌嗪-HCl;洗脱缓冲液(B液): 0.02 mol/L哌嗪-HCl+1 mol/L NaCl。
1.2 实验方法
1.2.1 细菌培养及样品制备
青枯雷尔氏菌FJAT-91经TTC培养基活化后,转接于SP液体培养基中,于30 ℃以170 r/min的速度在摇床上培养24 h,吸取1 mL菌液,以10 000 r/min的转速离心2 min,沉淀物分别悬浮于A液、B液和双蒸水中,重复试验3次,4 h后将不同溶液悬浮的青枯雷尔氏菌经系列梯度稀释,涂布于TTC平板上,置于30 ℃的恒温箱中培养48 h,观察菌落形态,统计菌落个数,利用DPS软件进行数据方差分析。
另外,分别取2 μL不同溶液悬浮的青枯雷尔氏菌样本至铜网,静置2 min,滤纸吸干,滴适量2%磷钨酸染色30 s,自然晾干,于透射电镜下观察菌体形态并拍照。
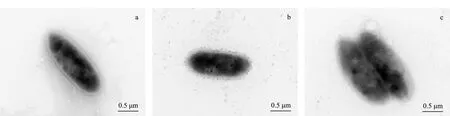
图 1 青枯雷尔氏菌FJAT-91在平衡缓冲液、洗脱缓冲液及双蒸水中悬浮4 h后的菌体形态Fig. 1 Cell morphologies of Ralstonia solanacearum strain FJAT-91 suspended in (a) balance buffer, (b) elution buffer and (c) double distilled water for 4 h Balance buffer: 0.02 mol/L piperazine-hydrochloric acid, elution buffer: 0.02 mol/L piperazine-hydrochloric acid+1 mol/L NaCl.
1.2.2 色谱条件
按1.2.1节方法所述,将培养好的菌液以8 000 r/min的转速离心10 min,沉淀物用双蒸水洗涤2次后加200 μL双蒸水溶解,于4 ℃冰箱保存备用。
在本试验中,需要从色谱系统中收集分离表征后的菌体做进一步培养,要保证整个色谱系统无菌,因此在进样之前,整个色谱系统先用75%(体积分数)的酒精冲洗15 min,然后用无菌水冲洗15 min,最后用无菌的缓冲液平衡整个色谱系统。所有器皿都需经过高温高压灭菌处理,缓冲液用双蒸水配制,使用前用0.22 μm的醋酸纤维素膜过滤。上样样品的前处理也严格按照无菌操作进行,以保证整个分离表征过程处于严格的无杂菌环境。
色谱填充材料采用的是强阴离子交换树脂,色谱柱规格为200 mm×4.6 mm,流速为2 mL/min,柱温为23~28 ℃。色谱分离方法:样品上样后,在0~3 min时,用A液进行平衡,使进样的青枯雷尔氏菌充分吸附到强阴离子交换树脂上;在3~8 min时,进行线性梯度洗脱,洗脱梯度为0~75%的B液;在8~12 min时,完全转换为洗脱缓冲液,以达到洗出吸附在树脂上的残余青枯雷尔氏菌的目的;在12~15 min时,转换为平衡缓冲液以平衡系统,从而为下一次的试验做准备。采用紫外检测器进行检测,检测波长为260 nm。
2 结果与讨论
2.1 缓冲液对青枯雷尔氏菌活性的影响
利用高效离子交换色谱对青枯雷尔氏菌进行分离时,如何保持细菌细胞表面的原有特性不受平衡缓冲液和洗脱缓冲液的影响是研究的关键。Armstrong等[20]报道,在毛细管电泳分析细菌的研究中采用双蒸水洗涤和悬浮细菌,不会对细菌的色谱行为造成影响。林娟等[13]的研究表明,高效离子交换色谱分析中采用平衡缓冲液哌嗪-HCL作为缓冲体系对青枯菌的生理活性无明显的副作用。本研究比较了A液、B液以及双蒸水对青枯雷尔氏菌FJAT-91活性的影响,结果表明,青枯雷尔氏菌FJAT-91在A液、B液和双蒸水中悬浮4 h后,菌体个数分别为6.467×109、6.267×109和6.233×109cfu/mL,差异不显著。此外透射电镜观察发现,A液和B液不会破坏菌株FJAT-91的菌体细胞,细胞结构完整、无破裂(见图1)。上述结果表明,本研究选用的色谱平衡缓冲液(0.02 mol/L哌嗪-HCL)和洗脱缓冲液(0.02 mol/L哌嗪-HCl+1 mol/L NaCl)体系对青枯雷尔氏菌的细胞活性没有明显的影响。
2.2 缓冲液pH值对色谱分离效果的影响
将高效离子交换色谱平衡缓冲液和洗脱缓冲液的pH值均设为5.0、6.0、7.0、8.0、9.0和10.0,考察缓冲液pH值对色谱分离的影响,试验重复3次。青枯雷尔氏菌FJAT-91在不同pH值缓冲液中的色谱分离效果不同。如表1和图2所示,青枯雷尔氏菌FJAT-91经高效离子交换色谱分离主峰的出峰时间为6 min左右。在pH值为5.0、6.0、7.0和8.0的缓冲液中,青枯雷尔氏菌FJAT-91均只出现单一色谱峰;在pH值为9.0的缓冲液中,青枯雷尔氏菌FJAT-91分别在6.02和8.05 min出现两个色谱峰;在pH值为10.0的缓冲液中,青枯雷尔氏菌FJAT-91分别在0.59、6.04和7.89 min出现3个色谱峰。在pH值为8.0的缓冲液中,青枯雷尔氏菌FJAT-91的色谱峰高及峰面积均最大,峰形较好,且此pH值与青枯雷尔氏菌的最适生长pH值7.5较接近。张洋等[21]的研究结果表明,缓冲液的pH值离细菌的等电点越近,细菌细胞表面所带的电荷就越少,与树脂的吸附能力就越小,反之就越大。故本研究选择青枯雷尔氏菌的高效离子交换色谱分离缓冲液pH值为8.0。
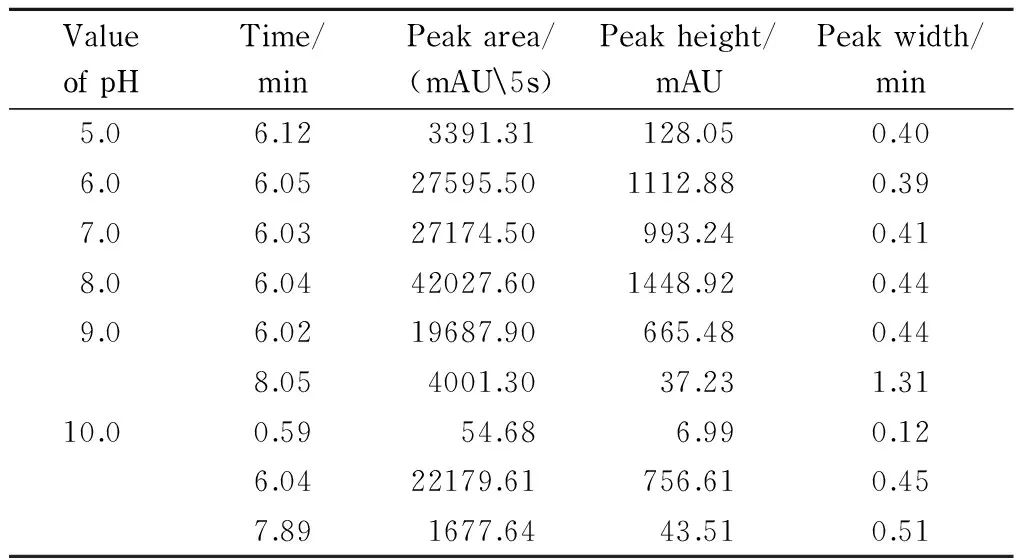
表 1 不同缓冲液pH条件下青枯雷尔氏菌FJAT-91的色谱峰行为
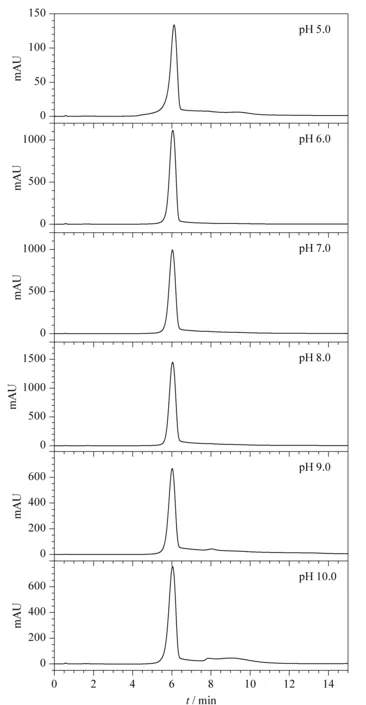
图 2 不同缓冲液pH条件下青枯雷尔氏菌FJAT-91的高效离子交换色谱图Fig. 2 High performance ion-exchange chromatograms of Ralstonia solanacearum strain FJAT-91 with different pH buffers
2.3 流速对色谱分离效果的影响
张国城[22]报道浓度型检测器(如热导池检测器、电子捕获检测器、液相色谱法中的紫外-可见光检测器等)在进样量一定时,积分响应值(峰面积)与流速成反比,而瞬间响应值(峰高)也受流速影响,但非成比例变化。本研究考察了流速为0.5、1.0、2.0、3.0、4.0、5.0 mL/min时对色谱分离的影响。在不同流速下,青枯雷尔氏菌FJAT-91的出峰时间、峰面积、峰高等均不同。结果如表2和图3所示,流速越快,主峰的出峰时间越早;而峰面积和峰高随流速增大而减小,如与流速为0.5 mL/min相比,流速在5 mL/min时,主峰出峰时间为4.96 min,提早了6.14 min,峰面积减少了85.81%,峰高减少了83.49%。流速为1、2和3 mL/min时,青枯雷尔氏菌FJAT-91均分离出单一峰,其中流速为2 mL/min时的出峰时间比流速为1 mL/min时提早了1.68 min,而比流速为3 mL/min时推迟0.57 min。由于流速过快会影响色谱柱的使用寿命,流速低会影响试验效率,综合上述研究结果,将青枯雷尔氏菌FJAT-91色谱分离的流速确定为2 mL/min。
2.4 菌体浓度对色谱分离效果的影响
为考察菌体浓度对色谱分离的影响,设置青枯雷尔氏菌FJAT-91的菌体浓度为1.0×107、1.0×108、1.0×109和1.0×1010cfu/mL。不同菌体浓度下,青枯雷尔氏菌菌株FJAT-91的分离效果不同,峰高和峰面积不同,如表3和图4所示。菌体浓度越高,色谱峰的峰高越高,峰面积也越大;菌体浓度低,色谱分离效果不好,会出现特征峰外的其他色谱峰,如菌体浓度为1.0×107cfu/mL时,分离出两个色谱峰,且峰面积和峰高均最小;而菌体浓度太大(超过1.0×1010cfu/mL)会堵塞色谱柱,因此菌体浓度应大于1.0×108且小于1.0×1010cfu/mL。峰面积(y)与菌体浓度(x, cfu/mL)为幂指数关系,方程为y=23.025x0.292(R2=0.965),其相关范围为1.0×108~1.0×1010cfu/mL。
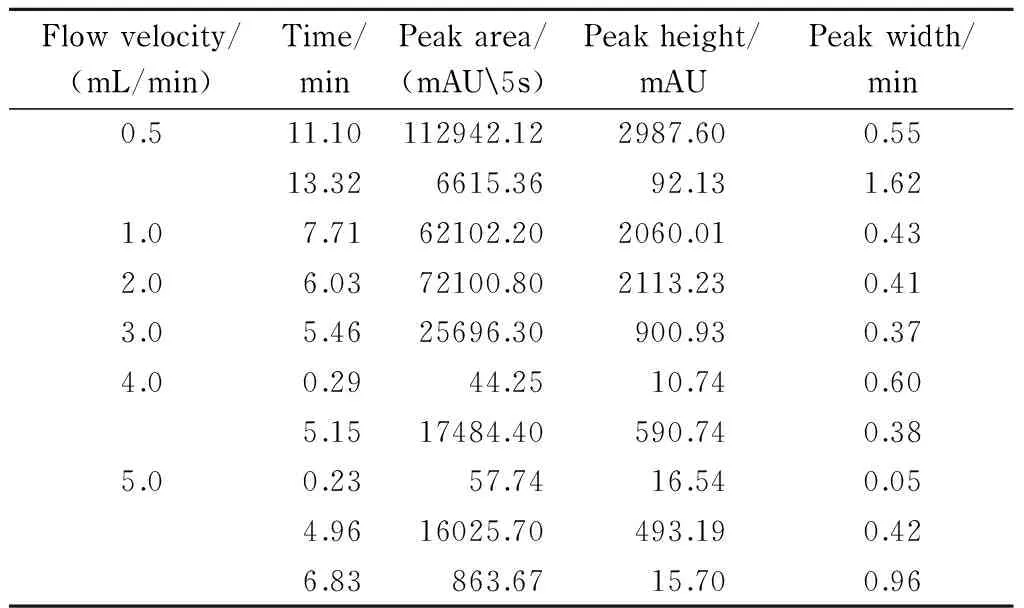
表 2 不同流速下青枯雷尔氏菌FJAT-91的色谱峰行为
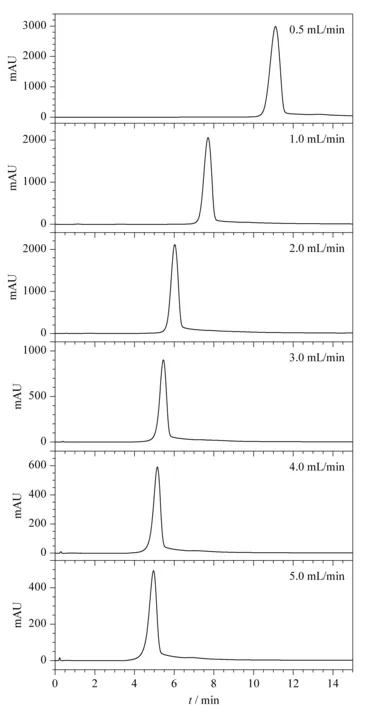
图 3 不同流速下青枯雷尔氏菌FJAT-91的高效离子交换色谱图Fig. 3 High performance ion-exchange chromatograms of Ralstonia solanacearum strain FJAT-91 with different flow velocities
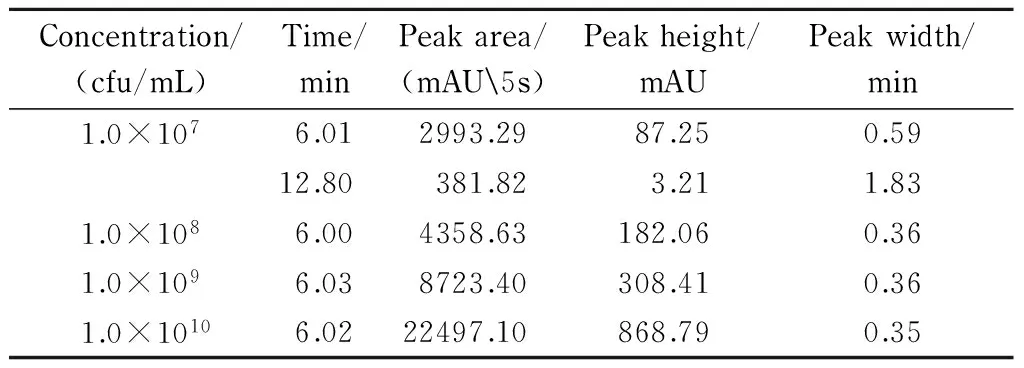
表 3 不同菌体浓度条件下青枯雷尔氏菌FJAT-91的色谱行为
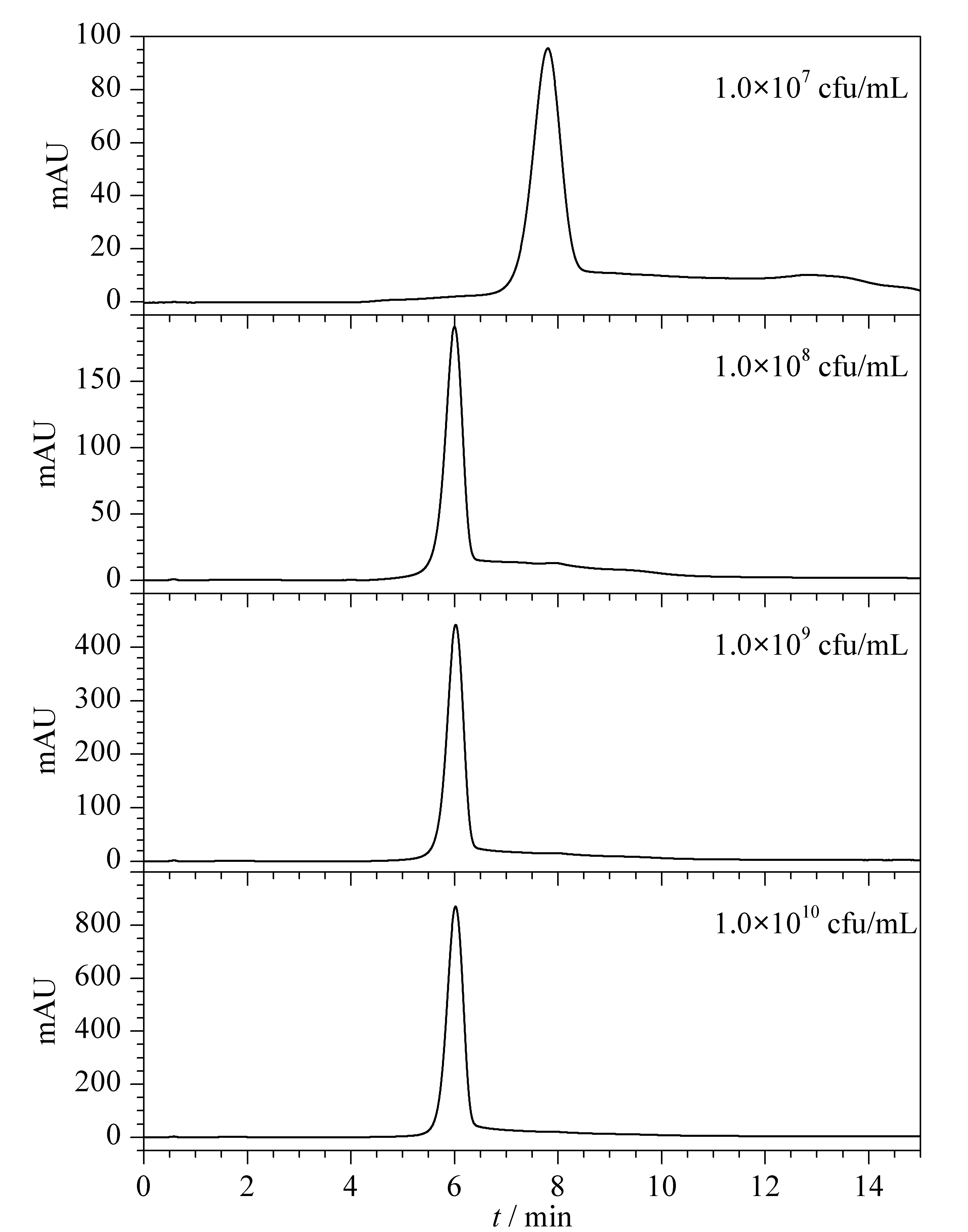
图 4 不同菌体浓度的青枯雷尔氏菌FJAT-91的高效离子交换色谱图Fig. 4 High performance ion-exchange chromatograms of Ralstonia solanacearum strain FJAT-91 with different bacterial concentrations
3 结论
本研究优化了青枯雷尔氏菌的高效离子交换色谱分离条件,确定最佳分离条件为:缓冲液pH值为8.0,流速为2 mL/min,菌体浓度要大于108cfu/mL且小于1011cfu/mL。该分离条件缩短了反应时间,提高了反应效率,为快速分离青枯雷尔氏菌提供一种有效的手段,同时也为细菌等微生物的分离提供了一个新途径。
[1] Peeters N, Guidot A, Vailleau F, et al. Mol Plant Pathol, 2013, 14(7): 651
[2] Mansfield J, Genin S, Magori S, et al. Mol Plant Pathol, 2012, 13(6): 614
[3] Chandrasekaran M, Subramanian D, Yoon E, et al. Plant Pathol J, 2016, 32(3): 216
[4] Yuliar, Nion Y A, Toyota K. Microbes Environ, 2015, 30(1): 1
[5] Suga Y, Horita M, Umekita M, et al. J Gen Plant Pathol, 2013, 79: 110
[6] Lin J, Xie F Y, Liu S T, et al. Chinese Journal of Applied and Environmental Biology, 2011, 17(4): 548
林娟, 谢范英, 刘树滔, 等. 应用与环境生物学报, 2011, 17(4): 548
[7] Zhang C L, Hua J Y, Wang D, et al. Plant Protection, 1993(1): 39
张长龄, 华静月, 王东, 等. 植物保护, 1993(1): 39
[8] Rahman M M, Ali M E, Khan A A, et al. Sci World J, 2012, 2012: 1
[9] Lin J, Liu S T, Gao Z N, et al. Chinese Journal of Applied and Environmental Biology, 2009, 15(5): 713
林娟, 刘树滔, 高珍娜, 等. 应用与环境生物学报, 2009, 15(5): 713
[10] Yu Q. [MS Dissertation]. Fuzhou: Fuzhou University, 2013
余谦. [硕士论文]. 福州: 福州大学, 2013
[11] Zheng X F, Zhu Y J, Liu B, et al. Microb Pathog, 2016, 90: 84
[12] Chen Z H, Liu S T, Xue W P, et al. Chinese Journal of Chromatography, 2004, 22(3): 234
陈昭华, 刘树滔, 薛伟苹, 等. 色谱, 2004, 22(3): 234
[13] Lin J, Ma C, Liu S T, et al. China Biotechnology, 2006, 26(5): 63
林娟, 马骋, 刘树滔, 等. 中国生物工程杂志, 2006, 26(5): 63
[14] Lin Y Z. [PhD Dissertation]. Fuzhou: Fujian Agriculture and Forest University, 2003
林营志. [博士论文]. 福州: 福建农林大学, 2003
[15] Chen P, Li R K, Xu X H, et al. Chinese Journal of Chromatography, 2002, 20(5): 439
陈萍, 李仁宽, 徐小华, 等. 色谱. 2002, 20(5): 439
[16] Daniels S L. Dev Ind Microb, 1972, 13: 211
[17] Marquis R E, Mayzel K, Carstensen E L. Can J Microb, 1976, 22 (7): 975
[18] Xie J B. [MS Dissertation]. Fuzhou: Fuzhou University, 2000
谢俊斌. [硕士论文]. 福州: 福州大学, 2000
[19] Hou Y W, Mou S F, Hou X P, et al. Chinese Journal of Chromatography, 1998, 16(4): 347
侯艳文, 牟世芬, 侯小平, 等. 色谱, 1998, 16(4): 347
[20] Armstrong D W, Schulte G, Schneiderheinze J M, et al. Anal Chem, 1999, 71(24): 5465
[21] Zhang Y, Wen T, Lin J, et al. Chinese Journal of Chromatography, 2005, 23(4): 418
张洋, 温腾, 林娟, 等. 色谱, 2005, 23(4): 418
[22] Zhang G C. China Metrology, 2010(5): 77
张国城. 中国计量, 2010(5): 77
Chinese Special Fund for Agro-Scientific Research in the Public Interest (No. 201303015); Fujian Provincial Natural Science Foundation of China (No. 2015J01103); Fujian Provincial Special Fund for Non-profit Institutions (No. 2014R1018-8).
Optimization of rapid separation conditions ofRalstoniasolanacearumusing high performance ion-exchange chromatography
ZHENG Xuefang, LIU Bo*, ZHU Yujing, CHEN Deju
(Agricultural Bio-Resources Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China)
Rapid separation ofRalstoniasolanacearumwith intact cell using high performance ion-exchange chromatography equipped with a UV detector was described. The bacterial growth abilities and cell morphologies in different suspension buffers were compared. The results showed that the bacterial numbers in the balance buffer (0.02 mol/L piperazine-hydrochloric acid), elution buffer (0.02 mol/L piperazine-hydrochloric acid+1 mol/L NaCl) and double distilled water were 6.467×109, 6.267×109and 6.233×109cfu/mL, respectively, exhibiting no significant difference. Moreover, the cell morphologies were observed under a transmission electron microscope which showed that the bacterial cells could remain intact. Effects of buffer pH, flow velocity and bacterial cell concentration on the separation efficiency were analyzed. The results showed that the optimum chromatographic separation parameters were as follows: the buffer pH was 8, the flow velocity was 2 mL/min and the bacterial cell concentration was from 1.0×108cfu/mL to 1.0×1010cfu/mL. Under the chromatographic separation conditions, the separation time was shortened and the separation efficiency was improved. Therefore, the chromatographic method developed here may be a promising tool for the rapid separation ofRalstoniasolanacearumand other bacteria.
high performance ion-exchange chromatography; separation;Ralstoniasolanacearum; cell surface properties
10.3724/SP.J.1123.2016.06044
2016-06-27
国家公益性行业(农业)科研专项基金(201303015);福建省自然科学基金(2015J01103);福建省公益类科研院所专项基金(2014R1018-8).
O658
A
1000-8713(2016)11-1091-06
* 通讯联系人.E-mail:fzliubo@163.com.
