山慈菇多糖对H22肝癌小鼠IL-2及p53蛋白表达的影响
2016-11-15徐小娟周志涵毛宇徐芳李杰贺建华
徐小娟,周志涵,毛宇,徐芳,李杰,贺建华
(1.湖南省医药技工学校,湖南长沙410128;2.湖南农业大学食品科学技术学院,湖南长沙410128;3.湖南农业大学动物科学技术学院,湖南长沙410128)
山慈菇多糖对H22肝癌小鼠IL-2及p53蛋白表达的影响
徐小娟1,2,周志涵1,毛宇2,徐芳2,李杰2,贺建华3,*
(1.湖南省医药技工学校,湖南长沙410128;2.湖南农业大学食品科学技术学院,湖南长沙410128;3.湖南农业大学动物科学技术学院,湖南长沙410128)
研究山慈菇多糖对H22的体内抑制作用及其机制。建立小鼠H22腹水瘤和实体瘤模型观察山慈菇多糖的抑瘤作用,Elisa检测实体瘤小鼠外周血IL-2水平,HE染色法观察小鼠肿瘤组织的细胞形态,SABC免疫组化法检测p53蛋白表达情况。能改善腹水瘤小鼠的生存状态和延长生存天数,延长率为21.4%。实体瘤小鼠低、中、高剂量组抑瘤率分别为21.58%、32.76%、40.05%,IL-2的中高剂量组相对模型组都具有极显著性(P<0.01),增强了p53蛋白的表达水平。山慈菇多糖延长了腹水瘤小鼠生存时间,解剖观察可能是减少小鼠体内炎症反应;实体瘤小鼠此次试验中呈现了一定的剂量依赖性,其机制可能与提高小鼠IL-2含量从而提高小鼠免疫力有关,p53随着肿瘤细胞分化程度下降而表达增加。
山慈菇多糖;小鼠肝癌H22;抗肿瘤;IL-2;p53
多糖是一类由单糖聚合而成的多聚糖,目前,已经发现多种多糖具有抗癌、抗氧化、抗衰老、降低血糖和提高免疫力等作用[1]。“山慈菇”的原植物是来源于杜鹃兰Cremastra appendiculata(D.Don)Makino[2],其始见于《本草拾遗》[3],为中国药典3收载的少常用中药,在民间常与其它中药配伍被用作抗肿瘤药物。本实验的山慈菇为兰科植物独蒜兰云南独蒜兰Pleione yunnanensis Rolfe Polysaccharides的干燥假鳞茎,习称“冰球子”假鳞茎入药,称“山慈菇”或“毛慈菇”,药材又称毛慈菇,其味甘、微辛、寒、归肝、脾经,具有清热解毒、消痈散结的功效,中医临床上常用于治疗淋巴结核,乳腺癌、食管癌、胃癌等恶性肿瘤,以及蛇、虫、狂犬咬伤[4],降压[5]。代芳应用补益理气药配伍山慈菇,治疗甲状腺腺瘤,肿块明显缩小[6],以山慈菇配伍他药治疗原发性肝癌,能解毒散结,延长患者生命[7]。肝细胞肝癌(hepatocellular carcinoma,HCC)(简称肝癌)是全球最常见的恶性肿瘤之一,死亡率在消化系统恶性肿瘤中列第三位[8]。目前治疗肝癌仍以手术及化疗为主,但化疗易引起的肝肾毒性等不良反应。本实验选用小鼠肝癌H22细胞是最常用的小鼠可移植性肿瘤细胞系之一,广泛应用于小鼠肿瘤动物模型的复制。山慈菇多糖抗肿瘤的机制极少报道,因此我们对山慈菇多糖诱导鼠源性H22肝癌细胞凋亡的抗肿瘤机制作一研究。
1 方法
1.1H22细胞的培育
将细胞浓度调整至1×106,反复吹打制成细胞悬液。取0.2mLH22细胞悬液注射至小鼠腹腔,8天后腹水小鼠腹部似母鼠,精神状态、毛色、进食稍差。为避免出现血性腹水,在第8天将小鼠颈椎脱臼处死,浸至75%乙醇,滤干于超净工作台使用一次性5mL注射器斜扎入腹腔将腹水取出,转存至已灭菌的15mL离心管,腹水为乳白色,如颜色偏红,应弃之。将腹水1 200 r/min离心5min,弃上清,将细胞加0.9%生理盐水按1∶3(体积比)稀释,于倒置显微镜下计数,0.9%生理盐水调整细胞浓度至1×106,用移液枪反复吹打、水平振摇成细胞悬液。
1.2多糖溶液的配置
山慈菇多糖(Pleione yunnanensis Rolfe polysaccharides,PYRP)纯度为80%:购于陕西斯诺特生物技术有限公司。山慈菇多糖,根据各组剂量,置10mL离心管中用0.9%生理盐水配置成溶液,灌胃小鼠后放于冰箱4℃冷藏,考虑药效,隔日重新配置新鲜山慈菇多糖溶液。
1.3动物模型建立
1.3.1实体瘤模型建立
昆明雌性小鼠60只,喂养3 d适应环境,约22 g~25 g,每只小鼠右腋窝下以75%乙醇消毒,皮下注射H22肝癌细胞1×106悬液0.2mL,接种后出现米粒大小的皮丘为接种成功。
1.3.2腹水瘤肝癌模型建立
将30只22g~25g昆明小鼠,每只小鼠腹腔以75%乙醇消毒,注射H22肝癌细胞1×106悬液0.2mL。腹水型肝癌H22小鼠分组及剂量:昆明雌性小鼠30只,喂养3 d适应环境。
1.4分组及剂量
1.4.1实体瘤肝癌模型
分组及剂量:空白组不接种,接种了H22肝癌细胞的小鼠随机分为5组,每组10只。山慈菇多糖高剂量组400mg/kg溶液0.2mL,山慈菇多糖中剂量组200mg/kg溶液0.2mL,山慈菇多糖低剂量100mg/kg溶液0.2mL,模型组0.9%无菌生理盐水0.2mL,阳性组腹腔注射环磷酰胺20mg/kg溶液0.2mL,正常组0.9%无菌生理盐水0.2mL。
1.4.2腹水瘤肝癌模型
分组及剂量:随机将腹水瘤肝癌小鼠分为以下3组,每组10只。山慈菇多糖组400mg/kg,模型组0.9%无菌生理盐水0.2mL,环磷酰胺组腹腔注射环磷酰胺40mg/kg溶液0.2mL。
1.5给药
1.5.1实体瘤肝癌模型
肿瘤移植的当天记为0天。注射48 h后,将山慈菇多糖溶液按高、中、低剂量各组小鼠连续用药13 d。每隔1天为小鼠称重并观察小鼠生存状态,在第5天可见实体瘤体积有接种时米粒般大小长成黄豆般大小,并用游标卡尺测量腋下肿瘤的长和宽。
1.5.2腹水瘤肝癌模型
肿瘤移植的当天记为0天。注射48 h后,将山慈菇多糖溶液400mg/kg给山慈菇多糖组小鼠灌胃给药,环磷酰胺组小鼠腹腔注射20mg/kg环磷酰胺,模型组灌胃0.9%生理盐水。每隔1天为小鼠称重并观察小鼠生存状态,在第5天可见小鼠腹部逐渐隆起,在第7天可观察到小鼠腹部明显腹水。
1.6检测指标
1)实体瘤连续给药13 d,末次给药24 h后,给小鼠称体重、拍照、眼眶采血,3 000 r/min离心10min制备血清,Elisa试剂盒检测血清中IL-2、TNFα的活性,用75%乙醇浸泡10 s后剥取小鼠瘤组织、肝脏、脾脏、胸腺称重,瘤组织和肝脏拍照并称重,将瘤组织浸入4%多聚甲醛固定液中密封,石蜡包埋,连续切片,免疫组化SABC法检测肿瘤组织蛋白p53的表达。
2)腹水型小鼠持续给药,观察生存状态及生存时间。
1.7统计学处理
2 结果及分析
2.1对实体瘤小鼠体重增长状况、肿瘤生长曲线及抑瘤率、脾脏指数与胸腺指数的影响
2.1.1实体瘤小鼠肿瘤生长曲线
荷H22小鼠实体瘤生长曲线见图1。
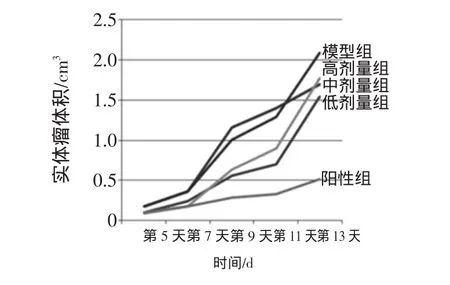
图1 荷H22小鼠实体瘤生长曲线Fig.1 H 22 tum or-bearingm ice solid tum or grow th chart
第5天开始测量小鼠实体瘤体积,用游标卡尺测量腋下肿瘤的长和宽,根据公式计算实体瘤体积。
实体瘤体积=长×宽2/2
由表1可以看出生理盐水对照组小鼠腋下肿块生长速度较快,从饮食、活动及毛发色泽来看,山慈菇多糖中、高剂量小鼠生存质量明显高于环磷酰胺组及山慈菇低剂量组。环磷酰胺组在后期体重增长明显低于山慈菇多糖各剂量组。
2.1.2对实体瘤小鼠体重、瘤质量的影响
各组小鼠给药前后体重变化、瘤质量见表1。

表1 各组小鼠给药前后体重变化、瘤质量Table1 Groupsofm icewithW eight changebeforeand after dosing、Quality of tumor
根据表1数据可看出,给药前小鼠的体重差别不大,给药后中剂量组的小鼠体重最接近于正常组,环磷酰胺组小鼠体重明显低于各组。模型组小鼠体重明显比其他各剂量组重,模型组相比其它小鼠肿瘤质量重且伴随积水,从而使模型组小鼠总体重增加。
2.1.3对实体瘤小鼠抑瘤率、脾脏指数、胸腺指数及IL-2表达的影响
各组小鼠抑瘤率、脾脏指数、胸腺指数见表2。

表2 各组小鼠抑瘤率、脾脏指数、胸腺指数Table2 Groupsofm icew ith tum or inhibition rateand the index of thym us,spleen weight
由表2可知,山慈菇多糖低、中、高剂量组对小鼠肝癌H22实体瘤的抑制率分别为21.58%、32.76%、40.05%,经SPSS18.0分析,与模型组比较,高、中剂量组具有极显著差异(P<0.01),环磷酰胺组抑制率达到81.52%,与模型组比较具有极显著差异(P<0.01),且与山慈菇多糖各剂量组相比,抑制肿瘤作用较强。
2.1.4观察瘤组织
模型组:瘤组织体积较环磷酰胺组大,形状不规则,部分有包膜覆盖,颜色相对周围肌肉组织浅,部分向肌肉浸润生长,瘤周有较大面积的水肿、出血,肿瘤切面中有较多新生微血管坏死出血。
环磷酰胺组:瘤组织为椭圆形或呈不规则形状,包膜大部分完整,体积明显小于模型组和山慈菇多糖组,瘤组织呈鱼肉色,切面色白,出血很少。
山慈菇多糖实验组:瘤组织呈椭圆形或不规则形状,大部分包膜明显,个别有向肌肉组织浸润现象,瘤组织颜色呈鱼肉色,切面较模型组出血较少。
2.1.6HE染色结果
HE染色结果见图2~图6。模型组(图2)中,细胞核深染、排列致密,与其相比较,其山慈菇多糖低、中、高用药组(图3、4、5)的瘤组织中,癌细胞的浸润明显减少,细胞核淡染、固缩或者散落成碎片,高剂量组(图5)更为明显。环磷酰胺组(图6)的效果相比山慈菇多糖各用药组,细胞多固缩及散落成碎片,效果最为明显。

图2 模型组Fig.2 Modelgroup
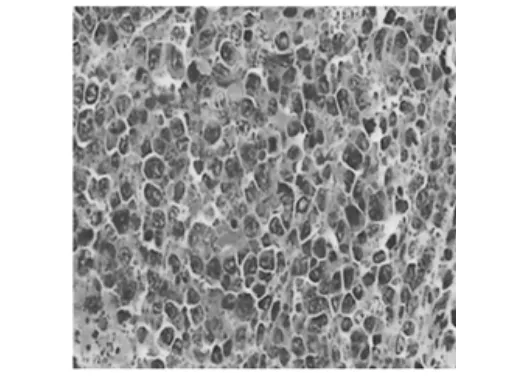
图3 低剂量组Fig.3 Low dosegroup

图4 中剂量组Fig.4 M edium dosegroup

图5高剂量组Fig.5 High dosegroup
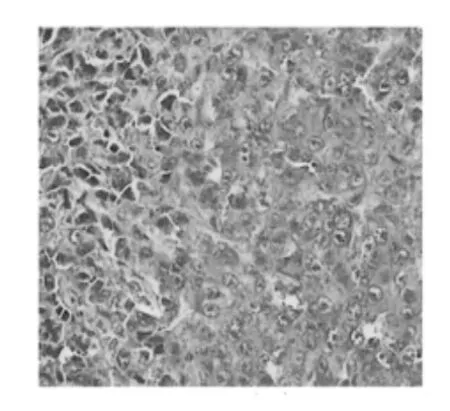
图6 环磷酰胺组Fig.6 Cyclophospham idegroup
2.1.7免疫组织化学技术观察p53蛋白表达
在临床病理诊断中,免疫组织化学(IHC)是一种很重要的技术和手段,免疫组化技术就应用于病理诊断,对于诊断肿瘤“肿瘤分类”判断预后产生了巨大的影响[9],本实验采用的SABC(StreptAvidin—Biotin Complex,简称SABC)是目前检测细胞调亡的常用而准确的方法之一[10],人类已经发现了许多与肿瘤发生相关的基因,包括抑癌基因和原癌基因两大类。p53基因被认为是目前最重要的抑癌基因[11],在DNA复制、修复、重组及细胞周期调控中都起到重要作用,其细胞凋亡通路是人类肿瘤发生过程中最常改变的通路[8],该通路中p53蛋白发挥细胞周期调控和DNA修复功能。p53阳性的癌细胞呈棕褐色与周围未着色的正常细胞形成对照,很容易在镜下识别。p53蛋白在多糖组中的表达率高于模型组,图像数据统计分析将下一步进行,说明山慈菇抑制肿瘤可能是通过p53抑癌基因发挥作用。免疫组织化学技术观察p53蛋白表达见图7~图9。
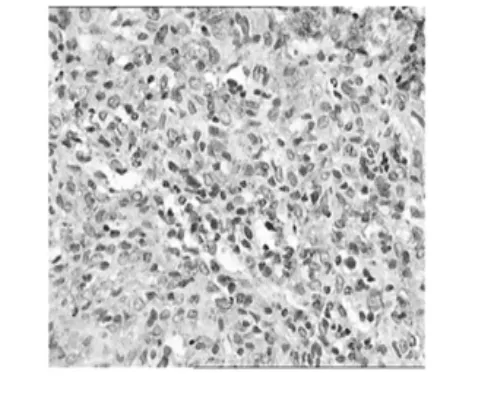
图7 模型组Fig.7 M odelgroup
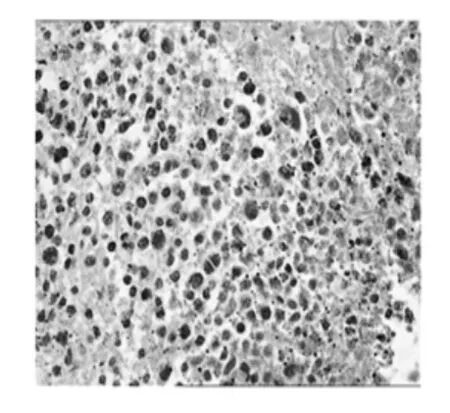
图8 多糖组Fig.8 Polysaccharidegroup
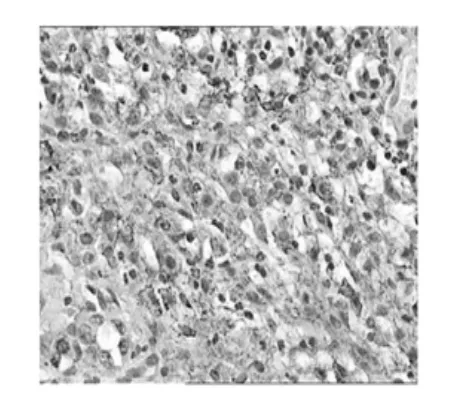
图9 环磷酰胺组Fig.9 Cyclophospham idegroup
2.2对腹水型小鼠生存状态及生存期影响比较
模型组小鼠在第6天左右腹腔明显膨大,至第8天生存状态良好,腹部逐日变大,第9天开始毛发开始枯萎、松散,精神状态欠佳,活动能力下降,进食量稍减,第13天出现小鼠死亡,平均生存14 d。
环磷酰胺组7天后开始毛发枯萎稀疏,无光泽,嘴巴乌紫、进食量逐日减少,在第13天出现死亡,第14天多数死亡,平均生存天数14 d。
山慈菇多糖组:灌胃山慈菇多糖400mg/kg,在第8天生存状态良好,9天后开始毛色无光泽,活动能力下降,进食量逐渐减少,在第13天无死亡现象,第14天出现死亡现象,平均生存天数17 d。
根据公式[11]生命延长率(ILS)/%=T-C/C×100
式中:T为治疗组,C为模型组。
相对模型组,山慈菇多糖组可使腹水型小鼠生命延长21.4%。且根据实验过程观察可得出山慈菇多糖可改善H22腹水型小鼠的生存状态。
3 结论
1)环磷酰胺和山慈菇多糖可不同程度地抑制H22荷瘤小鼠实体瘤的生长,抑瘤率是衡量一种药物抗肿瘤有效性的最基本和最重要的一个指标,是在进行抗肿瘤药物筛选时的主要依据,《现代肿瘤治疗药物学》关于抗肿瘤中草药有效性的标准是抑瘤率>30%[12]。化学药物环磷酰胺的效果最好,在山慈菇多糖的中、高剂量组的效果较为明显,达到了32.76%和40.05%,根据此标准,可初步认为山慈菇多糖有一定的抗肿瘤作用。但腹水瘤小鼠的生存期却无显著性提高,这可能与癌细胞在腹腔内扩散转移速度更快、毒性更强有关[13]。
2)相对环磷酰胺用药组,山慈菇多糖组荷瘤小鼠的胸腺指数和脾脏指数下降不明显,无体质量减轻,表明山慈菇多糖对小鼠机体的毒副作用小。
3)细胞因子(cytokine)有造血系统、免疫系统或炎症反应中的活化细胞产生,能调节细胞分化增殖和诱导细胞发挥功能,可作为恶性肿瘤生长的直接调节剂,可以杀伤肿瘤细胞而不影响正常细胞[14]。研究发现,IL-2是机体抗癌、抗病毒的主要参与者[15]。山慈菇多糖可以提高小鼠IL-2、TNFα的活性,中、高剂量组较为明显,这可能与山慈菇多糖能提高或保持荷瘤小鼠体内TNF-α含量,减少荷瘤小鼠的炎症反应,对肿瘤细胞发挥毒性作用有关[16],实验过程中还发现,多糖各剂量组荷瘤小鼠生理状态较好,食量、水量、活动量较模型、对照组强,初步揭示了其抑瘤机理之一,可能与免疫调节有关。
4)HE染色各种组织或细胞病变的一般形态结构特点均可显示出来,本实验在光镜下观察瘤组织的染色切片中发现,山慈菇多糖给药组切片相对于模型组癌细胞的浸润明显减少,细胞核淡染、固缩或者散落成碎片,细胞形态各异,着色深浅不一,提示了山慈菇多糖有诱导小鼠肝癌H22细胞凋亡的作用。
5)本实验检测结果显示多糖组p53表达随药物浓度增高着色明显,模型组p53表达较低。综上所述,山慈菇多糖具有一定的抗肿瘤作用,其作用机制可能与相关蛋白表达一定的关联。
[1]王燕萍,杨君,冯慧予,等.粗多糖测定方法的选择对分析结果的影响[J].中国卫生检验杂志,2009,19(9):2171-2174
[2]邴其忠.“山慈菇”的本草考证[J].植物分类报,2008,46(5):785-792
[3]董海玲.山慈菇的化学成分和药理作用研究进展[J].中草药,2007,38(11):1734-1738
[4]Xiao PG.Modern Chinese Materia Medica[M].Beijing:Chemical Industry Press,2000:85
[5]Fujisawa Pharmaceutical Co.,Ltd.Antihypertensive cremastosineⅠandⅡisolation:JP:57035518[P].1982-2-6
[6]代芳.中药治疗甲状腺腺瘤体会[J].实用中医药杂志,2002,18(6):35
[7]汪锡尧,姜德清.中医药治疗原发性肝癌1例[J].江苏中医药,2008,40(1):59
[8]谭军英,张洪海,郭洪亮,等.原发性肝癌组织P53和ASPP2基因突变检测及临床意义[J].中华肿瘤防治,2010,17(7):513-516
[9]张卫琴.免疫组化技术在病理诊断中的应用[J].安徽医药,2012,16(11):112-114
[10]徐小娟,蔡懿鑫,毛宇,等.山慈菇多糖对荷H22肝癌小鼠的抗肿瘤机制研究[J].食品研究与开发,2015,36(7):23-25
[11]魏永永.p53与Ras协同及其在肿瘤发生中的作用[J].遗传,2012,34(12):1513-1521
[12]廖子君,南克俊,韩军.现代肿瘤治疗药物学[M].西安:世界图书出版公司,2002:8
[13]南淑蕾,吴国欣,何珊,等.芥子碱对小鼠肝癌H22的体内抑制作用初探[J].中华中医药杂志,2014,29(11):3618-3622
[14]窦锡彬.壮药白莲I号方对荷瘤S180小鼠抑瘤率及血浆白细胞介素-18的影响[J].时珍国医国药,2008,19(2)449-450
[15]任青华,范廷英,张博,等.复方水蛭素提取物对动物S180肿瘤和th1/th2类细胞因子的影响[J].中华肿瘤防治杂志,2008,15(21):1621-1623
[16]郭艳莹,吴勃岩,董静.齐墩果酸与环磷酰胺联合应用对H22荷瘤小鼠P 53突变及TNFα的影响[J].中医药学报,2014,42(3):32-33
Study the Effect of Pleione yunnanensis Rolfe Polysaccharides on IL-2 and p53 Protein Expression
XU Xiao-juan1,2,ZHOU Zhi-han1,MAO Yu2,XU Fang2,LI Jie2,He Jian-hua3,*
(1.Hunan Medical and Pharmaceutical Technical College,Changsha 410128,Hunan,China;2.College of Food Scienceand Technology,Hunan Agricultural University,Changsha 410128,Hunan,China;3.Collegeof Animal Science and Technology,Hunan Agricultural University,Changsha 410128,Hunan,China)
To study on the anti-tumor effct and mechanism of Pleione yunnanensis Rolfe polysaccharides(PYRP)onmicewith H22 hepatocellular carcinoma.The ascitic type and solid tumor ofH22 were established to observe the anti-tumor effect of sinapine.Used Elisa To analyze the level of IL-2,TNFαfrom peripheral blood.HE stainingwasused to observe the cellularmorphology.The thymus index and spleen indexwere used to analyze the influence of PYRP on the immune organs.Immunohistochemical(SABC)were used to study the apoptosismechanism induced by PYRP.The solid tumor inhibition ratio of low,middle,high and low dose of PYRP treated groupswere 21.58%,32.76%,40.05%respectively,PYRPon the life extension ofH22 ascites typemice is 21.4%.PYRP could promote the expression of IL-2 and promote the expression of p53.PYRP could inhibit the H22 solid tumor onmice significantly with dose-dependent and no obvious side effect.The probable route of inhibitory effectof PYRPonmicewith H22 solid tumor is immune-enhancementand acceleration of cellapoptosis.
Pleioneyunnanensis Rolfepolysaccharides;micewithH22hepatocellularcarcinoma;anti-tumor;IL-2;p53
10.3969/j.issn.1005-6521.2016.18.002
中日政府间国际合作项目(2011DFA30490-2)
徐小娟(1987—),女(汉),助理讲师,研究生/硕士,研究方向:营养与健康。
贺建华,男,教授,博士,研究方向:营养与健康。
2015-10-22
