粉煤灰硫酸焙烧熟料溶出液的除铁过程研究
2016-11-14刘康薛济来朱骏谭奇伟
刘康,薛济来,朱骏,谭奇伟
粉煤灰硫酸焙烧熟料溶出液的除铁过程研究
刘康1, 3,薛济来1, 2,朱骏1, 2,谭奇伟1
(1. 北京科技大学冶金与生态工程学院,北京,100083;2. 北京科技大学钢铁冶金新技术国家重点实验室,北京,100083;3. 中国核工业集团核工业北京化工冶金研究院,北京,101149)
对粉煤灰硫酸焙烧熟料溶出液空气和双氧水两段协同除铁过程进行研究。研究结果表明:当恒定空气流速为50 mL/min和全程搅拌速率为500 r/min时,在空气氧化时间为7 h,空气氧化温度为85 ℃,H2O2的氧化时间为30 min及其氧化温度为25℃,质量分数为14%、用量为5 mL等优化条件下可使综合除铁率达99.25%,溶出液铁质量浓度可由1.185 g/L降至8.800 mg/L;除铁后获结晶硫酸铝煅烧所得Al2O3品位(质量分数)为98.71%。
粉煤灰;硫酸化焙烧;氧化沉淀;除铁
从粉煤灰中提取Al2O3不仅可减轻环境危害,而且可为铝工业发展提供替代资源[1−3]。近年来,基于酸法提取Al2O3的工艺研究显示出广阔应用前景而受到重视。在工艺过程中,Fe2O3与Al2O3具有几乎相同的反应路径而易于形成产品;且Fe比Al在阴极上更易析出,会降低铝电解生产的金属铝品位,因此,对粉煤灰原料或在其工艺流程中进行除铁是保障Al2O3和金属铝品质的关键步骤。目前,在粉煤灰提取Al2O3过程除铁环节中,原灰磁选脱铁[4]物料处理量过大且除铁率不高;浸出液溶剂萃取[5−6]除铁投入高且萃取剂需经多级反萃才能循环使用;铝盐重结晶法[7]对溶出液反复升降温导致能耗和铝损失较大;溶出液加碱沉淀铝反溶法[8]存在酸碱反复使用和中和问题;此外,黄钾铁矾法[9]、针铁矿法[10]、赤铁矿法[11]等铁矾渣量大且反应温度高。对硫酸铝溶液采用高锰酸钾[12]氧化水解沉淀法除铁,但其价格高且锰组分进入溶液。综上分析,合适的除铁工艺方法应具备避免引入杂质、流程易操作、能耗物耗低且试剂常规通用等条件。采用空气双氧水协同两段氧化除铁已在锌湿法冶金方面有初步研究[13],但尚未见在酸法处理粉煤灰提取Al2O3过程中应用的报道。为此,本文作者采用浓硫酸焙烧水浸法将粉煤灰中Al2O3以Al2(SO4)3形式转入熟料溶出液,随后对溶出液进行空气−双氧水两段氧化除铁,研究考察空气氧化时间及其温度、双氧水氧化时间及其温度、质量分数、双氧水用量等因素对溶出液除铁率影响,旨在探索一种有利于提高粉煤灰酸法工艺除铁率、降低物料能量消耗的技术途径。
1 实验
1.1 原料和试剂
实验所用粉煤灰化学成分如表1所示,可见灰中主要为Al2O3与SiO2,且Fe2O3质量分数为3.59%。粉煤灰XRD分析结果见图1,表明粉煤灰主要物相为莫来石和二氧化硅。实验所用试剂为:H2SO4(98%,质量分数,下同),H2O2(30%)和CaCO3(99%),均为分析纯,国药集团化学试剂有限公司生产;瓶装空气(99.5%),北京千禧气体有限公司生产;去离子水,实验室自制。

表1 粉煤灰化学成分
1.2 实验过程
将原灰在研磨机(KNM-1)中研磨60 min并烘干去除附着水,取1 kg磨后粉煤灰分10次(每次100 g)与质量分数为80%的硫酸按照酸灰质量比1.5:1.0在刚玉坩埚中混匀,放入马弗炉(SRJX-8-13)中于270℃焙烧60 min。熟料磨细后在85℃去离子水中以液固质量比10:1和搅拌速率500 r/min溶出60 min;经固液分离得熟料溶出液,将所得全部溶出液整体均匀混合后取20 g原料所对应体积的溶出液作为单次除铁实验所用原料,其总Fe质量浓度为1.185 g/L,Fe2+质量浓度为0.39 g/L,Al质量浓度为11.379 g/L,pH为0.8~0.9。对溶出液进行两段氧化沉淀除铁:第1段为空气氧化除铁,在空气流速50 mL/min和搅拌速率为500 r/min条件下,考察空气氧化时间和温度对除铁率的影响;第2段为H2O2深度氧化除铁并维持搅拌速率为500 r/min,考察条件为氧化温度、氧化时间、H2O2质量分数、H2O2用量。在除铁过程中加入CaCO3调节溶液pH并使用pH计(PHSJ-3F)精确测量,除铁后经固液分离得除铁后液,对除铁渣烘干后溶液和除铁后溶液分别进行分析,根据溶出液与除铁后液铁质量浓度计算除铁率。除铁后液经结晶得含水Al2(SO4)3,并在850 ℃煅烧2 h得到产物Al2O3。
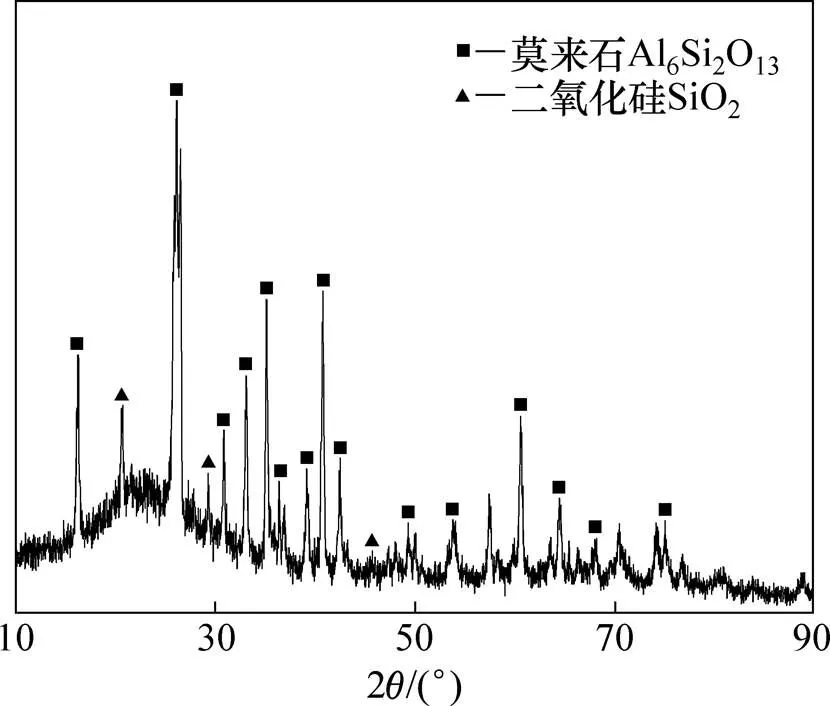
图1 粉煤灰XRD图谱
1.3 分析方法
采用X线荧光光谱仪(XRF-1800X, SHIMADZU, 日本)分析粉煤灰化学成分;采用X线衍射仪(RigakuD:MAX-RB12KW, 日本)鉴定原料和产物物相;采用扫描电镜(JSM-6480LV, JEOL,日本)表征除铁渣、硫酸铝结晶和煅烧氧化铝形貌;溶出液和除铁后液铁质量浓度由ICP分析仪(OPTIMA 7000DV, Perkinelmer,美国)测试;溶出液Fe2+质量浓度由K2Cr2O7滴定法测定。
2 结果与讨论
2.1 除铁过程中pH的选择
粉煤灰中铁主要以Fe2O3和Fe3O4存在,因此,经硫酸焙烧后转化为Fe2(SO4)3和FeSO4进入溶出液,故需将Fe2+氧化成Fe3+从而使其水解沉淀。氧化除铁过程主要反应为:
Fe2+−e=Fe3+(1)
Fe3++3H2O=Fe(OH)3↓+3H+(2)
sp=[(M3+)]×[(OH−)]3(3)
w=[(H+)]×[(OH−)] (4)
pH=−1/3×lg[(Fe3+)]+1.15 (5)
pH=−1/3×lg[(Al3+)]+3.093 (6)
金属离子M3+沉淀所需pH可由对应沉淀溶度积、水离子积常数计算[14−16],由溶度积sp(式(3))和水离子积w(式(4))并将Fe(OH)3与Al(OH)3溶度积(分别为2.8×10−39和1.9×10−33)代入即可得式(5)和式(6),其中为浓度,mol/L;同理可计算Fe(OH)2离子浓度与pH关系。可得熟料溶出液金属离子浓度与pH的关系如表2所示,可见实验中将pH控制在2.8~3.0,可使溶出液中Fe3+水解沉淀从而达到溶出液铝铁分离的目的。

表2 氢氧化物沉淀与溶液pH关系
2.2 空气氧化除铁
因为空气在水溶液中溶解度有限,故应保证通入空气使溶出液含有饱和溶解氧。因此,空气流速恒定为50 mL/min,磁力搅拌速率为500 r/min。
2.2.1 空气氧化时间对除铁率的影响
图2所示为空气氧化时间与除铁率的关系,溶液温度为90 ℃。从图2可见:氧化1 h时除铁率达40.0%,延长至7 h时除铁率达到峰值93.4%;超过7 h后除铁率小幅度下降。反应开始后,随CaCO3加入,溶液pH升高,故Fe3+水解沉淀且速率加快,所生成Fe(OH)3与CaSO4混合使溶液呈黄色悬浊液;随O2溶解量增大,溶液中Fe2+被氧化成Fe3+并水解沉淀,故除铁率持续增大;当时间继续延长时,已生成的Fe(OH)3在酸性溶液体系与水解副产物H+共同作用下会发生少量反溶,故导致在空气氧化时间高于7 h后除铁率可略有降低。参考除铁效果和实验时间,推荐7 h为合适空气氧化时间。
2.2.2 空气氧化溶液温度对除铁率的影响
图3所示为空气氧化温度与除铁率关系曲线,其中氧化时间为7 h。由图3可见:当温度在25~85℃时,除铁率增大且在55 ℃后增大速率加快;当温度高于85 ℃时,除铁率由峰值稍有下降。温度对除铁率影响显著是因为升高温度可促进Fe2+氧化和Fe3+水解沉淀,还有助于Fe(OH)3胶体团聚沉淀;当升至95 ℃时溶液已接近于沸腾,故考虑除铁率及能耗,合适空气氧化温度为85 ℃。
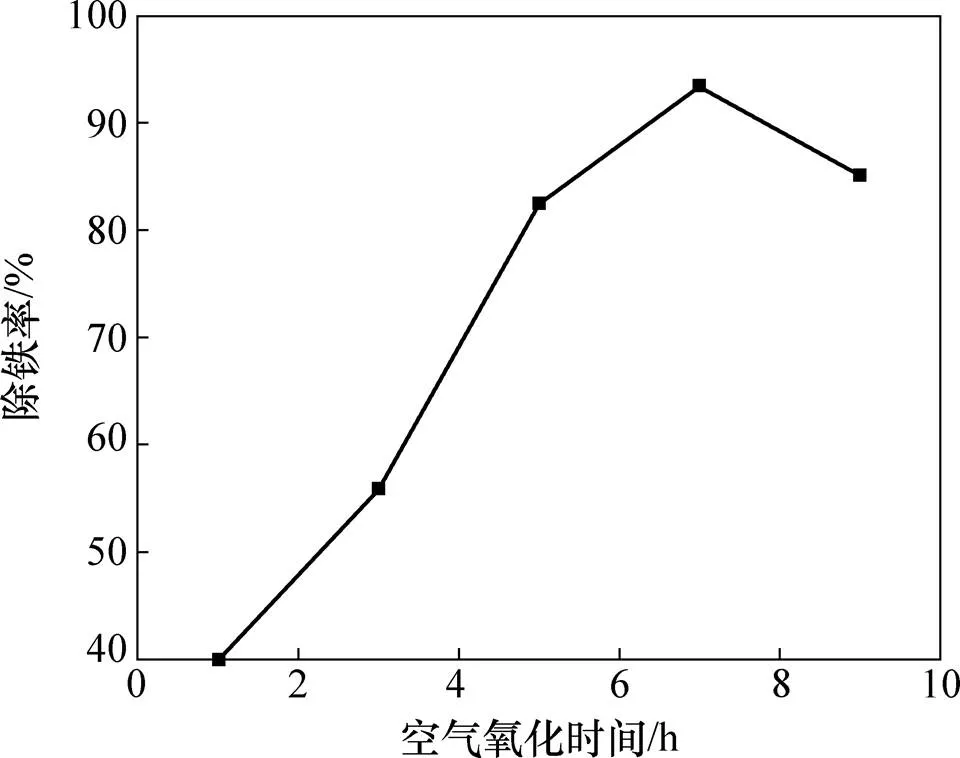
图2 空气氧化时间对除铁率的影响
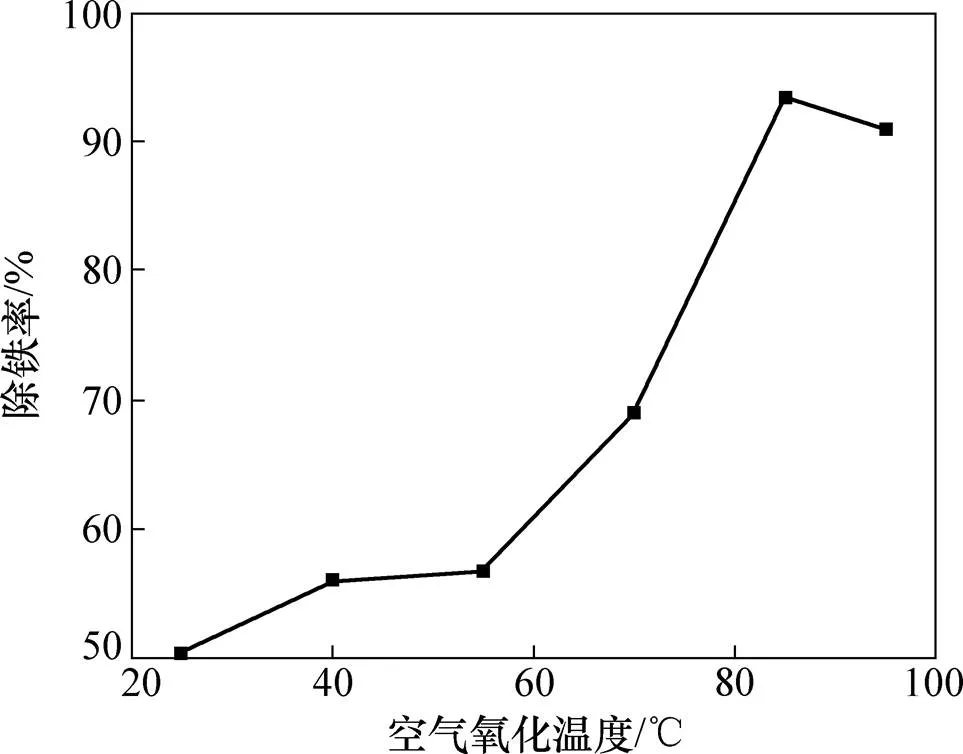
图3 空气氧化温度对除铁率的影响
2.3 H2O2氧化深度除铁
空气氧化除铁经济性好但氧化能力有限,难以将溶液中铁除至所需水平,需再引入H2O2进行深度除铁,以提升除铁和经济性两方面效果,该阶段保持磁力搅拌速率为500 r/min。
2.3.1 H2O2氧化时间对除铁率的影响
图4所示为H2O2氧化时间与除铁率关系曲线,其中H2O2氧化温度为85 ℃,其质量分数为30%,用量为5 mL。由图4可见:除铁率在30 min达到峰值99.1%,而当时间超过45 min后除铁率保持恒定。H2O2氧化除铁过程速率较快,其加入初期在搅拌作用下迅速将剩余Fe2+氧化为Fe3+继而形成Fe(OH)3沉淀。而延长氧化时间会使已生成的Fe(OH)3在H2O2弱酸性和溶液H+双重作用下发生微量溶解使除铁率降低0.8%,即H2O2氧化Fe2+和Fe3+完全水解过程具有一定时效性。考虑除铁率和时间,选定H2O2氧化合适时间为30 min。
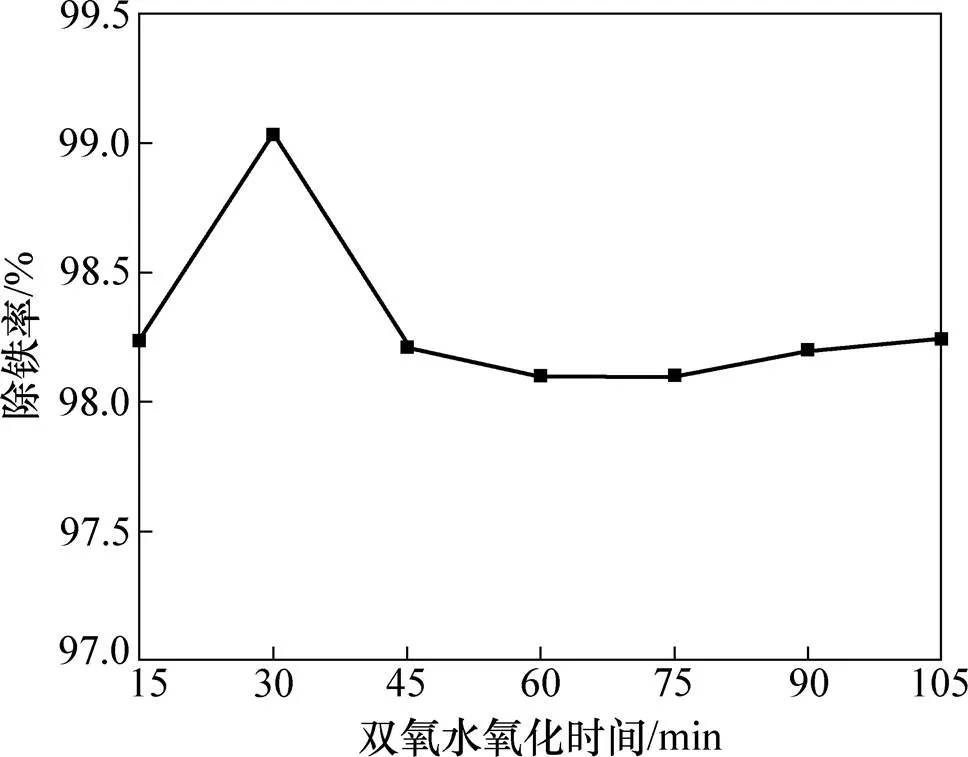
图4 H2O2氧化时间对除铁率的影响
2.3.2 H2O2氧化温度对除铁率的影响
图5所示为H2O2氧化温度与除铁率关系曲线,其中H2O2氧化时间为30 min,其质量分数为30%,用量为5 mL。由图5可知:当温度为25 ℃时除铁率为99.25%,而后随溶液温度升高除铁率下降,这可归因于温度升高时双氧水分解[17]2H2O2=2H2O+O2。这与实际过程一致;在溶液温度较高时,加入H2O2后溶液表面会立刻形式一层气泡将溶液鼓起,经过5~10 s后,该气泡层消失。基于除铁率和温度及能耗考虑, H2O2合适氧化温度为25 ℃。
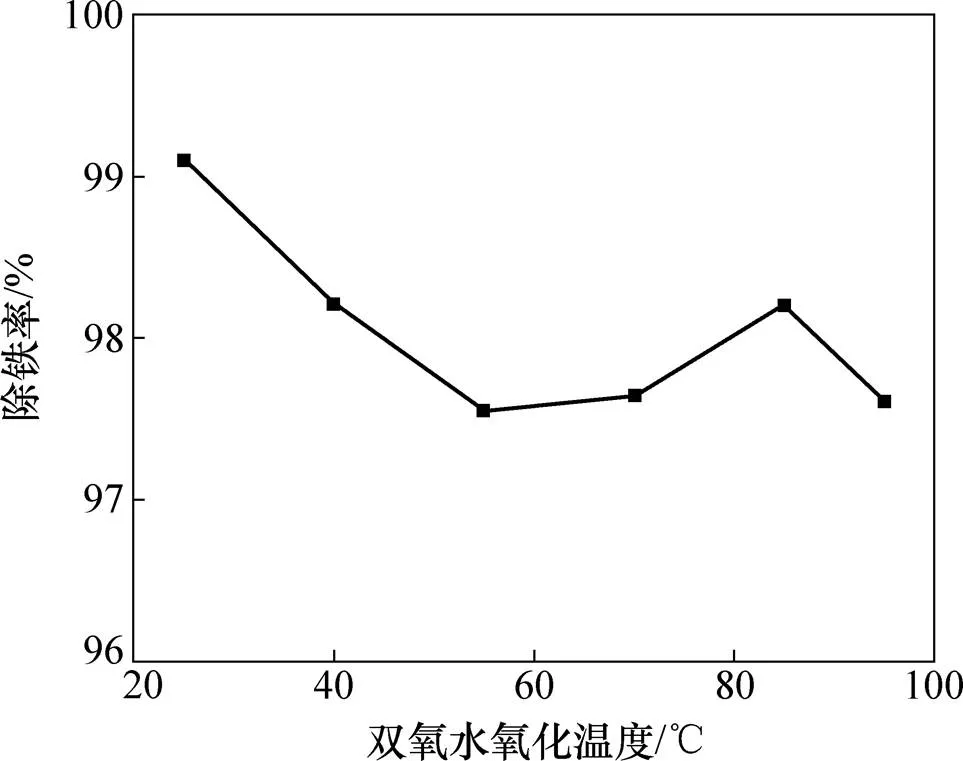
图5 H2O2氧化温度对除铁率的影响
2.3.3 H2O2质量分数对除铁率的影响
图6所示为H2O2质量分数与除铁率关系曲线,其中H2O2氧化时间为30 min,其氧化温度为25 ℃,用量为5 mL。试剂双氧水原始质量分数为30%,在H2O2质量分数为14%时除铁率出现峰值99.1%,而当H2O2质量分数进一步增大时,除铁率持续下降。这主要是因为当H2O2开始加入时其有效量相对于溶液中Fe2+而言欠缺,而当H2O2质量分数继续增大时,呈过量状态,弱酸性使少量已生成Fe(OH)3沉淀出现反溶进入溶液。故选取H2O2合适质量分数为14%。
2.3.4 H2O2用量对除铁率的影响
图7所示为H2O2用量与除铁率关系曲线,其中H2O2氧化时间为30 min,其氧化温度为25 ℃,质量分数为14%。由图7可见:H2O2用量为5 mL时除铁率达到峰值,当H2O2用量超过5 mL后除铁率稍有降低。考虑到除铁率和试剂消耗,H2O2适宜用量为5 mL。

图6 H2O2质量分数对除铁率的影响
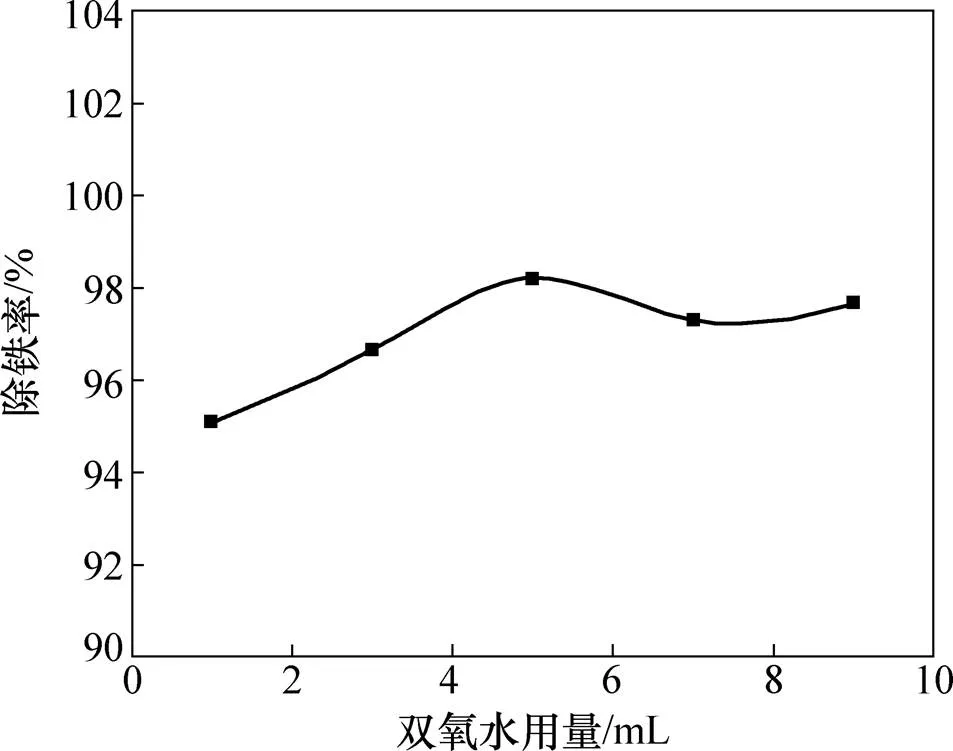
图7 双氧水用量对除铁率的影响
综合前述2段除铁过程参数影响规律,在以上优化除铁参数下,焙烧熟料溶出液经空气、双氧水两段协同除铁其除铁率可达99.25%,溶出液铁质量浓度可由1.185 g/L降至8.800 mg/L。此外,综合分析以上实验结果,计算可得单次实验溶出液平均铝损失率为4%~5%。针对除铁过程单因素条件实验所得参数的适用性问题,本研究后续用1 kg和10 kg级粉煤灰放大实验给予验证,分析2种情况下的实验结果,可知条件实验参数用于扩大化实验,其除铁率为98.6%~99.0%,表明参数具有较好适用性;此外,在放大型实验中发现,空气输入方式由单管单头集中式输入改为单管多头分散型输入时效果更佳。
2.4 除铁效果分析
研究结果表明:溶出液带有一定黄绿色,这表明溶出液中含有一定量Fe3+和Fe2+;而经过除铁后,溶液呈无色透明,这表明两段除铁过程可将溶出液中Fe成分被有效除去。
图8所示为除铁渣XRD和SEM图,可见除铁渣主要物相是CaSO4,Fe(OH)3和Fe2O3,这与实验所确定除铁渣组成相吻合。出现Fe2O3峰是因为除铁渣烘干时CaSO4易吸水且Fe(OH)3易少量脱水而生成Fe2O3。出现Fe(OH)2衍射峰是因为在空气氧化过程中,溶液中极少量Fe2+跟随Fe3+共同水解;而绝大多数Fe2+是被2段氧化过程氧化为Fe3+而后水解沉淀,因此,除铁渣中出现个别Fe(OH)2衍射峰。

(a) XRD;(b) SEM
SEM分析可见除铁渣粒径为5~10 μm,并呈现不规则片状结构,且小片附着在大片上生长,从而表明除铁渣中Fe(OH)3是依附在CaSO4基体上而团聚沉淀,这与实验结果相吻合。当只对溶出液进行加热并鼓入空气氧化除铁时,溶液中会出现均匀深红色Fe(OH)3胶体物质,但其在过滤环节无法与主溶液分离;而当加入调碱剂CaCO3时,除铁产物易于与主溶液分离,这表明CaSO4充当基体促使Fe(OH)3凝聚 沉淀。
2.5 除铁后液结晶与煅烧产物表征
图9所示为除铁后液硫酸铝结晶XRD和SEM图。从图9可见:结晶产物为Al2(SO4)3晶体并含有不同数量结晶水;Al2(SO4)3晶体颗粒粒度为5~25 μm并具有2~8 μm厚度的片状结构,且有小晶体附着在大颗粒晶体上。

(a) XRD;(b) SEM
图10所示为除铁后液结晶硫酸铝煅烧所得γ-Al2O3XRD和SEM图。由图10可见:煅烧产物为单一γ-Al2O3相,且Al2O3颗粒呈不规则球形,颗粒粒度为50~100 μm,且这些球形由更小块状和片状结构组成。
煅烧氧化铝化学成分分析结果见表3。从表3可见:煅烧产物化学成分分析中Al2O3纯度(质量分数)达到98.711%,且主要参考指标项Fe2O3,SiO2,Na2O等质量分数皆满足有色金属工业一等品Al2O3标准,故表明对焙烧熟料溶出液进行两段氧化水解沉淀后,所得Al2O3产品可满足铝电解对纯度和杂质量的要求。
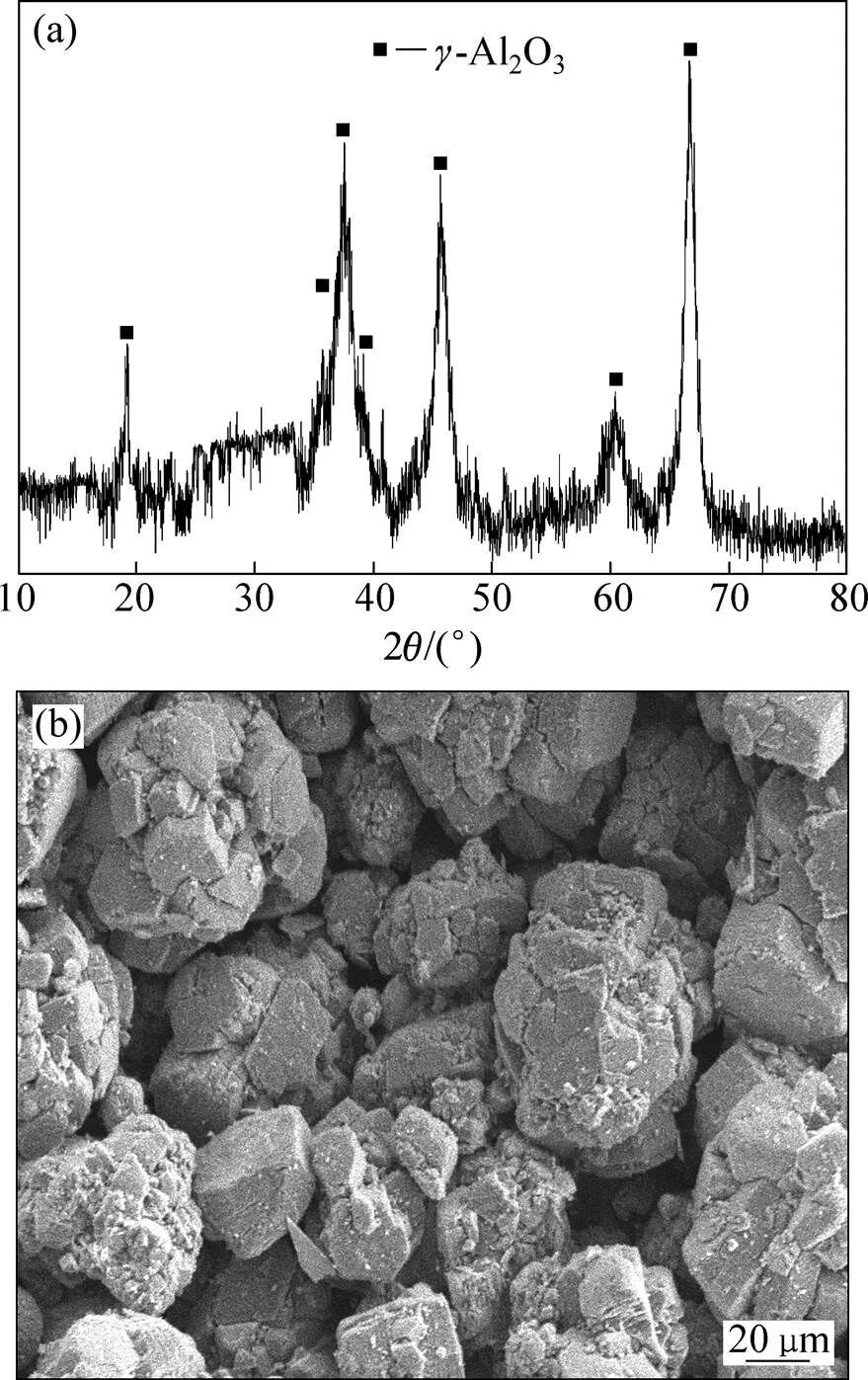
(a) XRD;(b) SEM

表3 煅烧氧化铝的化学成分(质量分数)
3 结论
1) 通过理论计算获得溶液pH与Al3+和Fe3+浓度关系式,将溶液pH控制在2.8~3.0范围内使Fe3+水解沉淀为Fe(OH)3,从而实现溶出液中Al3+和Fe3+的有效分离。
2) 在空气流速为50 mL/min和全程磁力搅拌速率500 r/min条件下,2段除铁实验所得优化操作参数如下:空气氧化时间为7 h及其温度为85℃,H2O2氧化时间为30 min及其氧化温度为25℃、质量分数为14%、用量为5 mL时,两段除铁工艺除铁率可达99.25%,可使溶出液中Fe质量浓度从1.185 g/L降至8.800 mg/L,除铁后溶液中Al2(SO4)3结晶煅烧所得Al2O3品位为98.711%,可满足铝电解过程要求。
3) 在溶出液除铁过程中,加入调碱剂CaCO3可使胶体Fe(OH)3有效凝聚沉降,而使液固分离过程更易于进行;同时,空气与双氧水协同作用可使除铁效果和经济性有较大提高。
参考文献:
[1] YAO Zhitong, XIA Meisheng, SARKER P K. A review of the alumina recovery from coal fly ash, with a focus in China[J]. Fuel, 2014, 120: 74−85.
[2] NAYAK N, PANDA C R. Aluminum extraction and leaching characteristics of talcher thermal power station fly ash with sulfuric acid [J]. Fuel, 2010, 89: 53−58.
[3] SARKAR A, RUMO R, UDAYBHANU G. A comprehensive characterization of fly ash from a thermal power plant in Eastern India[J]. Fuel Processing Technology, 2006, 87: 259−277.
[4] 姚志通. 固体废弃物粉煤灰的资源化利用[D]. 杭州: 浙江大学海洋学院, 2010: 37−43.YAO Zhitong. The resource utilization of solid waste coal fly ash[D]. Hangzhou: Zhejiang University. Ocean College, 2010: 37−43.
[5] 薛茹君, 兰伟兴, 李森. 萃取除铁法在粉煤灰制取高纯氧化铝中的应用研究[J]. 中国矿业大学学报, 2010, 39(6): 907−910. XUE Rujun, LAN Weixing, LI Sen. Preparation of ultra purity alumina from coal fly ash using an extraction separation of Fe(III)[J]. Journal of China University of Mining & Technology, 2010, 39(6): 907−910.
[6] CHOU Kansen, LIN Chuencheang. Extraction iron from aluminum sulfate solution[J]. Hydrometallurgy, 1986, 15: 391−397.
[7] 吴艳. 从粉煤灰中提取氧化铝和二氧化硅的研究[D]. 沈阳: 东北大学冶金学院, 2008: 35−38. WU Yan. Study on extraction of Al2O3and SiO2from fly ash[D]. Shenyang: Northeastern University. School of Metallurgy, 2008: 35−38.
[8] 闫丽. 酸碱联合法从粉煤灰提取氧化铝和氧化硅工艺过程的研究[D]. 北京: 北京科技大学冶金与生态工程学院, 2008: 62−69. YAN Li. Study on digestion of alumina and silica from coal fly ash using an acid and alkali combined process[D]. Beijing: University of Science and Technology Beijing. School of Metallurgical and Ecological Engineering, 2008: 62−69.
[9] 刘俊峰, 易平贵, 黄可龙. 常压酸浸闪锌矿的条件对锌浸出率的影响[J]. 中国有色金属学报, 2000, 10(5): 728−731.LIU Junfeng, YI Pinggui, HUANG Kelong. Effects of conditions of soaking blende with sulfuric acid on rate of leaching zinc in oxygen and at normal pressure[J]. The Chinese Journal of Nonferrous Metals, 2000, 10(5): 728−731.
[10] 李海军, 杨洪英, 陈国宝. 中心复合设计针铁矿法从含钴生物浸出液中除铁[J]. 中国有色金属学报, 2013, 23(7): 2040−2046.LI Haijun, YANG Hongying, CHEN Guobao. Goethite deironization process for cobaltiferous bioleaching solution by central composite design[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(7): 2040−2046.
[11] 杨秋菊, 刘久清, 蒋彬. 高铁低铜溶液磷酸盐除铁工艺[J]. 中南大学学报(自然科学版), 2012, 43(10): 3763−3768. YANG Qiuju, LIU JiuQing, JIANG Bin. Technique of removing iron by phosphate in high iron-low copper solution[J]. Journal of Central South University (Science and Technology), 2012, 43(10): 3763−3768.
[12] 吴建宁, 蔡会武, 郭红梅. 从含铁硫酸铝中除铁[J]. 湿法冶金, 2005, 24(3): 155−158.WU Jianning, CAI Huiwu, GUO Hongmei. Removing of iron from aluminum sulfate solution[J]. Hydrometallurgy of China, 2005, 24(3): 155−158.
[13] 杨大锦. 低品位锌矿堆浸-萃取-电积工艺研究[D]. 昆明: 昆明理工大学冶金与能源工程学院, 2006: 77−88.YANG Dajin. Study on heap leaching solvent extraction electro-deposit of low grade zinc ore[D]. Kunming: Kunming University of Science and Technology. School of Metallurgical and Energy Engineering, 2006: 77−88.
[14] SARIKAYA Y, KEZBAN A, ALEMDAROĞLU T. The effect of Al3+concentration on the properties of alumina powders obtained by reaction between aluminium sulphate and urea in boiling aqueous solution[J]. Journal of the European Ceramic Society, 2002, 22(12): 1905−1910.
[15] GAO Wencheng, LI Zhibao. Solubility andspof Mg4Al2(OH)14·3H2O at the various ionic strengths[J]. Hydrometallurgy, 2012, 117/118: 36−46.
[16] GUO Qinghai, TIAN Jiao. Removal of fluoride and arsenate from aqueous solution by hydrocalumite via precipitation and anion exchange[J]. Chemical Engineering Journal, 2013, 231: 121−131.
[17] 刘中兴, 谢传欣, 石宁. 过氧化氢溶液分解特性研究[J]. 齐鲁石油化工, 2009, 37(2): 99−102.LIU Zhongxing, XIE Chuanxin, SHI Ning. Study on decomposition behavior of hydrogen peroxide solution[J]. QILU Petrochemical Technology, 2009, 37(2): 99−102.
(编辑 陈灿华)
Process study on iron removal of leachate from coal fly ash sintered by concentrated sulfuric acid
LIU Kang1, 3, XUE Jilai1, 2, ZHU Jun1, 2, TAN Qiwei1
(1. School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing, Beijing 100083, China; 2. State Key Laboratory of Advanced Metallurgy, University of Science and Technology Beijing, Beijing 100083, China; 3. Beijing Institute of Chemical Engineering and Metallurgy, China National Nuclear Corporation, Beijing 101149, China)
Iron removal process of leachate from coal fly ash sintered by concentrated sulfuric acid was investigated,which involved two steps, i.e., air oxidation and hydrogen peroxide oxidation. The results show that the iron removal rate can achieve 99.25% at the optimal operating conditions of the air oxidation time 7 h, air oxidation temperature 85 ℃, H2O2oxidation time 30 min, H2O2oxidation temperature 25 ℃, H2O2concentration 14% and H2O2dosage 5 mL, with the constant air flow rate 50 mL/min and the stirring rate 500 r/min in the whole process. Meanwhile, the iron mass concentration in leachate can decrease to 8.800 mg/L from 1.185 g/L. The purity of Al2O3product calcinated from aluminum sulfate precipitation in leachate after iron removal is 98.71%.
coal fly ash; sulfating sintering; oxidation precipitation; iron removal
10.11817/j.issn.1672-7207.2016.10.002
TF 821
A
1672−7207(2016)10−3295−07
2015−10−01;
2015−12−13
中央高校基本科研业务费专项资金资助项目(FRF-UM-15-049)(Project(FRF-UM-15-049) supported by the Fundamental Research Funds for the Central University)
薛济来,教授,博士生导师,从事有色金属冶金、冶金电化学及资源循环利用等研究;E-mail:jx@ustb.edu.cn
