激活PPAR-γ上调PTEN抑制人肾母细胞瘤G401细胞增殖及侵袭转移的实验研究
2016-11-10西安市儿童医院小儿外科西安710003
西安市儿童医院小儿外科(西安710003)
郭 朝 徐 泉▲
激活PPAR-γ上调PTEN抑制人肾母细胞瘤G401细胞增殖及侵袭转移的实验研究
西安市儿童医院小儿外科(西安710003)
郭 朝 徐 泉▲
目的:研究罗格列酮对人肾母细胞瘤细胞G401增殖、迁移和侵袭能力的影响,并探讨其相关机制。方法:体外培养G401,不同浓度的罗格列酮干预G401细胞,MTT法测定细胞增殖的抑制率。选择最合适的罗格列酮浓度(10 μmol/L)干预细胞,用划痕愈合实验检测细胞迁移能力的变化,Transwell侵袭小室实验检测细胞侵袭能力的变化,Western blot检测PPAR-γ、PTEN、T-AKT、P-AKT、MMP-2、MMP-9蛋白水平变化;RT-PCR检测PTEN、MMP-2、MMP-9的mRNA表达变化。结果:罗格列酮可以显著抑制G401细胞增值,并呈浓度和时间依赖性(P<0.05);罗格列酮可以显著抑制G401细胞的迁移和侵袭能力(P<0.05)。Western blot结果显示罗格列酮可以上调PPAR-γ、PTEN的蛋白水平,下调P-AKT、MMP-2、MMP-9水平;RT-PCR结果显示罗格列酮可以上调PTEN的mRNA水平,下调MMP-2、MMP-9的mRNA水平。结论:罗格列酮可抑制肾母细胞瘤细胞G401的增殖,其分子机制可能与激活PPAR-γ,上调 PTEN、抑制PI3K/AKT信号通路有关;罗格列酮抑制G401细胞迁移和侵袭能力主要是通过激活PPAR-γ,抑制MMP-2和MMP-9 的表达实现。
肾母细胞瘤是小儿最常见的恶性肿瘤之一,约占儿童恶性肿瘤的6%,泌尿系统恶性肿瘤的95%以上。目前临床多采用手术、放疗及化疗等综合个体化治疗方案,但是在治疗过程中发现,常用的化疗药物如长春新碱、放线菌素D等均存在较大的肝肾毒性,而放疗易引起放射性肠炎等并发症。因此寻找新型干预药物,并探讨其具体作用机制,对防治肾母细胞瘤的发生、发展有重要意义[1]。过氧化物酶体增生物激活受体-γ(PPAR-γ)是一种核转录受体,具有广泛的组织、细胞保护作用[2]。磷脂酰肌醇3-激酶 (PI3K)是重要的细胞内信号转导分子,通过催化磷脂酰肌醇(PI)磷酸化发挥作用,AKT是PI3K的下游靶基因,PI3K/AKT信号通路参与细胞增殖、迁移、分化,血管生成等一系列病理生理过程,在多种肿瘤的发生发展中起着重要作用[3]。10号染色体缺失的磷酸酶及张力蛋白同源物(PTEN)是近年来新发现的一种肿瘤抑制基因,其产物PTEN蛋白是 PI3K/AKT信号通路的内源性负性调控蛋白,可通过其脂质磷酸酶活性阻断PI3K/AKT信号通路来实现其抑癌作用[4]。基质金属蛋白酶(MMPs)与肿瘤侵袭转移关系密切,目前研究较多的为MMP-2和MMP-9[5]。研究证实,激活 PPAR-γ可抑制多种肿瘤细胞的增殖及其侵袭转移[6],但在肾母细胞瘤中尚无相关研究报道。本文探讨激活PPAR-γ能否通过上调 PTEN,抑制 PI3K/AKT信号通路,下调MMP-2和MMP-9的表达,进而抑制肾母细胞瘤细胞增殖及侵袭转移。
材料和方法
1 材 料 人肾母细胞瘤细胞G401购自北京协和细胞资源中心,罗格列酮购自Sigma公司。McCoy's 5a培养基购自Gibco公司,胎牛血清购自杭州四季青公司。四甲基偶氮唑盐(MTT) ,二甲基亚砜(DMSO) 均购自美国Sigma 公司。兔抗人PPAR-γ、PTEN、T-AKT、P-AKT、MMP-2、MMP-9单克隆抗体均购自Cell signaling technology(CST)公司,鼠抗人β-actin单克隆抗体,辣根酶(FITC)标记山羊抗鼠 IgG、山羊抗兔 IgG 二抗均购自北京中杉金桥公司。PTEN、MMP-2、MMP-9、β-actin基因引物由北京奥克鼎盛有限公司合成,反转录试剂盒和 RT-PCR试剂盒购自TaKaRa公司。
2 细胞培养 用含双抗(青霉素100 U/ml、链霉素100 μg/ml)的10% FBS-McCoy's 5a培养基培养人肾母细胞瘤细胞G401,置于37 ℃、5 % CO2培养箱中,细胞单层贴壁生长,至70 %~80 %融合度时,用0.25 %胰酶消化后传代,取对数生长期的细胞用于实验。
3 MTT法细胞增殖实验 取对数生长期的G401细胞制成单细胞悬液,以4000个细胞/孔的密度接种于96孔培养板,每孔加培养基200 μl,于37℃、5% CO2细胞培养箱中培养。待24 h细胞贴壁后,加入不同浓度的罗格列酮(0.1、1、10、100 μmol/L),分别培养 24 h、48 h、72 h后终止。(以下操作均在避光条件下进行)每孔加入5 mg/ml MTT 溶液20 μl,细胞培养箱中孵育4 h,弃上清液,每孔加入DMSO 150 μl,置酶标仪上振荡10 mim。测波长为490 nm处的吸光度(OD)值。细胞增殖抑制率=(OD对照组-OD实验组) /( OD对照组-OD空白组),实验重复3 次。
4 细胞划痕愈合实验 取对数生长期的G401细胞,制成单细胞悬液,接种于6孔培养板中。待细胞长满培养板底层后,取一个干净的10 μl无菌枪头,用其尖端分别在 6 孔板的各组细胞上划痕。用PBS漂洗2遍洗去被刮下的细胞,加入无血清培养基,然后分为对照组及罗格列酮组(10 μmol/L)。在细胞倒置显微镜下观察划痕宽度,取各组细胞培养孔中划痕宽度相等的位置照相,并做标记。将细胞放置于37℃,5 % CO2培养箱中继续培养,24 h及48 h后观察同一位置的细胞迁移情况,再次照相。细胞迁移指数 =[24(48)h划痕面积]/初始划痕面积(0 h),实验重复3 次。
5 Transwell小室侵袭实验 将Matrigel基质胶用预冷的无血清McCoy's 5a培养基按1∶6的比例稀释,取100μl稀释的基质胶加入到Transwell小室的上室中,放入细胞培养箱4 h或过夜。取对数生长期的细胞,分为对照组及罗格列酮组(10umol/L)分别干预24 h,用1% FBS-McCoy's 5a培养基将细胞密度调整到5×105/ml。24孔板Transwell小室上室加入200 μl细胞悬液,下室加入500 μl 1%FBS-McCoy's 5a培养基。细胞培养箱中培养24 h,PBS清洗,多聚甲醛固定,结晶紫染色,擦去上室细胞,显微镜下计数。取5个视野(上、中、下、左、右),照相、计数,实验重复3 次。
6 Western-blot 检测PPAR-γ、PTEN、T-AKT、P-AKT、MMP-2、MMP-9蛋白的表达 取对数生长期的G401细胞,制成单细胞悬液,接种于6孔培养板中,于 37℃,5% CO2的培养箱中培养,待细胞长至60 %~70 %时,分为对照组及罗格列酮组(10 μmol/L),48 h后,用RIPA细胞裂解液提取各组细胞总蛋白,使用BCA法测定蛋白浓度;SDS-聚丙烯酰胺凝胶垂直电泳,使用半干转膜法,将蛋白转印至 PVDF 膜上;将PVDF膜放入5 % 脱脂牛奶中室温封闭2 h,加一抗孵育;4 ℃过夜;PBST 洗膜,10 min×3 次;二抗孵育,室温2 h;PBST;洗膜,10 min×3次;使用BIO-RAD 成像系统检测条带,分析结果,实验重复3 次。
7 RT-PCR检测PTEN、MMP-2、MMP-9、β-actin的mRNA表达变化 细胞培养及分组同上,24 h收获细胞,按照说明书提取细胞总RNA,测定其完成度和纯度,按照反转录试剂盒合成cDNA,以β-actin为内参照。β-actin上游引物序列5'-AGCCTCGCCTTTGCCGA-3',下游引物序列:5'-CTGGTGCCTGGGGCG-3';PTEN上游引物序列5'-ACCAGTGGCACTGTTGTTTCAC-3',下游引物序列5'-TCCTCTGGTCCTGGTATGAAG-3';MMP-2上游引物序列5'-GATACCCCTTTGACGGTAAGGA-3',下游引物序列5'-CCTTCTCCCAAGGTCCATAGC-3';MMP-9上游引物5’-TGTACCGCTATGGTTACACTCG-3',下游引物5'-GGCAGGGACAGTTGCTTCT-3'。反应条件为:95℃预变性3 min,94 ℃变性30 s,相应退火温度(55~ 62℃) 30 s,72℃延伸30 s,35个循环;72 ℃延伸5 min,4 ℃冷却。产物进行琼脂糖凝胶电泳,BIO-RAD 成像系统检测条带并拍照。条带分析,将目标条带与β-actin带的吸光度值之比作为其 mRNA 表达水平的参数,实验重复3 次。
结 果
1 罗格列酮抑制G401细胞增殖的作用 见图1。罗格列酮能够明显抑制G401细胞的增殖,具有时间及浓度依赖性(P<0.05)。
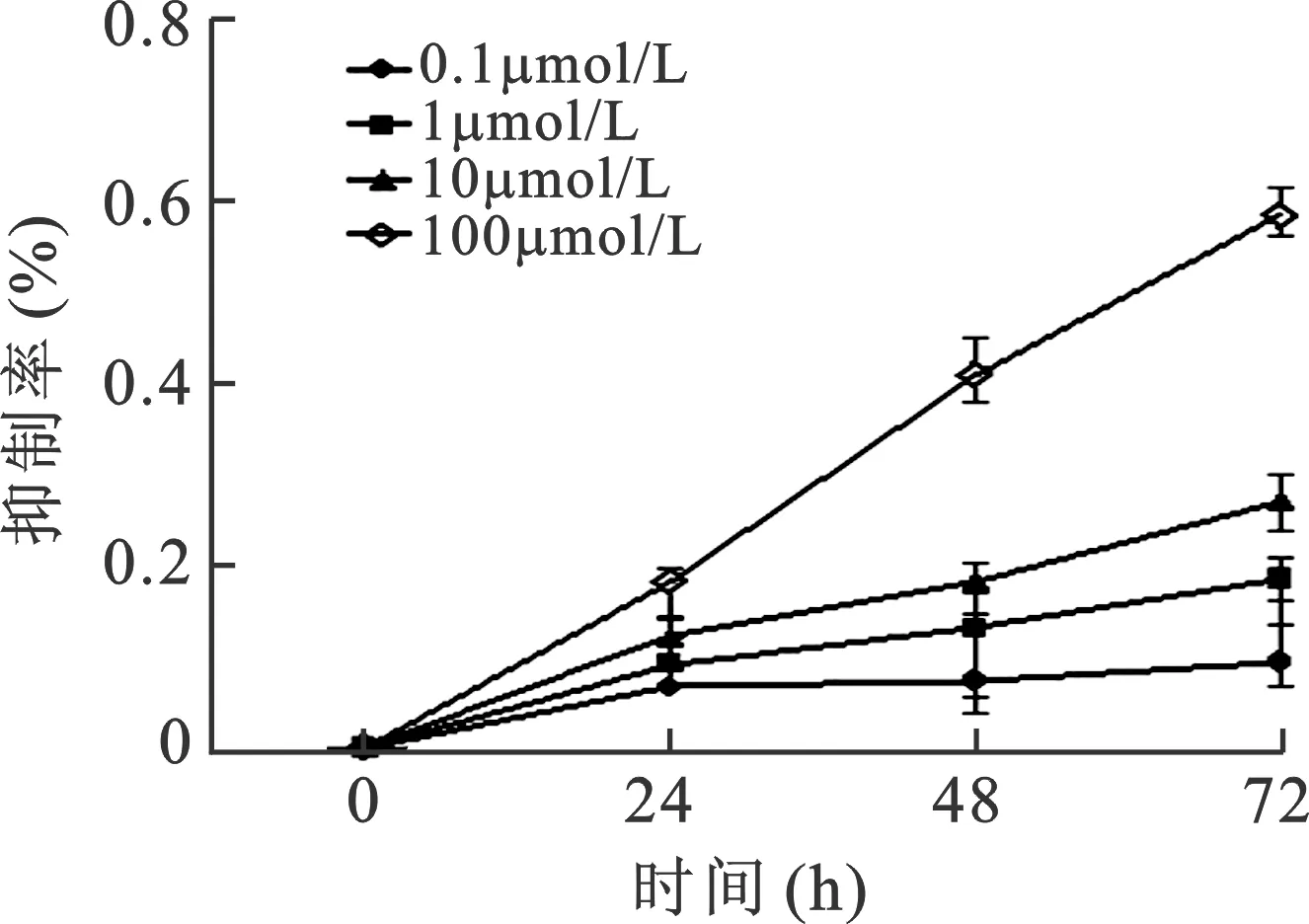
图1 罗格列酮对G401细胞的抑制作用
2 罗格列酮抑制G401细胞的迁移能力 见图2。将细胞分为对照组、罗格列酮组(10 μmol/L),分别干预24 h及48 h,通过划痕实验检测各组G401细胞迁移能力的变化。干预24 h后,正常对照组的迁移指数为0.444±0.0823,罗格列酮组的迁移指数为0.778±0.0437;干预48 h后,正常对照组的迁移指数为0.110±0.0320,划痕几乎已经全部愈合,罗格列酮组的迁移指数为0.446±0.0855;两组之间相比,罗格列酮明显抑制了G401细胞的迁移,差异具有统计学意义 (P<0.05)。
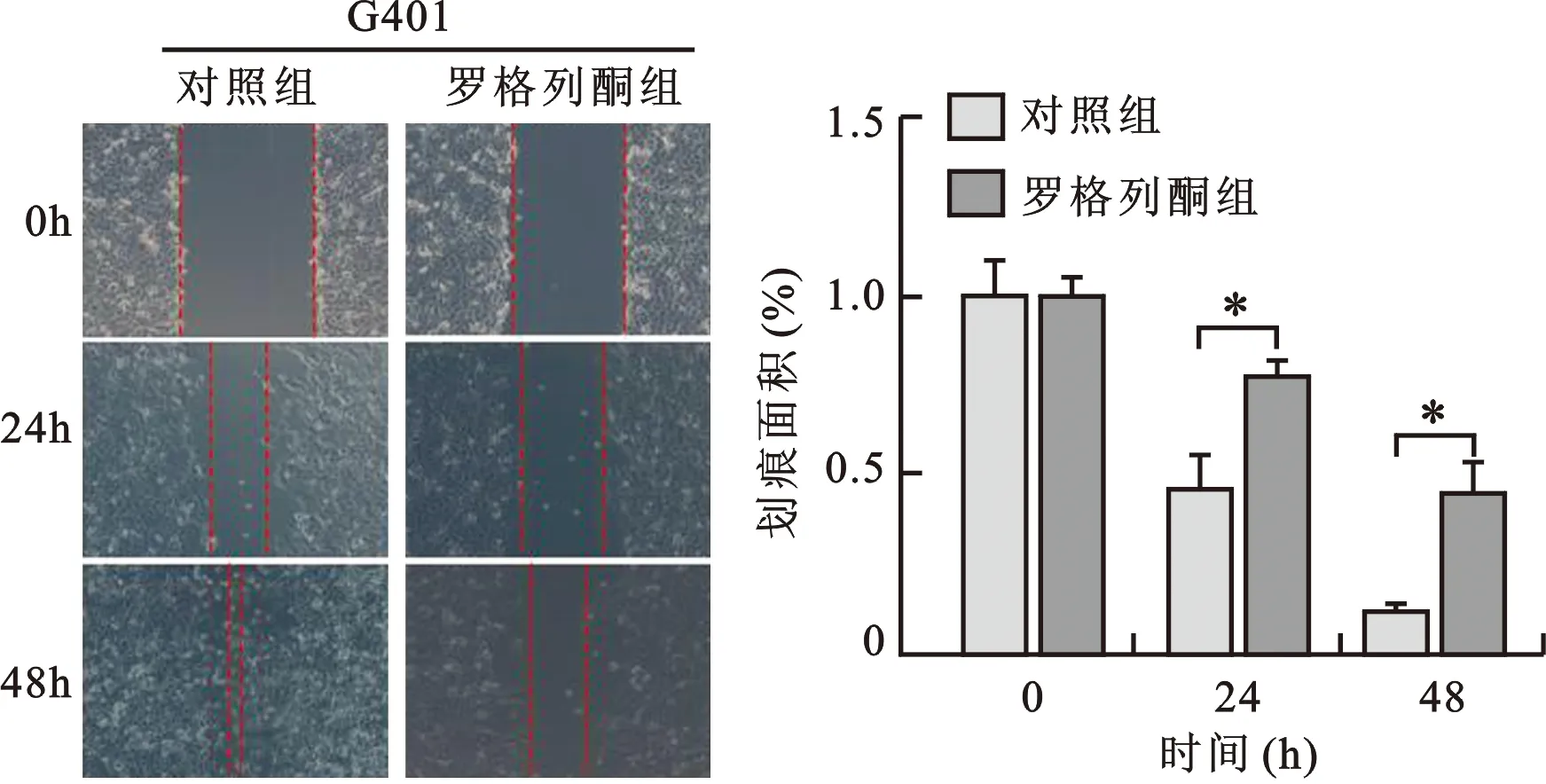
与对照组比较,* P<0.05
3 罗格列酮抑制G401细胞的侵袭能力 见图3。将细胞分为对照组、罗格列酮组(10 μmol/L),干预24 h,通过Transwell小室侵袭实验检测两组G401细胞的侵袭能力的变化。对照组的穿膜细胞数为267.333±50.4个,罗格列酮组的穿膜细胞数为118±35.028个,罗格列酮显著抑制了G401细胞的侵袭能力,差异有统计学意义(P<0.05)。
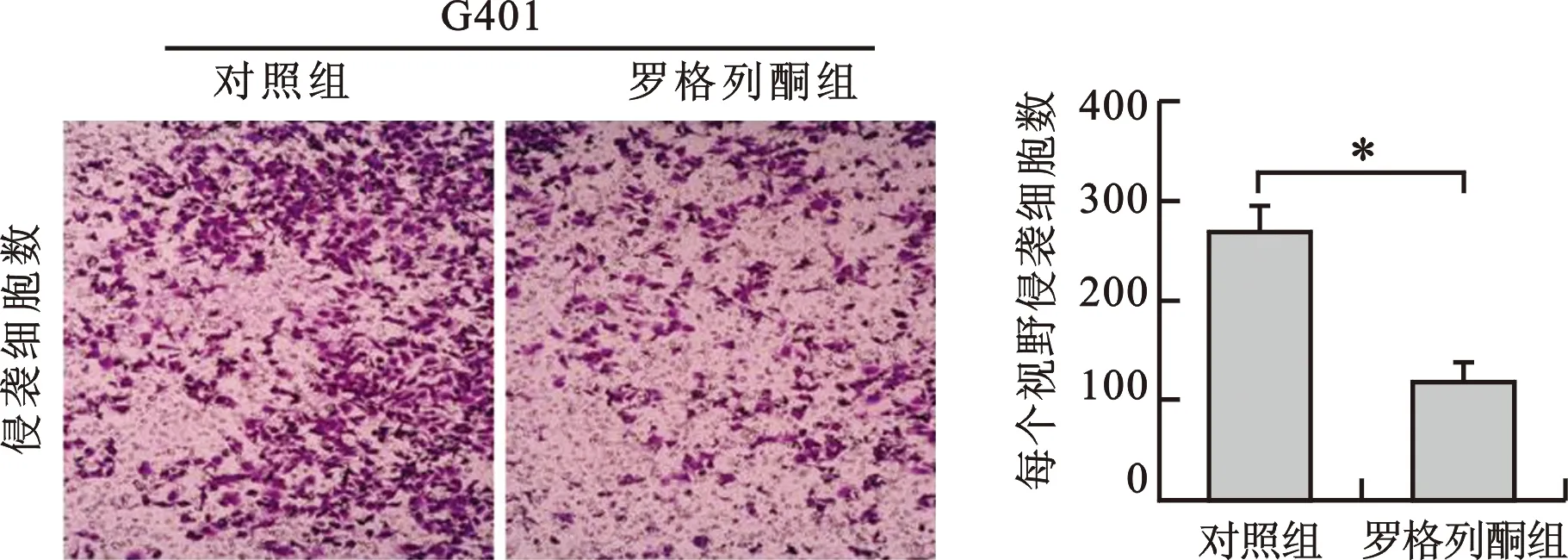
图3 罗格列酮抑制G401细胞的侵袭能力
4 罗格列酮对G401细胞PPAR-γ、PTEN、T-AKT、P-AKT、MMP-2、MMP-9蛋白水平的影响 见图4。Western blot检测结果显示,罗格列酮干预后,G401细胞PPAR-γ、PTEN的水平升高,P-AKT、MMP-2、MMP-9的水平降低,差异具有统计学意义(P<0.05)。
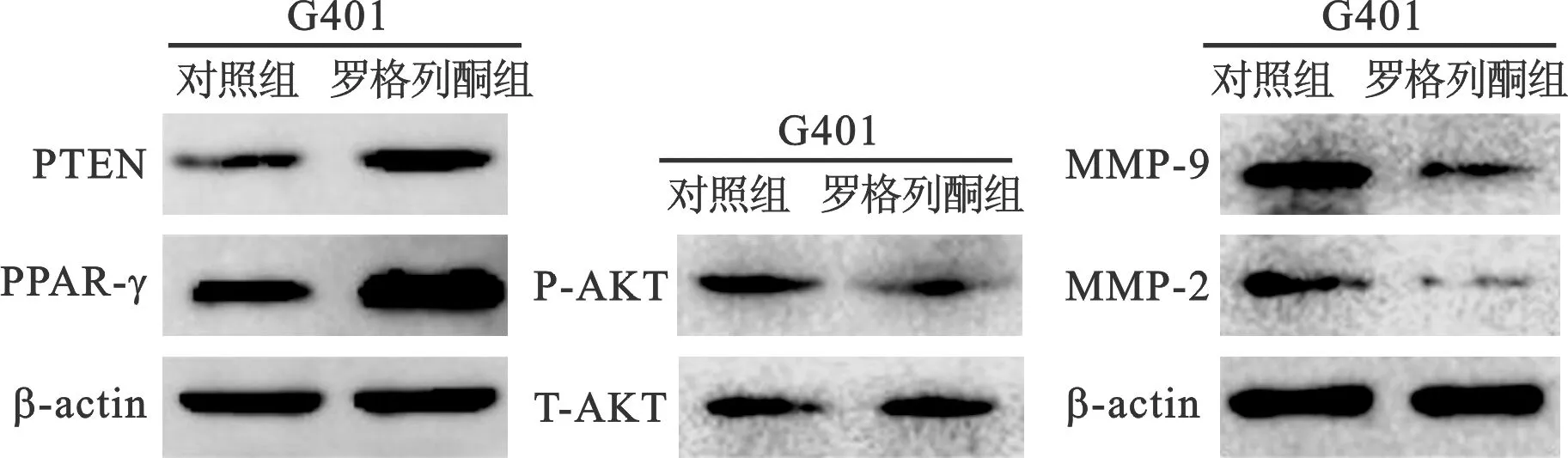
图4 罗格列酮对G401细胞PPAR-γ、PTEN、T-AKT、P-AKT、MMP-2、MMP-9蛋白水平的影响
5 罗格列酮对G401细胞PTEN、MMP-2、MMP-9mRNA表达水平的影响 见图5。RT-PCR检测结果显示,罗格列酮干预细胞后,PTEN mRNA的表达水平明显升高,MMP-2、MMP-9 mRNA的表达水平显著下降,差异有统计学意义(P<0.05)。

图5 罗格列酮对G401细胞PTEN、MMP-2、MMP-9mRNA表达水平的影响
讨 论
罗格列酮是一种高选择性、强效的PPAR- γ激动剂,它激活 PPAR-γ核受体后,可以促进葡萄糖合成、转运及胰岛素增敏,临床上多用于治疗2 型糖尿病[7]。近年来研究发现,罗格列酮对于多种肿瘤具有一定的抑制作用,如肝癌[8]、胰腺癌等。本试验证实罗格列酮可以抑制肾母细胞瘤G401细胞的增殖,进一步研究发现罗格列酮可以上调G401细胞的PPAR-γ的mRNA和蛋白表达水平,下调AKT的磷酸化水平。
PPAR-γ在细胞分化、增殖、生长、炎症、凋亡及血管形成等多方面中发挥重要作用。目前多项研究表明 PPAR-γ与肿瘤疾病关系密切,Han等[9]研究发现,罗格列酮可以通过激活 PPAR-γ依赖信号通路,即PTEN-PI3K/AKT信号通路抑制人肺癌细胞的增殖过程。PPAR-γ与配体结合后,可形成活性转录因子,再与类维甲酸核内受体RXR)形成转录复合体,最终与PPAR-γ反应活性原件(PPRE)结合,参与调控多种目的基因的转录,包括 PTEN 基因。PTEN 是一种内源性PI3K/AKT信号通路的调控因子,可通过PI3K介导的信号通路,发挥调控肿瘤细胞增殖、生长及凋亡的作用[10]。本试验中我们发现,罗格列酮可以激活PPAR-γ,上调其表达水平,进而从mRNA及蛋白水平上调PTEN的表达,提示罗格列酮可通过增加PTEN的转录和表达,抑制PI3K/AKT信号通路,从而发挥抑制肾母细胞瘤细胞增殖的作用。
MMPs是降解细胞外基质的重要成分,在肿瘤的侵袭及转移中发挥着重要的作用,特别是MMP-2和MMP-9[11]。本试验发现,罗格列酮可抑制G401细胞的迁移能力和侵袭能力;同时MMP-2、MMP-9的mRNA及蛋白表达水平均明显下调,提示罗格列酮可能通过下调MMP-2和MMP-9的转录和表达,从而抑制了G401细胞的迁移和侵袭能力。
综上所述,罗格列酮可抑制肾母细胞瘤细胞G401的增殖,并呈浓度和时间依赖效应;其分子机制可能与激活PPAR-γ,上调 PTEN、抑制PI3K/AKT信号通路有关。以上研究结果表明,激活PPAR-γ具有潜在的治疗肾母细胞瘤的作用,为研发新的靶向治疗药物提供了新的思路。
[1] Cozzi DA, Ceccanti S, Cozzi F. Comment on: Nephron-sparing surgery (NSS) for unilateral Wilms tumor (uWT): The SIOP 2001 experience[J]. Pediatr Blood Cancer,2015,62(8): 1489.
[2] Kharbanda C, Alam MS, Hamid H,etal. Antidiabetic effect of novel benzenesulfonylureas as PPAR-γ agonists and their anticancer effect [J]. Bioorg Med Chem Lett,2015,25(20): 4601.
[3] Liu YZ, Wu K, Huang J,etal. The PTEN/PI3K/Akt and Wnt/beta-catenin signaling pathways are involved in the inhibitory effect of resveratrol on human colon cancer cell proliferation[J]. Int J Oncol,2014, 45(1): 104-112.
[4] Roa I, de Toro G, Fernandez F,etal. Inactivation of tumor suppressor gene pten in early and advanced gallbladder cancer[J]. Diagn Pathol,2015,10: 148.
[5] Kato H, Duarte S, Liu D,etal. Matrix Metalloproteinase-2 (MMP-2) Gene Deletion Enhances MMP-9 Activity, Impairs PARP-1 Degradation, and Exacerbates Hepatic Ischemia and Reperfusion Injury in Mice[J]. PLoS One,2015,10(9): e0137642.
[6] Pang X,Wei Y,Zhang Y,etal. Peroxisome proliferator-activated receptor-gamma activation inhibits hepatocellular carcinoma cell invasion by upregulating plasminogen activator inhibitor-1[J]. Cancer Sci,2013,104(6): 672-680.
[7] Olefsky JM.Treatment of insulin resistance with peroxisome proliferator-activated receptor gamma agonists[J]. J Clin Invest,2014,106(4): 467-472.
[8] Shen B, Chu ES, Zhao G,etal. PPARgamma inhibits hepatocellular carcinoma metastases in vitro and in mice[J]. Br J Cancer,2012,106(9): 1486-1494.
[9] Han S, Roman J. Rosiglitazone suppresses human lung carcinoma cell growth through PPARgamma-dependent and PPARgamma-independent signal pathways[J]. Mol Cancer Ther,2006,5(2): 430-437.
[10] Li XJ, Li YZ, Jin CT,etal. Curcumin induces apoptosis by PTEN/PI3K/AKT pathway in EC109 cells[J]. Zhongguo Ying Yong Sheng Li Xue Za Zhi,2015,31(2): 174-1747.
[11] Meng F,Chen X,Song H,etal. LAPTM4B Down Regulation Inhibits the Proliferation, Invasion and Angiogenesis of HeLa Cells In Vitro[J]. Cell Physiol Biochem,2015,37(3): 890-900.
(收稿:2016-01-28)
▲通讯作者:西安交通大学第二附属医院
Wilms瘤 过氧化物酶体增生物激活受体-γ 磷脂酰肌醇3-激酶 基质金属蛋白酶 @罗格列酮
R737.11
A
10.3969/j.issn.1000-7377.2016.10.006
