苹果6-磷酸山梨醇脱氢酶基因启动子的转化及其转录活性
2016-11-10杨国婵谢银鹏马锋旺邹养军
杨国婵,谢银鹏,马锋旺,梁 东,邹养军
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
苹果6-磷酸山梨醇脱氢酶基因启动子的转化及其转录活性
杨国婵,谢银鹏,马锋旺,梁东,邹养军
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
【目的】 研究6-磷酸山梨醇脱氢酶基因启动子(S6PDHp)的组织表达特点。【方法】 利用Gateway技术构建了S6PDHp与GUS基因的融合表达载体,然后通过农杆菌介导法转化番茄“中蔬5号”,对转基因植株进行PCR检测,对鉴定为阳性的植株进行GUS组织化学染色,验证S6PDHp的组织表达特性。【结果】 将S6PDHp-GUS融合表达载体转化番茄,经PCR检测显示,成功获得了转S6PDHp基因的阳性番茄植株。对阳性植株各组织器官的GUS 化学染色和活性检测结果显示,除叶片外许多器官都有很强的GUS活性,且在转基因番茄成熟期植株的茎部活性最高,根部活性最低;叶片从新叶到老叶的各个时期,GUS活性持续降低。【结论】S6PDHp表达在植物衰老过程中降低;且在转基因番茄茎部的GUS活性最强,说明该启动子具有组织表达特异性。
苹果;6-磷酸山梨醇脱氢酶;启动子;转基因;GUS染色
山梨醇(Sorbitol)是大多数蔷薇科(Rosaceae)植物主要的光合产物,也是碳水化合物的主要转运形式和可溶性的贮藏碳水化合物,与其他植物中蔗糖的作用相似[1-2]。由于山梨醇具有许多重要的功能,因而植物体内生成山梨醇的关键酶6-磷酸山梨醇脱氢酶(Sorbitol-6-phosphate dehydrogenase,S6PDH;EC 1.1.1.200)受到了国内外学者的广泛关注。S6PDH可以催化葡萄糖-6-磷酸生成山梨醇-6-磷酸,再经6-磷酸山梨醇磷酸酶(Sorbitol-6-phosphatase,SorPP;EC 3.1.3.50)脱磷酸后生成山梨醇[2]。S6PDH参与的反应被认为是山梨醇合成的关键调控步骤[3-4]。编码S6PDH的基因序列现已获得[5-6]。有研究表明,S6PDH主要在叶片中表达,在果树其他部位中表达量很低。S6PDH的表达和酶活性与叶片“从库到源”的功能密切相关[7-8]。据此推测,S6PDH基因启动子可能具有在叶片(绿色)组织中高度表达(特异表达)的特性。
以往关于叶片(绿色)组织特异表达启动子的研究发现,多种植物中存在活化酶亚基RBCS(Rubisco small subunit)基因和桃的叶绿素A/B结合蛋白Cab(chlorophyll a/b-binding protein)基因,这些基因都在叶片和幼果等绿色组织中高表达,而在成熟果实、花和根等组织中表达量非常低。进一步研究发现,这些启动子都具有叶片(绿色)组织特异表达的特性[9-10]。
因此,本试验拟将S6PDH基因的启动子基因(S6PDHp),与GUS基因融合构建植物表达载体,利用农杆菌介导法将其转化到番茄中,然后检测转基因番茄各组织中的GUS蛋白含量,旨在为了解S6PDHp启动子的组织特异表达特性提供依据。
1 材料与方法
1.1材料
番茄品种“中蔬5号”,大肠杆菌TOP10购自天根公司,载体pDONR221(Kan)、pGWB433及农杆菌EHA105和S6PDHp菌液(含pMD-S6PDHp质粒)由本实验室保存。
DNA凝胶回收试剂盒DNA Gel Extraction Kit 购自天根公司,pMD18-T Vector 载体购自TaKaRa公司,DNA Marker DL2000、PCR Kit、BP Clonase Enzyme Mix和LR Clonase Enzyme Mix均购自Invitrogen公司,PCR引物合成、DNA测序由上海桑尼生物科技有限公司完成,EDTANa2、K4Fe(CN)6、DMSO、X-Gluc、Triton X-100、BCA蛋白试剂盒、凝胶用试剂及其他国产分析纯试剂均由本实验室购买保存。
1.2S6PDHp-GUS融合表达载体的构建
1.2.1目的基因的获得由于Gateway技术[11]中需要attB位点,设计attB-P(1F)A/S、attB-P(2F)A/S和attB A/S 3对引物(表1)。先从S6PDHp菌液中提取pMD-S6PDHp质粒,再以pMD-S6PDHp质粒为模板、attB-P(1F)A/S为第1对引物PCR扩增S6PDHp基因。PCR产物用1%琼脂糖凝胶进行电泳,切胶回收清晰的电泳条带,获得的DNA命名为attB-1F-S6PDHp。然后以attB-1F-S6PDHp为模板。attB-P(2F)A/S为第2对引物进行第二次PCR,获得2次扩增产物attB-2F-S6PDHp。再以2次扩增产物attB-2F-S6PDHp为模板、attB A/S为引物进行第3次PCR,获得最终携带attB位点的attB-S6PDHp产物。
以上所用到的PCR反应液(25 μL体系)组分为:2.5 μL 10×LATaqBuffer,2.0 μL Mg2+,1.0 μL DNA,0.5 μL dNTP,0.2 μL TaRaKa LATaq(10 U/μL),1.0 μL 引物,1.0 μL模板,16.8 μL ddH2O;PCR反应程序为:94 ℃预变性5 min;94 ℃变性60 s,52 ℃退火30 s;72 ℃延伸10 min,4 ℃保温。
1.2.2Entry载体的构建利用得到的attB-S6PDHp产物和pDONR221进行BP反应,用S6PDHp基因编码序列将pDONR221载体上的ccdB位点置换,构建成具卡那霉素(Kan)抗性的Entry载体。参照《分子克隆实验指南》中的转化方法将BP反应产物转化大肠杆菌感受态TOP10后,用含50 mg/L卡那霉素的LB固体培养基进行筛选。挑取转化所得的单菌落,在400 μL含50 mg/L卡那霉素的液体培养基中振荡培养4~6 h,对菌液进行PCR鉴定,阳性菌落扩大培养后提取质粒。
1.2.3表达载体的构建将获得的Entry载体质粒通过LR反应连接到pGWB433载体上,LR反应产物转化大肠杆菌感受态TOP10,在含有50 μg/mL 壮观霉素的LB平板上进行筛选,挑取单菌落振荡培养后进行PCR鉴定,将鉴定为阳性的菌液送去测序。提取菌液质粒,转化农杆菌感受态EHA105后备用。
1.3番茄的遗传转化及植株再生
番茄种子消毒处理后在无菌条件下播种于MS培养基上,28 ℃暗培养条件下发芽,发芽后在光照(2 000 lx,8 h)条件下生长,10 d左右可长出子叶,将子叶沿垂直于纵轴的方向平均切成两半,切好的材料放到预培养基中暗培养24 h后进行农杆菌侵染转化。将含有植物表达载体的农杆菌活化扩大培养,在加链霉素、利福平和壮观霉素的10 mL液体LB培养基中于28 ℃、200 r/min条件下振荡过夜培养。当菌液OD600 nm值为0.6时,用MSO稀释10倍,收集培养基上的子叶放在无菌培养皿中,然后加入携带目的基因的农杆菌菌液轻轻摇动共培养4~5 min,取出子叶后放在无菌滤纸上吸去多余菌液,再在共培养基(MS+2-4-D 0.1 mg/L+细胞分裂素 0.05 mg/L)上28 ℃暗培养3 d,将共培养的外植体转到含有50 mg/L卡那霉素的诱导培养基(MS+6-BA 2.0 mg/L+萘乙酸(NAA)0.05 mg/L)上。经2~3周继代后转到分化培养基上(MS+6-BA 1.0 mg/L+Kan 50 mg/L)进行再生抗性芽筛选,经筛选的再生抗性芽接到含有50 mg/L Kan的生根培养基(MS+NAA 0.1 mg/L) 上进行生根培养,待幼苗生长至2~3片真叶时,对幼苗进行锻炼,然后移栽到土里。
1.4转化植株的PCR检测
摘取抗性再生植株和未转化植株叶片,用CTAB法提取其基因组DNA,分别用attB A/S这对引物进行PCR扩增,25 μL体系中rTaq12.5 μL、ddH2O 9.5 μL、模板DNA 1 μL、上下游引物各1 μL。反应条件:94 ℃总变性8 min;94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸150 s,共进行38个循环;72 ℃延伸10 min,PCR产物用1%琼脂糖凝胶电泳进行检测。
1.5S6PDHp转化番茄植株各组织GUS表达的检测
1.5.1组织化学染色(1)将抗性转化番茄植株的根、茎、叶、花、青果和红果分别置于灭菌培养皿中,加入 GUS 染色液(10.0 mmol/L EDTANa2,100 mmol/L NaH2PO4·H2O,0.1%Triton X-100,0.5 mmol/L K4Fe(CN)6·3H2O,0.5 mg/mL X-Gluc;X-Gluc用 DMSO 溶解,染色液配好后用 0.22 μmol/L 滤膜过滤,-20 ℃保存备用),浸没抗性番茄各组织材料,置于 37 ℃培养 24 h;(2)弃去染色液后加入体积分数70%乙醇,浸没试验材料,于 37 ℃培养 6 h;(3)弃去体积分数70%乙醇后加入体积分数90%乙醇,浸没试验材料,于 37 ℃培养 10 h;(4)弃去体积分数90%乙醇后进行观察及照相。
1.5.2GUS 活性测定参照 Jefferson[12]的方法,对非转基因番茄和转基因番茄的根、茎、新叶、成熟叶、老叶、花、红果、青果各个组织提取蛋白进行GUS活性分析,重复3次,结果用“平均值±标准差”表示。本试验中的计算公式为:GUS活性=(4-MU含量)÷总蛋白含量÷反应时间;总蛋白含量=0.017x+0.273(R2=0.999),4-MU含量=(x1-x2)÷3.927 5(R2=0.998),x1指反应结束后的荧光值,x2指初始反应时的荧光值。
2 结果与分析
2.1S6PDHp片段加入attB位点的克隆
用attB-P(1F)A/S、attB-P(2F)A/S和attB A/S 3对引物,依次对每轮PCR克隆产物进行扩增,克隆产物见图1。将含有attB全位点的attB-S6PDHp片段进行回收,用于下一步BP反应及构建Entry载体。
2.2S6PDHp-GUS融合表达载体的构建
用加入attB全位点的S6PDHp片段与Entry载体pDONR221进行BP反应,反应产物转化大肠杆菌感受态TOP10,在含有卡那霉素的LB固体培养基上进行筛选,得到单菌落,然后进行PCR鉴定获得阳性菌落;用阳性菌落扩大培养并提取质粒,然后与目的载体pGWB433进行LR反应,转化大肠杆菌感受态TOP10,在具有壮观霉素的LB固体培养基上进行筛选,得到单菌落后进行PCR检测获得阳性菌落;将阳性菌落进行测序,结果表明已经成功构建了含有GUS基因的植物表达载体pGWB433-S6PDHp。载体构建的Gateway过程见图2。

图 1苹果6-磷酸山梨醇脱氢酶基因启动子S6PDHp片段的PCR扩增
1~5.S6PDHp基因的扩增;6.S6PDHp基因加上attB 全位点后的PCR扩增;M.DNA Marker
Fig.1Amplification of Sorbitol-6-phosphate dehydrogenase gene promoter (S6PDHp) of apple
1-5.Gene amplification ofS6PDHp;6.Full site ofS6PDHpplus attB gene;6.DNA Marker

图 2S6PDHp与GUS基因融合植物表达载体的构建流程
B.attB位点碱基序列
Fig.2Construction process of plant fusion expression vector from S6PDHp and GUS
B.Nucleotide sequence of attB
2.3农杆菌转化番茄及转基因植株的PCR检测
为了进一步验证S6PDHp基因启动子在植物各个组织器官中的表达情况,将构建好的pGWB433-S6PDHp融合载体提取质粒转化农杆菌EHA105感受态,利用农杆菌介导法对番茄进行转化,番茄子叶经含有S6PDHp-GUS质粒的农杆菌侵染后,共培养3 d,再在含有50 mg/L Kan的诱导培养基上进行筛选培养,2~3周后形成了抗性愈伤组织,再将抗性愈伤组织继代转到分化培养基上,这时可见有少数愈伤组织逐渐分化出芽,当抗性植株生长至3~4片真叶时转入生根培养基进行诱导生根,然后将生根的转基因番茄苗移栽到土里,获得转基因番茄抗性苗(图3)。
用attB引物对获得的转基因番茄植株进行PCR检测,凝胶电泳结果(图4)表明,共有3株番茄成功转入了S6PDHp基因。
2.4S6PDHp基因转化植株各组织器官中的表达活性检测
GUS染色试验发现,转基因番茄根部没有被染成蓝色,茎、叶、花、青果、成熟红果都被染成蓝色,说明启动子在转基因番茄的根部没有活性,而在茎、叶、花、青果、红果中都有活性(图5)。
从图6可以看出,转基因番茄成熟期GUS活性在根部最低,茎部最高;叶片在生长过程中新叶的GUS活性最高,成熟叶次之,老叶中GUS活性最低,几乎为零;青果的GUS活性比红果高。尽管新叶、花、红果GUS活性比茎低,但是这些组织在转基因植株与非转基因植株中的GUS活性差异比茎的差异高。

图 3转S6PDHp基因番茄植株的获得
a.播种10 d左右的番茄;b.子叶在预培养基上暗培养24 h;c.摇菌悬浮;d、e.侵染4~5 min,黑暗共培养3 d;f.转入2ZR诱导培养基;g.继代分化;h.转入生根培养基;i.生根;j.移栽苗;k.转大盆生长;l.转基因番茄开花;m.转基因番茄结果
Fig.3Transgenic process of tomato plants
a.10 day after planting tomato seeds;b.Pre-culture 24 h of the cut cotyledon;c.Shaking suspension bacteria;d,e.Impregnation 4-5 min and suspension 3 days in dark;f.Turning to 2ZR induction medium;g.Subculture differentiation;h.Turning to rooting medium;i.Rooting;j.Transplanting seedlings;k.Transferred to the large pan;l.Transgenic tomato blossom;m.Transgenic tomato results

图 4转S6PDHp基因再生番茄植株的PCR检测
M.DNA Marker;P.质粒DNA;N.未转基因番茄再生植株;1~9.转基因番茄再生植株
Fig.4PCR detection of transgenic tomato plants
M.DNA Marker;P.Plasmid;N.Non-transgenic tomato;1-9.Transgenic tomato plants

图 5 非转基因与转S6PDHp基因番茄各个组织器官中GUS融合载体的表达
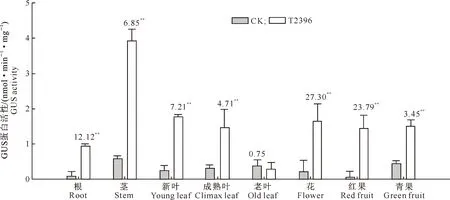
图 6 非转基因番茄(CK)与转S6PDHp基因番茄(T2396)各个组织中的GUS酶活性分析
3 讨 论
基因表达调控是分子生物学研究的热点之一,启动子是一段提供RNA聚合酶识别和结合的DNA序列,位于基因的上游,一旦RNA聚合酶定位并结合于启动子的序列上,即可开始启动子转录[13]。启动子是基因的一个组成部分,控制着基因表达的起始时间和表达程度,就像“开关”,决定着基因的活动,因此对启动子的研究是必不可少的。对启动子功能的分析主要是通过生物信息学预测和试验相结合来进行的。目前,生物技术越来越多地应用于农业作物的育种中,例如:将一些抗逆性基因在可行的情况下转基因到目的作物上,由于转进作物的基因过量表达,因此有必要研究启动子的组织特异性。有了固定的组织特异表达启动子,就可以利用它使目的基因在植物特定部位进行表达。例如:可以根据昆虫进食特点,让抗虫基因在植物的叶片或者幼果中表达[14-19]。
本研究采用番茄作为模式植物进行转基因,其优势在于可以完整观察到启动子在植物的根、茎、叶、花、果实、种子中的活性。S6PDHp与GUS融合载体转化番茄及番茄植株再生的结果表明,试验中所用的番茄转基因体系适用于“中蔬5号”这一番茄品种;另外,番茄抗性植株的PCR法检测中,有多数番茄抗性苗均呈现假阳性现象,造成这种现象的原因,推测是由于Kan选择浓度不足所致。
本研究为了确定S6PDHp的组织特异性表达特点,对PCR检测为阳性的转基因番茄成熟植株的各个组织进行了GUS化学染色和活性分析,结果表明:该启动子在茎、叶、花、果实中都具有活性,但是活性不同,说明该启动子在不同的组织中有特异性表达特性;在新叶、成熟叶、老叶GUS酶活测定中发现,启动子活性在新叶中是最强的,在老叶中几乎没有活性;果实青果中的GUS活性高于红果,由此可以得出,该启动子在生长活力越强的组织中活性越高。前期有研究表明,S6PDHp主要在叶片中表达,在其他部位中表达量很低。然而本试验中S6PDH基因的启动子在转基因番茄除了根以外的各个组织中均有活性,且未表现出叶片中活性最高的特点,说明S6PDH基因的表达或许还受其他因素影响,这有待深入研究。
4 结 论
通过Gateway技术成功构建了S6PDHp的GUS基因融合表达载体,利用农杆菌侵染法转化番茄,成功得到了阳性转基因番茄植株,这为以后探究S6PDH中顺式元件的功能提供了具体的转化体系。通过对阳性转基因番茄植株的各个组织器官进行GUS组织化学染色和GUS活性分析发现,该启动子在除根部以外的其他组织器官中均有不同程度的活性,S6PDHp在老叶部分的活性最弱,在茎部活性最强,说明该启动子在植物衰老过程中表达降低,且具有组织表达特异性;这为解决组成型启动子在植物中过量表达所带来的危害提供了依据。
[1]Loescher W H.Physiology and metabolism of sugar alcohols in higher plant [J].Physiology Plantarum,1987,70:553-557.
[2]Zhou R,Cheng L L,Wayne R.Purification and characterization of sorbitol-6- phosphate phosphatase from apple leaves [J].Plant Science,2003,165:227-232.
[3]Teo G,Suzuki Y,Uratsu S L,et al.Silencing leaf sorbitol synthesis alters long-distance partitioning and apple fruit quality [J].Proceedings of the National Academy of Sciences of the United States of America,2006,103:18842-18847.
[4]Cheng L L,Zhou R,Reidel E J,et al.Antisense inhibition of sorbitol synthesis leads to up-regulation of starch synthesis without altering CO2assimilation in apple leaves [J].Planta,2005,220:767-776.
[5]Kanayama Y,Mori H,Imaseki H,et al.Nucleotide sequence of a cDNA encoding sorbitol-6-phosphate dehydrogenase from apple [J].Plant Physiology,1992,100:1607-1608.
[6]梁东.苹果山梨醇代谢相关基因的分子特性研究 [D].陕西杨凌:西北农林科技大学,2010.
Liang D.Cloing and characteristics of genes involved in sorbitol metabolism from apple [D].Yangling,Shaanxi:Northwest A&F University,2010.
[7]Sakanishi K,Kanayama Y,Mori H,et al.Expression of the ge-ne for NADP-dependent sorbitol-6-phosphate dehydrogenase in peach leaves of various developmental stages [J].Plant & Cell Physiology,1998,39:1372-1374.
[8]Suzue Y,Tsukuda M,Hatano S,et al.Change in the activity and gene expression of sorbitol- and sucrose-related enzymes with leaf development of ‘La France’ Pear [J].Journal of Japanese Society Horticulture Science,2006,75(1):45-50.
[9]Suzuki Y,Kaori N,Ryuichi Y,et al.Differences in expression of the rbcs multigene family and RuBisCo protein content in various rice plant tissues at different growth stages [J].Plant & Cell Physiology,2009,50:1851-1855.
[10]Bassett C L,Callahan A M,Artlip T S,et al.A minimal peach type Ⅱ chlorophyll a/b-binding protein promoter retains tissue-specificity and light regulation in tomato [J].BMC Biotechnology,2007,7:47.
[11]Tsuyoshi N,Sumie I,Tetsuya K.Gateway vectors for plant tr-ansformation [J].Plant Biotechnology,2009,26:275-284.
[12]Jefferson R.Assaying chimeric genes in plants:the GUS gene fusion system [J].Plant Molecular Biology Reporter,1987,5:387-405.
[13]苏宁,孙萌,李轶女,等.水稻叶绿体16S启动子克隆改造、载体构建及转化研究 [J].植物学通报,2003,20(3):295-301.
Su N,Sun M,Li Y N,et al. Isolation and modification of rice chloroplast 16S promoter,construction of expression vector and transformation [J].Bulletin of Botany,2003,20(3):295-301.
[14]Abiaka C,Olusi S,Simbeye A.Serum concentrations of micronutrient antioxidants in an adult Arab population [J].Asia Pac J Nutr,2002,11(1):22-27.
[15]刘莉.水稻叶片衰老特异性启动子的克隆和利用及剑叶旱期衰老上升表达基因的鉴定 [D].武汉:华中农业大学,2008.
Liu L.Cloning and application of a senescence-specific promoter in rice leaf and identification of early senescence-associated genes in flag leaves [D].Wuhan:Huazhong Agricultural University,2008.
[16]Grant C R,Tomap R.Sorbitol metabolism by apple seedings [J].Phytochemistry,1981,20(7):1505-1511.
[17]周丹红.番茄红素的提取、纯化、稳定性及微胶囊化的研究 [D].合肥:合肥工业大学,2006.
Zhou D H.Studies on lyeo peneand its extraction,purification,stability and microenea psulation [D].Hefei:Hefei University of Technology,2006.
[18]De Block M,Botterman J,Vandewiele M,et al.Engineering he-rbicide resistance in plants by expression of a detoxifying enzyme [J].EMOBO J,1987,6(9):2513-2518.
[19]Fillatti J J,Haissig B M,Brent M,et al.Development of glyp-hosatetoleram populus plants through expression of amutant aroagene fromSalmonellatyphimurium[J].Basic Life Sci,1998,44:243-249.
Transformation and transcriptional activity of sorbitol-6-phosphate dehydrogenase promoter of apple
YANG Guochan,XIE Yinpeng,MA Fengwang,LIANG Dong,ZOU Yangjun
(CollegeofHorticulture,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study investigated the tissue-specific expression of sorbitol-6-phosphate dehydrogenase gene promoter (S6PDHp).【Method】 TheS6PDHpsequence was fused with the GUS reporter gene to construct plant reporter vector.Then,the plant reporter vector was introduced into tomato via Agrobacterium-mediated transformation.PCR detection of the transgenic plants was conducted and tissue-specific expression ofS6PDHpin positive plants were validated by GUS histochemical staining.【Result】 PCR results showed that the transgenic plants were obtained successfully.In transgenic tomato maturity plant,GUS activity assays indicated that the expression of GUS was highly active in stem while that in root was the lowest.The GUS activity was stronger than that of control plants.New leaf blade to the repressive period of old leaves,GUS activity was reduced.【Conclusion】 Promoter expression in plants reduced and GUS activity in transgenic tomato stems was the strongest.The obtainedS6PDHpfragment expressed specifically in transgenic tomato.
apple;sorbitol-6-phosphate dehydrogenase;promoter;transgenic;GUS staining
时间:2016-08-0909:41DOI:10.13207/j.cnki.jnwafu.2016.09.022
2015-03-16
国家自然科学基金项目“苹果6-磷酸山梨醇脱氢酶基因启动子的功能分析与应用”(31201600);国家苹果产业技术体系项目“生物技术与抗性育种”(CARS-28);国家科技支撑计划项目“主要仁果类果树新品种选育”(2013BAD02B01)
杨国婵(1989-),女,山西运城人,在读硕士,主要从事苹果分子育种研究。E-mail:836942031@qq.com
邹养军(1969-),男,陕西乾县人,副教授,硕士生导师,主要从事果树生理生态及育种与生物技术研究。
E-mail:yangjunzou@126.com
S661.1
A
1671-9387(2016)09-0166-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160809.0941.044.html
