芍药苷对HepG2肝癌细胞凋亡的诱导作用
2016-10-27张亚武权柯
张亚武,权柯
1兰州大学第二医院胆胰外科,甘肃兰州730000;2甘肃中医药大学
芍药苷对HepG2肝癌细胞凋亡的诱导作用
张亚武1,权柯2
1兰州大学第二医院胆胰外科,甘肃兰州730000;2甘肃中医药大学
目的:探讨芍药苷(Paeoni florin)对H epG 2肝癌细胞凋亡的诱导作用,并考察其作用机制。方法:用不同浓度芍药苷(0.5,2 m g/m L)对HepG 2肝癌细胞进行培养,采用MTT法检测细胞活力,酶标法检测Caspase 3活性,western blot法检测N F-κB信号通路相关蛋白表达。结果:随着给药浓度的增加,芍药苷能逐渐降低H epG 2肝癌细胞活力,在48小时抑制率最高;并能提高Caspase 3活性,抑制细胞核内N F-κB p65磷酸化,IκBα磷酸化,从而促进细胞凋亡。结论:芍药苷可能通过N F-κB信号通路诱导H epG 2肝癌细胞凋亡,达到抗肿瘤效果。
HepG 2肝癌细胞;凋亡;NF-κB信号通路;磷酸化;芍药苷
肝癌是常见的恶性肿瘤之一,目前其主要治疗手段为手术,但术后易复发,转移率较高。因此,寻求有效治疗肝癌,降低复发率的药物成为研究热点。
芍药苷(Paeonif1orin,PF)是从毛茛科植物芍药(Paeonia Lactiflora Pa11)中提取的有效单体成份,能抗各种肿瘤活性[1-4]。已有报道芍药苷可上调Bax,p53表达,下调Bc1-2表达,促进HepG2肝癌细胞凋亡[1],但其具体机制尚不可知。并且芍药苷可通过抑制NF-κB信号通路,抑制胃癌细胞增殖[2-3],本研究在此基础上探讨芍药苷是否通过抑制NF-κB信号通路来诱导HepG2肝癌细胞凋亡。
1 材料与方法
1.1细胞系与药物HepG2肝癌细胞购自美国标准生物品收藏中心(ATCC),细胞培养在含10%胎牛血清的DMEM培养基中。芍药苷购自中国药品生物制品检定所。
1.2试剂与仪器四唑盐试剂(MTT)(sigma公司);BCA法蛋白定量试剂盒(碧云天生物技术研究所);ECL超敏发光液(碧云天生物技术研究所);小鼠p65抗体(碧云天生物技术研究所);β-actin(碧云天生物技术研究所);兔IκBα抗体(Epitmics公司);兔抗pp65抗体(Epitmics公司);Caspase 3分光光度法检测试剂盒(南京凯基生物技术有限公司);胎牛血清(Gbico公司);DMEM培养基(Gbico公司);CO2培养箱(Thermo Scientific公司);超净工作台(Thermo Scientific公司);Tecan Infinite F200/M200型多功能酶标仪(瑞士TECAN集团公司);ChemiDocTM XRS凝胶成像系统(Bio-Rad公司)。
1.3方法
1.3.1MTT实验将80%左右融合的HepG2肝癌细胞,消化,细胞浓度调整为4×103个/mL,接种,37℃5% CO2培养箱中培养24小时。加入含PF,终浓度为0.5、1、2mg/mL的DMEM培养基中,继续培养24、48、72小时,加MTT(5mg/mL)20μL,培养4小时后弃上清,加DMSO 150 μL,10分钟左右后570 nm处测定OD值。计算药物对细胞生长的抑制率。
1.3.2Caspase 3酶活性检测将80%左右融合的HepG2肝癌细胞,消化,细胞浓度调整为4×103个/mL,接种,37℃5%CO2培养箱中培养48小时。加入含PF,终浓度为0.5、1、2 mg/mL的DMEM培养基中,按照Caspase 3酶活性检测试剂盒说明书进行操作,收集细胞,裂解,加底物,显色,于405 nm处测定吸光度。
1.3.3w est ern bl ot收集细胞,加入RIPA裂解液,收获蛋白。根据BCA试剂盒对蛋白浓度进行测定。跑SDS凝胶电泳,后湿法砖膜。孵一抗过夜,二抗1小时后,在膜上滴加ECL曝光液,在凝胶成像系统中曝光。用“Quantity one”软件对各抗体条带灰度值进行统计。
1.4统计学方法数据采用SPSS 17.0软件统计分析。计量资料以(±s)表示,采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1芍药苷对H epG 2肝癌细胞增殖抑制作用随着给药浓度的增加,芍药苷对HepG2肝癌细胞抑制作用逐渐增强,在2 mg/mL时抑制率最大;随着24、48、72小时给药时间的增加,芍药苷对HepG2肝癌细胞抑制作用也逐渐增强,其中48、72小时作用强度一致,所以在后续实验中选取48小时作为给药浓度,见表1。
表1 芍药苷对H epG 2肝癌细胞增殖抑制作用(±s)
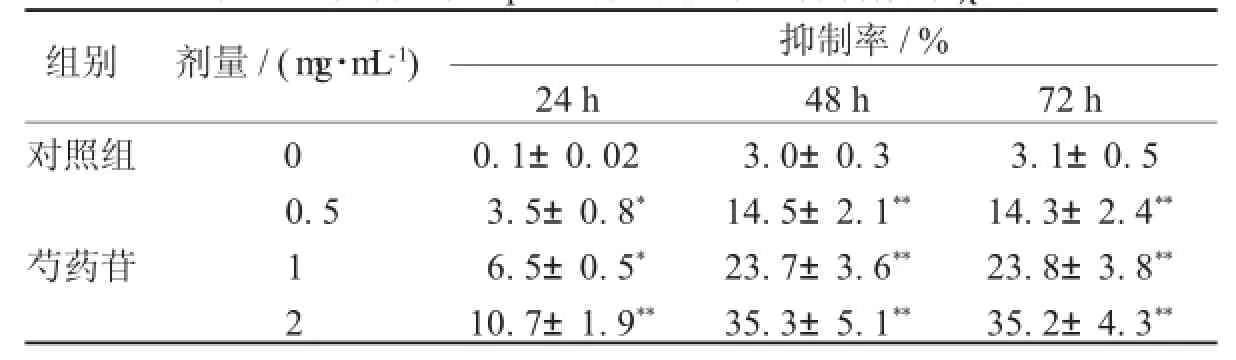
表1 芍药苷对H epG 2肝癌细胞增殖抑制作用(±s)
注:与前一剂量组比较,*表示P<0.05,**表示P<0.01。
组别剂量/(m g·m L-1)抑制率/% 24 h48 h72 h对照组00.1±0.023.0±0.33.1±0.5 0.53.5±0.8*14.5±2.1**14.3±2.4**芍药苷16.5±0.5*23.7±3.6**23.8±3.8**2 10.7±1.9**35.3±5.1**35.2±4.3**
2.2芍药苷对HepG 2肝癌细胞Caspase 3活性的影响芍药苷(0.5、1、2 mg/mL)能提高HepG2肝癌细胞Caspase 3活性,并呈剂量依赖性,差异具有统计学意义(P<0.01),见图1。
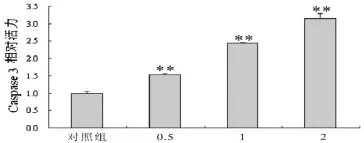
图1 芍药苷对HepG 2肝癌细胞Caspase 3活性的影响
2.3芍药苷对HepG 2肝癌细胞NF-κB通路的影响芍药苷能抑制HepG2肝癌细胞细胞核NF-κB p65蛋白磷酸化,并呈剂量依赖性,差异具有统计学意义(P<0.05),而对细胞核内p65表达无任何影响,差异无统计学意义(P>0.05)。因此继续探讨NF-κB p65上游蛋白的影响,结果发现芍药苷能抑制HepG2肝癌细胞IκBα蛋白磷酸化,并呈剂量依赖性,差异具有统计学意义(P<0.05),但对IκBα自身表达无任何影响,见图2。
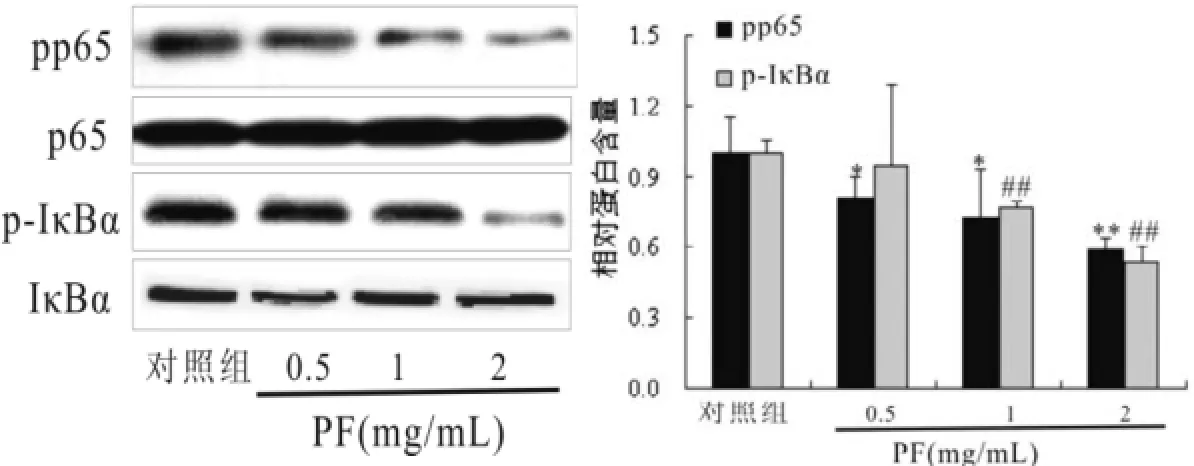
图2 芍药苷对H epG 2肝癌细胞N F-κB通路的影响
3 结论
肝癌是常见的恶性肿瘤之一,其危害仅次于肺癌,目前其主要治疗手段为手术,但即使获得手术切除机会,其复发、转移率依然较高[5-9]。因此,寻求有效治疗肝癌,降低复发率的药物成为当务之急。而抗肿瘤药物包括化疗药物、激素、生物制剂都能引起肿瘤细胞发生调亡。凋亡对肿瘤的抑制起重要作用,并且抑制NF-κB活性促进细胞凋亡是治疗肿瘤的有效手段之一[10]。芍药苷可通过抑制NF-κB信号通路来抑制胃癌细胞增殖[2-3],所以本研究拟尝试用不同浓度(0.5、1、2 mg/mL)芍药苷对HepG2肝癌细胞进行培养,结果表明随着给药浓度的增加,芍药苷可逐渐降低细胞活力,抑制肿瘤细胞的增殖,在48小时时抑制率达到最高点。
Caspase 3是caspase家族中最重要的凋亡执行者之一,其被合成后通常以非活化的酶原形式存在于细胞质中,在多种凋亡信号刺激下经蛋白水解作用被激活成活化形式,可对多种蛋白底物进行降解,在细胞凋亡过程中起关键作用,被认为是整个凋亡级联反应的一个关键调节点[11]。Caspase 3在HepG2肝癌细胞中活性高于给药组[12-14],在本研究中,与对照组比较,芍药苷(0.5、1、2 mg/mL)呈剂量依赖性抑制Caspase 3活性。
NF-κB是一类广泛存在于肿瘤细胞内的重要转录因子,是多信号转导途径的汇聚点,参与组织细胞的免疫调节,炎症反应,生长分化和凋亡等[15-16]。未受刺激时与IκB结合,当受到刺激时,IκB磷酸化,释放NF-κB,使之恢复转录活性并从细胞质转移到细胞核内,调节相关基因的表达。NF-κB在各种肿瘤细胞中均过表达[17],朱开梅等[18]报道八角中莽草酸可通过抑制NF-κB p65活性,抑制人肝癌HepG2细胞增殖。本研究结果表明芍药苷能抑制HepG2肝癌细胞NF-κBp65,IκBα蛋白磷酸化,最终提高Caspase 3活性,诱导肿瘤细胞凋亡。
因此,芍药苷可能通过NF-κB信号通路,提高Caspase 3活性,促进HepG2肝癌细胞的凋亡。
[1]晏雪生,李瀚旻,彭亚琴,等.芍药苷对人肝癌细胞Hep-G2凋亡及其调控基因的影响[J].中华中医药学刊,2007,25(7): 1346-1347.
[2]方申存,戴伟,吴昊,等.芍药苷对人胃癌SG C7901/V CR细胞增殖抑制作用及其机制研究[J].南京医科大学学报:自然版,2010,30(5):636-640.
[3]Fang S,Zhu W,Zhang Y,et al.Paeoni florin modulates multi drug resistance of a human gastric cancer cell line vi a the inhibition of NF-κB activation[J].Mol Med Rep,2012,5(2):351-356.
[4]Lu JT,He W,SongSS,et al.Paeoni florin inhibited the tumor invasion and metastasis in human hepato cellular carcinoma cells[J].Brat is l Lek Listy,2014,115(7):427-433.
[5]郭明,伍周玲,王春歌,等.黄芩苷-金属配合物的合成及其抗肿瘤活性研究[J].药学学报,2014,49(3):337-345.
[6]吴菲,林国桢,张晋昕.我国恶性肿瘤发病现状及趋势[J].中国肿瘤,2012,21(2):81-85.
[7]魏沙.2002—2010年我国城市恶性肿瘤死亡率变化趋势分析[J].实用预防医学,2013,20(1):111-113.
[8]李钟声.原发性肝细胞癌的治疗进展[J].安徽医学,2009, 30(7):830-832.
[9]蔡欣然,黄长玉,周良艺.原发性肝癌根治术后不同复发时期高危因素及疗效研究[J].实用肿瘤杂志,2010,25(5): 560-563.
[10]Baud V,Karin M.Is N F-kappaB a good target for cancer therapy?Hopes and pitfalls[J].Nat Rev Drug Discov,2009,8(1):33-40.
[11]Porter A G,Janicke RU.Emerging roles of caspase-3 in apopt os is[J].Cell Death Differ,1999,6(2):99-104.
[12]Xiang Q,M aY,Dong J,et al.Carnosic acid induces apopt osi s associ at ed with mit ochondri al dysfuncti on and Akt inact i vation in HepG 2 cell s[J].Int J Food Sci Nutr,2015,66(1):76-84.
[13]Zhang H,Guo Z,Han L,et al.The antitumor effect and mechanism of tai pei ni ne A,a new C19-dit erpenoid al kal oi d fr om Aconi tumt ai pei cum,on the HepG 2 hum an hepat ocel l ul ar carci nom a cel l l i ne[J].J BU O N,2014,19(3):705-712.
[14]Sudan S,Rupasi nghe H P.Fl avonoi d-enri ched appl e fraction A F4 i nduces cell cycle arrest,DNA topoisomerase II inhi bition,and apoptosis in human liver cancer HepG 2 cells[J].Nutr Cancer,2014,66(7):1237-1246.
[15]Zhang Y H,Yan HQ,Wang F,et al.TIPE2 inhi bits TN F-α i nduced hepatocellular carcinoma cell metastasis via Erk1/2 downregul at i on and N F-κB activation[J]. Int J Oncol,2015,46(1):254-264.
[16]Shan RF,Zhou Y F,Peng A F,et al.Inhi bition of Aurora-B suppresses H epG 2 cell invasi on and migration via the PI3K/A kt/N F-κB si gnaling pathway in vitro[J]. Exp Ther Med,2014 8(3):1005-1009.
[17]崔嵩,刘学锋,吴斌.N F-κB在肿瘤中的研究进展[J].现代肿瘤医学,2009,17(1):134-137.
[18]朱开梅,顾生玖,顾小文,等.八角中莽草酸对人肝癌H epG 2细胞增殖及N F-κB蛋白表达的影响[J].中国实验方剂学杂志,2014,20(1):126-129.
Apoptotic Induction Effects of Paeoniflorin on Hepatoma Carcinoma Cells
ZHANG Yawu1,QUAN Ke2
1 Biliary Pancreatic Surgery Department of Lanzhou University Second Hospital,Lanzhou 730000,China;2 Gansu University of Traditional Chinese Medicine
Objective:To explore apoptotic induction effects of paeoniflorin on hepatoma carcinoma cells(HepG2),and to investigate its mechanism.Methods:HepG2 cells were cultivated with different concentrations of paeoniflorin(0.5,2 mg/mL),cell viability was detected by MTT method,Caspase 3 activity measured by enzyme linked immunosorbent assay and the expression of NF-κB signaling pathway related protein by western blot method. Results:As the concentrations of the drug increased,paeoniflorin could decrease the viability of HepG2 cells gradually,and the inhibition rate reached the highest within 48 hours;it increased Caspase 3 activity,inhibited the phosphorylation of NF-κB p65 and IκBα,thereby to promote cellular apoptosis.Conclusion:Paeoniflorin could obtain anti-tumor effects by inducing the apoptosis of HepG2 cells via NF-κB signaling pathway.
hepatoma carcinoma cells;apoptosis;NF-κB signaling pathway;phosphorylation;paeoniflorin
R735.7
A
1004-6852(2016)05-0023-03
2015-02-19
张亚武(1971—),男,硕士学位,副主任医师。研究方向:消化道肿瘤的诊治。
