XAV939对卵巢癌细胞侵袭迁移的影响及Wnt/β-catenin信号的抑制作用
2016-10-26汪彩霞
汪彩霞,陈 说,赵 杨
XAV939对卵巢癌细胞侵袭迁移的影响及Wnt/β-catenin信号的抑制作用
汪彩霞1,陈说2,赵杨2
目的探讨XAV939对卵巢癌细胞侵袭转移方面的影响及其对Wnt/β-catenin信号转导途径的抑制作用。方法采用MTT法检测XAV939对卵巢癌细胞活力的抑制作用,划痕实验观察XAV939对细胞迁移能力的影响,Transwell细胞迁移实验检测XAV939对卵巢癌细胞侵袭转移的影响,Westernblot方法检测wnt1、β-catenin、TCF4蛋白以及基质金属硫蛋白9(Metallothioneinmatrixprotein,MMP9)的表达水平。结果XAV939作用48h后,抑制率明显上升,尤其浓度达到8μmol/L(31%±1%,P=0.034)、16μmol/L(51%±4%,P=0.028),且划痕和Transwell实验结果显示XAV939能抑制卵巢癌的侵袭和转移。此外,westernblot结果显示,wnt1、β-catenin、TCF4、MMP9的表达水平均有所降低。结论XAV939通过Wnt/β-catenin信号通路来抑制卵巢癌细胞的侵袭和迁移。
卵巢癌;XAV939;Wnt/β-catenin信号转导通路; 侵袭迁移
近年来,卵巢癌是危及女性健康的恶性肿瘤,居女性生殖系统恶性肿瘤的第2位[1]。尽管手术切除和化学疗法取得了一定的疗效,但是卵巢癌的侵袭转移成为患者高病死率居高不下的根源。卵巢癌的侵袭和转移是多基因多因素作用的过程。临床试验表明,卵巢癌的发生与基因突变和信号转导通路的失调有着密切的关系。越来越多的证据显示,wnt/β-catenin信号通路与肿瘤的发生发展联系紧密。因此,针对β-catenin基因的靶向治疗已经成为这一领域的研究热点。XAV939是Wnt/β-catenin信号通路的小分子抑制药[2],在肝癌[3]、神经母细胞瘤[4]等癌症中研究甚多。在胃癌研究[5]中认为,它可以抑制肿瘤的发生发展,但是在卵巢癌的研究中比较少见。本实验采用XAV939作用于卵巢癌细胞,探究其对卵巢癌侵袭迁移的影响,从而为临床卵巢癌的治疗提供依据。
1 材料与方法
1.1实验材料卵巢癌细胞系OVCAR3购自ATCC细胞库(美国)。XAV939购自上海惠诚生物科技有限公司,MTT购自Amresco,Transwell培养板购自BD公司(美国),RPMI1640购自Hyclone公司。β-catenin和Wnt1购自Santacruzbiotechnology,MMP9和TCF4购自Proteintech。
1.2实验方法
1.2.1细胞培养OVCAR3细胞用含10%的胎牛血清的RPMI1640培养液置37 ℃恒温、5%CO2、饱和湿度的条件下培养。1~2d换液传代1次,当细胞处于对数生长期进行实验。
1.2.2MTT法测定IC50收集对数期细胞,以3×103个/孔接种于96孔板,置于5%CO2,37 ℃孵箱中孵育过夜,加入不同浓度(0、0.125、0、25、0.5、1、2、4、8、16、32μmol/L)XAV939,同时设1个对照组(DMSO)和1个空白组,每组设3个复孔,培养48h。然后,每孔加入20μl0.5%MTT溶液,继续培养4h。弃去培养液,每孔加入150μlDMSO,于490nm波长处测定吸光度值。
1.2.3划痕试验取对数生长期的细胞接种于6孔板中,大约5×105/(ml·孔)。待细胞单层铺满培养基时,用200μl的Tip头进行划痕。用PBS清洗细胞2~3次,去除细胞碎片。并在实验组加入不同浓度的XAV939。置于37 ℃,5%CO2的条件下进行培养,分别在0、48h取样拍照。
1.2.4Transwell试验在已铺好胶Transwll的下室加入500μl含10%的胎牛血清RPMI1640培养液,上室加入200μL无血清的细胞悬浮液(2.5×105个/ml)及不同浓度梯度的XAV939,并放置在37 ℃,5%CO2进行孵育24h。然后,用4%多聚甲醛溶液固定20min,PBS清洗后用0.1%结晶紫染色,于Olympus倒置荧光显微镜下观察计算穿过Matrigel聚合胶及小室微孔膜的细胞数。
1.2.5Westernblot检测蛋白表达水平于处理后的细胞加入裂解液,提取细胞总蛋白,采用BCA法进行定量分析。配胶、上样(样品加入2×SDS加样缓冲液)并进行SDS—PAGE凝胶电泳分离蛋白。转移至PVDF膜,4 ℃封闭过夜。一抗室温孵育2h,弃掉一抗,加入二抗,于室温平缓摇动2h。每次孵育后均用TBST洗薄膜3次。采用ECL化学发光法检测相关蛋白。等比例混合发光剂和增强剂,反应 5min。放入暗盒进行X线显影,观察结果。
1.2.6统计学处理采用SPSS10.0统计软件进行结果分析,两样本之间进行独立样本t检验,多样本之间进行方差分析,P<0.05具有统计学意义。
2 结 果
2.1MTT实验MTT结果显示,以DMSO组为对
照,XAV939作用48h后对卵巢癌细胞的抑制率呈浓度依赖性,其抑制率分别为2μmol/L(17%±0.4%)、4μmol/L(19%±1%)、8μmol/L(31%±1%)、16μmol/L(51%±4%)、32μmol/L(55%±2%),P<0.05差异具有统计学意义。因此,确定后续实验XAV939的干预浓度为2、4、8和16μmol/L。见图1。
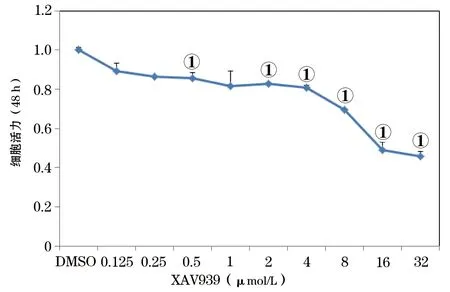
图1 不同浓度的XAV939作用48 h后对OVCAR3细胞活力的影响①P<0.05
2.2划痕试验和Transwell检测细胞迁移和侵袭能力划痕试验结果显示(图2),卵巢癌细胞OVCAR3经过4、8、16μMXAV939处理48h后细胞迁移能力显著降低,呈现剂量依赖性。迁移率由DMSO组(0.31±0.02)降低至4μM(0.2±0.04)、8μM(0.16±0.02)、16μM(0.09±0.04),均P<0.05,差异具有统计学意义。
Transwell试验结果显示(图3),穿过小室的癌细胞数目DMSO组(773±35)明显高于4μmol/L(620±49)、8μmol/L(436±17)、16μmol/L(322±13),均P<0.05,差异具有统计学意义。并且随着浓度的增加,穿过小室的细胞更少。
2.3Westernblot检测β-catenin、wnt1、TCF4、MMP9表达水平的变化Westernblot实验(图4)表明,wnt信号通路的蛋白wnt1、β-catenin、TCF4、MMP9的表达水平均有所降低,且这些变化都呈浓度依赖性。

图2 XAV939对OVCAR3细胞的影响

图3 XAV939对OVCAR3细胞侵袭能力的影响细胞侵袭(放大倍数×20)能力明显下降。①P<0.05。所有试验均重复3次
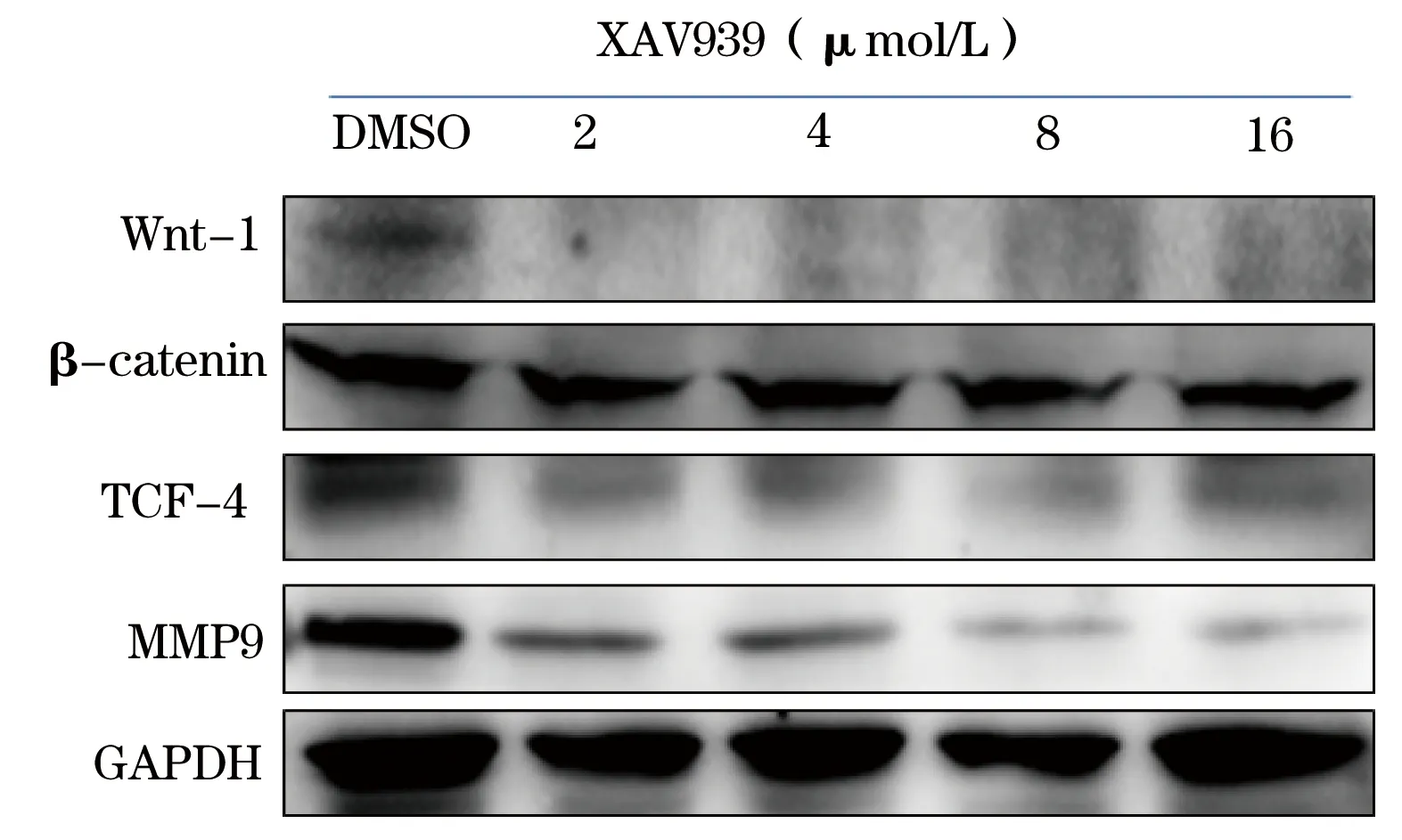
图4 XAV939对TCF4、β-catenin、wnt-1
3 讨 论
肿瘤侵袭和转移能力是肿瘤恶变的标志。分子生物学研究发现,恶性肿瘤的侵袭转移与wnt/β-catenin信号转导通路密切相关。Jang等[6]通过靶向敲除wnt1,发现乳腺癌的侵袭和转移能力明显受到抑制。同样在卵巢癌上皮细胞癌的研究中,实验数据显示β-catenin在卵巢癌组织的的表达大于正常组织,这些结果提示wnt/β-catenin在卵巢癌的侵袭和转移起着重要的作用[7]。笔者采用wnt/β-catenin信号通路的特异性抑制剂XAV939来处理卵巢癌细胞,发现XAV939能够抑制卵巢癌细胞的侵袭和迁移能力,并且呈剂量依赖性。笔者发现,应用XAV939处理卵巢癌细胞后,wnt1,β-catenin表达下降,TCF4与MMP9的表达也下降。
β-catenin以结合型和游离型存在于细胞中,前者通过与上皮钙黏蛋白E-cadherin结合来调节细胞间的黏附;后者通过wnt信号通路,作用于细胞核内的转录因子LEF/TCF,来参与肿瘤发生发展的过程[7]。wnt/β-catenin信号转导途径的激活机制是一个错综复杂的过程。大量的实验研究得出,在wnt蛋白缺失的情况下,胞内的β-catenin被磷酸化进而由蛋白酶降解,因此在胞内保持着较低水平。当wnt蛋白存在的情况下,β-catenin低磷酸化水平导致胞内的β-catenin的累积,随之进入细胞核内,通过与LEF/TCF形成转录起始复合物来调控相关基因的表达[8,9]。作为wnt信号通路的分子开关,TCF家族对肿瘤的侵袭和转移抑制起着重要作用,尤其是TCF4与肿瘤的发生发展密切相关[10]。
Sanchez-TilloE[11]等发现,β-catenin/TCF4通过上皮间充质转化途径来介导肿瘤的侵袭和转移。
此外,细胞外基质ECM降解在肿瘤的侵袭和转移也起着重要作用。越来越多的实验证明,基质金属硫蛋白MMPs的异常与肿瘤的转移密不可分,如胃癌[12]、肝细胞癌[13]。王红民等[14]通过对肺癌的研究发现,MMP9在低分化的肺癌中高水平表达。体外侵袭实验表明,低水平的MMP9能增强细胞间的附着能力,从而抑制了肿瘤的转移,这可能与MMP能降解ECM的作用有关[15,16]。多项研究显示,wnt信号通路通过核内β-catenin来激活MMPs,进而介导癌细胞的侵袭和迁移能力[17,18]。
综上所述,本研究发现,XAV939不仅抑制wnt/β-catenin信号通路,并且还可以通过抑制其下游的基因TCF4及MMP9来抑制卵巢癌的侵袭和转移。通过本研究,笔者首次提出XAV939通过wnt/β-catenin信号通路来抑制卵巢癌的侵袭和转移,并为卵巢癌的治疗策略开拓了新思路。
[1]ZhuangH,ZhaoMY,HeiKW, et al.Aberrantexpressionofpim-3promotesproliferationandmigrationofovariancancercells[J].APJCP, 2014, 16(8): 3325-3331.
[2]曹译心, 董立华, 熊小明, 等.XAV-939 对三阴性乳腺癌抑制的作用[J]. 解剖学杂志, 2013, 36(3): 300-304.
[3]汤晓颖, 庞林宾, 宋立文, 等.XAV939 抑制人肝癌HepG2 细胞血管生成拟态的形成[J]. 基础医学与临床, 2015, 35(3): 345-349.
[4]TianX,HouW,BaiS, et al.XAV939inhibitsthestemnessandmigrationofneuroblastomacancerstemcellsviarepressionoftankyrase1[J].Internationaljournalofoncology, 2014, 45(1): 121-128.
[5]何庆良, 周俊峰, 黄发昆, 等.XAV939 对胃癌细胞株MKN-45 的增殖及Wnt/β-连环蛋白信号通路的抑制作用[J]. 中华实验外科杂志, 2014, 31(012): 2745-2747.
[6]JangGB,KimJY,ChoSD, et al.BlockadeofWnt/β-cateninsignalingsuppressesbreastcancermetastasisbyinhibitingCSC-likephenotype[J].SciRep, 2015, 23(5):12465.
[7]李艳.β-catenin,Axin在卵巢上皮细胞癌组织中的表达及临床意义[D]. 蚌埠医学院, 2013.
[8]席小龙, 姜波健, 俞继卫. 肿瘤干细胞相关信号通路在胃癌发生发展中的研究进展[J]. 世界华人消化杂志, 2014, 22(4): 494-500.
[9]LefevreL,OmeiriH,DrougatL, et al.CombinedtranscriptomestudiesidentifyAFF3asamediatoroftheoncogeniceffectsofβ-catenininadrenocorticalcarcinoma[J].Oncogenesis, 2015, 4(7):e161.
[10]叶雄俊, 常智杰, 张志文, 等. 1Wnt信号通路调控细胞癌变的分子开关:T细胞因子J[J]. 中华泌尿外科杂志, 2003, 24(6): 4232-4251.
[11]Sánchez-TillóE,deBarriosO,SilesL, et al.β-catenin/TCF4complexinducestheepithelial-to-mesenchymaltransition(EMT)-activatorZEB1toregulatetumorinvasiveness[J].ProceedingsoftheNationalAcademyofSciences, 2011, 108(48): 19204-19209.
[12]王爱东, 吕光成. 胃癌组织中MMP一 9 表达, 微血管生成与胃癌侵袭与转移[J]. 肿瘤杂志, 2002, 22(1): 57-63.
[13]MiyoshiA,KitajimaY,KidoS, et al.SnailacceleratescancerinvasionbyupregulatingMMPexpressionandisassociatedwithpoorprognosisofhepatocellularcarcinoma[J].Britishjournalofcancer, 2005, 92(2): 252-258.
[14]王红民, 张小红.MMP-2,MMP-9 在肺癌中的表达及其与肺癌转移和预后关系的研究[J]. 中国现代药物应用, 2014,8(14):61-62.
[15]刘慧英.MMP-9 在肿瘤侵袭和转移中的作用以及影响慢性粒细胞白血病骨髓基质对造血干细胞粘附性的机制[D]. 中国协和医科大学, 2007.
[16]SancéauJ,TruchetS,BauvoisB.Matrixmetalloproteinase-9silencingbyRNAinterferencetriggersthemigratory-adhesiveswitchinEwing′ssarcomacells[J].JournalofBiologicalChemistry, 2003, 278(38): 36537-36546.
[17]YanC,BoydDD.Regulationofmatrixmetalloproteinasegeneexpression[J].Journalofcellularphysiology, 2007, 211(1): 19-26.
[18]IlyasM.Wntsignallingandthemechanisticbasisoftumourdevelopment[J].TheJournalofpathology, 2005, 205(2): 130-144.
(2015-10-14收稿2015-12-20修回)
(责任编辑梁秋野)
AStudyonXAV939’sfunctionininhibitingovariancancercellsmigrationandinvasion
WANGCaixia1,CHENShuo2,andZHAOYang2.
1.ChinaMedicalUniversity,Shenyang110013,China; 2.GynecologyDepartment,TheFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China
ObjectiveToinvestigatetheeffectsofXAV939oninvasionandmetastasisofovariancancercellsaswellastheinhibitionoftheWnt/β-cateninsignalingpathway.MethodsTheMTTassaywasusedtodetecttheinhibitioneffectofXAV939ontheviabilityofovariancancer,theinhibitionofcellmetastasiswasdetectedbyscratchtestandtranswellcellmigrationassay,theexpressionlevelofβ-catenin,wnt1,TCF4andMMP9proteinbyWesternblotting.ResultsTheMTTassayshowedthattheinhibitionrateofovariancancerincreasedsignificantlybyXAV939for48h,especiallytheconcentrationof8μmol/L(31%±1%,P=0.034),16μmol/L(51%±4%,P=0.028).ScratchtestandtranswellcellmigrationassayshowedtheinhibitionofinvasionandmetastasisafterXAV939treatment.Inaddition,theresultsofWesternblottingshowedthatXAV939reducedtheexpressionofwnt1,β-catenin,TCF4,andMMP9protein.ConclusionXAV939caninhibittheinvasionandmigrationofovariancancercellsthroughWnt/β-cateninpathway.
ovariancancer;XAV939;wnt/β-cateninsignalingpathway;invasionandmetastasis
国家自然基金项目(81202049, 81472440)
汪彩霞,硕士。
1.110013沈阳,中国医科大学临床医学七年制(实验班);2.110001沈阳,中国医科大学附属第一医院妇科
赵杨,E-mail:yida.zhaoyang@163.com
R73-34
