氢氧化亚铁变为灰绿色的理论探究
2016-10-20吴文中
摘要:Fe(OH)2制备过程中产生灰绿色的原因众说纷纭,争议颇多。在研究NaHCO3与FeSO4溶液反应制备FeCO3沉淀中,意外得到了“茶绿色”的FeCO3沉淀(纯品为白色),藉以研究Fe(OH)2变色的原因,结合现有研究成果,认为Fe(OH)2沉淀物吸附反应体系中绿色的Fe2+是Fe(OH)2白色沉淀变为灰绿色沉淀的真正原因。
关键词:氢氧化亚铁;灰绿色;亚铁离子;碳酸亚铁;理论探究
文章编号:1005–6629(2016)9–0060–04 中图分类号:G633.8 文献标识码:B
学者姜言霞等[1]认为,反应体系中Fe3+的含量是影响氢氧化亚铁制备实验的关键因素,NaOH溶液的浓度对该实验也有重要影响,并得出了适合课堂教师演示和学生分组实验探究的氢氧化亚铁制备的实验方案;“正交试验法探讨氢氧化亚铁制备的最佳实验条件”[2]一文则通过系列实验表明:FeSO4溶液的配制方法对Fe(OH)2沉淀白色持续时间长短有显著影响;张婉佳等教师[3]研究了控制反应体系的pH和反应溶液的密度及隔离空气的条件下,得出了实验室制备Fe(OH)2的最佳可行方案;还有许多改进实验[4,5]方面的论文,主要通过改进实验装置,避免氧气、Fe3+等干扰因素对实验的影响以达到良好实验效果等方面做了大量的研究工作。
众多学者从不同的视角探讨了Fe(OH)2制备中沉淀颜色的变化规律,对高中化学实验中如何得到能保存较久的白色Fe(OH)2沉淀具有重要的指导意义,但这些文章都没有确切回答Fe(OH)2沉淀为什么会发生颜色变化的微观上的原因。学者徐建飞[6]认为新生成的Fe(OH)2沉淀吸附溶液中Fe2+离子行为是Fe(OH)2变色的主因,但文章仅通过实验得出的一个结论,并未从理论高度系统阐述其吸附机理。
1 一次意想不到的实验
笔者在研究、解读FeSO4与NaHCO3溶液反应中,做了以下两组实验。
实验1 5.0mL 10%的FeSO4溶液与体积相同的0.1 mol·L-1 NaHCO3溶液混合(实验温度约为 11.5℃),混合后半分钟,无明显现象,之后,逐渐可看到乳白色浑浊现象(略带浅黄色),无气泡,5min后,沉淀明显增多,颜色逐渐变为茶绿色,同时有极少量气泡产生,如图1左照。(试管内预先滴入少许植物油,以防止Fe2+被氧化,FeSO4溶液使用过量的还原性铁粉处理,保证溶液中基本无Fe3+,下同)
实验2 把上述实验的FeSO4溶液换成0.1 mol·L-1的FeCl2溶液,实验现象大致相同,唯一不同的是,最后得到的不是茶绿色的沉淀,而是灰白色沉淀(略带浅绿色),如图1右照。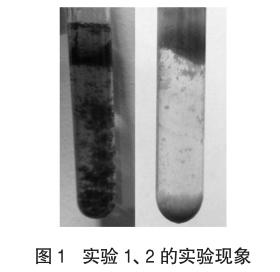
为什么两组实验得到的FeCO3沉淀有显著差异?实验1在反应开始阶段,沉淀颜色接近FeCO3的真实颜色,几分钟后变成茶绿色。(注:FeCO3应为白色结晶)
2 引起的思考
笔者在进行上述实验过程中,马上联想到高中制备Fe(OH)2的化学实验中遇到的问题:Fe(OH)2沉淀一段时间后会变成灰绿色,现象类似实验2中得到的FeCO3沉淀。
随即出现的疑问是:上述实验得到的难道不是FeCO3沉淀,而是Fe(OH)2沉淀?后续实验和分析表明:
(1)上述沉淀物皆为FeCO3沉淀,而不是Fe(OH)2沉淀。
(2)NaHCO3溶液的pH始终为8.31左右[7](NaHCO3大于0.0025 mol/L范围内,随着浓度变化,pH基本不变),理论上不会得到Fe(OH)2沉淀。
(3)与FeSO4溶液中滴加NaOH溶液那样能快速得到Fe(OH)2不一样的是:生成FeCO3沉淀“非常”缓慢(实验开始时,笔者甚至误以为不能反应)。
(4)实验1中出现的茶绿色现象比实验2中出现得要快,且颜色更深,与在FeSO4溶液中滴加NaOH溶液得到Fe(OH)2沉淀的现象有显著差异。
上述两组实验数据的根本区别:实验1中FeSO4浓度大得多;实验1使用FeSO4溶液,实验2使用的是FeCl2溶液。
很容易让笔者得出以下结论:反应体系中Fe2+浓度影响实验结果,过量的Fe2+可能被吸附到FeCO3沉淀表面。
那么问题就来了,制备Fe(OH)2出现的类似实验现象是否也可能是这个原因?想到这点,笔者意识到似乎找到了Fe(OH)2沉淀颜色变化的真正原因。
3 Fe(OH)2沉淀吸附Fe2+的可能性探讨
3.1 胶体的形成过程与特点
氢氧化亚铁溶胶是由许多Fe(OH)2分子构成的,其中心部分叫胶核,胶核的外边是阴阳离子所形成的吸附层,胶核和吸附层统称为胶粒,整个胶团的结构可用图2描述[以FeCl2溶液制备Fe(OH)2胶体为例]。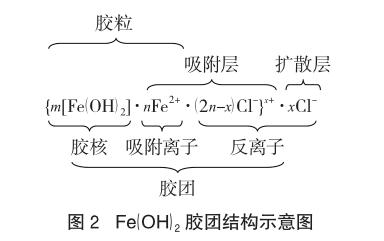
一般认为与晶体的组成离子形成不溶物的离子将优先被吸附,优先吸附与沉淀(晶体)具有相同成分的离子[法扬斯(Fajans)规则],胶核到底吸附带何种性质电荷的离子取决于体系的环境,如采用0.01 mol/L AgNO3溶液与同浓度的KI溶液反应来制备AgI胶体时,如果形成胶体时KI过量,则胶核(AgI)m吸附I-而带负电,反之,当AgNO3溶液过量时,则胶核(AgI)m吸附Ag+而带正电,因此某胶核带电的符号取决于被吸附离子的符号,而带电的程度取决于胶粒的表面积的大小、胶核之间的紧密程度以及吸附时间的长短,当胶核表面吸附离子而带电后,在它周围的溶液中,带相反电性的离子(反离子)会扩散到胶核附近,并与胶核表面电荷形成扩散“双电层”结构。
需要说明的是:在高中制备氢氧化铁胶体的实验中,操作是向沸水中加入FeCl3溶液,由于Fe3+的水解,使溶液显酸性,溶液中的OH-浓度较小,溶液中部分Fe(OH)3和HCl起反应:
FeO+是与Fe(OH)3组成类似的离子,所以被优先吸附在胶核[Fe(OH)3]m上,形成胶粒;如果在碱性环境下,则可吸附OH-而带负电。由此,我们常说的氢氧化铁胶粒带正电,是由于制备胶体的实验过程的特殊性决定的,而非氢氧化铁胶粒一定带正电。
对胶核[Fe(OH)2]m来说,其吸附的离子可以是Fe2+,也可以是OH-离子,其最终吸附何种离子,则取决于反应体系的离子环境,若溶液中Fe2+离子浓度明显大于OH-离子,则胶粒带正电,胶核吸附的是Fe2+。
3.2 Fe(OH)2沉淀过程的探讨
Fe(OH)2的形成过程实际上是分步进行的,体系中实际存在各种形式的离子和分子,在pH不很低的情况下,其含量都不高,其过程如下: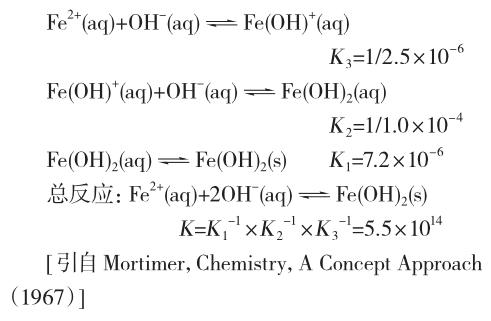
当许多个Fe(OH)2分子形成以后,Fe(OH)2分子就可能聚集在一起,形成胶核[Fe(OH)2]m,而一旦形成胶核后,就能吸附环境中的与胶核组成类似的阴阳离子,即Fe2+或OH-等离子,而后形成胶体。
值得注意的是,得到胶体不一定能稳定存在,因为胶体所处环境电解质浓度假如比较高,胶体就会发生聚沉现象,因此当浓度较高的FeSO4溶液与NaOH溶液混合后(体系中电解质浓度较高),无法得到纯粹的Fe(OH)2胶体,而是得到Fe(OH)2沉淀,沉淀发生得如此迅速,以致先前被吸附的离子就夹杂在沉淀物中,若胶核[Fe(OH)2]m吸附Fe2+,就容易得到绿色沉淀。正因为如此,制备AgI胶体时,只能采用浓度非常低的AgNO3和KI溶液来完成:在一个大试管里注入0.01 mol/L KI溶液10mL(过量),用胶头滴管滴入8~10滴相同浓度的AgNO3溶液,边滴加边振荡,即得碘化银胶体,这样得到的AgI胶体中的胶粒带负电,胶核(AgI)m吸附I-离子。
4 Fe(OH)2沉淀颜色变化的理论分析
事实上,无论是胶体形成过程,还是一般的沉淀物都具有吸附离子的行为[存在Fe(OH)2沉淀的水溶液环境中,同时一定存在Fe(OH)2胶体]。应该关注的是:吸附过程并非瞬间完成,如同其他的化学过程一样,都有一个达到“吸附-解离”的平衡过程,即需要一定的时间才能保证沉淀物吸附量达到最大值。吸附量的大小不但与溶液中离子浓度有关,也与胶核的表面积有关,表面积越大,吸附离子浓度越高,则吸附量越大。
而实验2由于FeCl2溶液的浓度比较低,FeCO3沉淀吸附Fe2+的总量大为减少,最后得到的FeCO3沉淀就为浅绿色,比较在FeSO4溶液中加入NaOH溶液实验中的Fe(OH)2沉淀颜色的变化比较缓慢,其原因就是得到的Fe(OH)2沉淀速率快,[Fe(OH)2]m胶核来不及吸附Fe2+,因此往往需过一段时间以后才会转化为灰绿色,同时由于Fe(OH)2快速沉淀,Fe(OH)2分子之间靠得比较紧密,胶核的表面积相对而言就比较小。
4.2 Fe(OH)2沉淀的吸附行为
学者徐建飞[8]建议采取在NaOH溶液中滴加FeSO4溶液来制备Fe(OH)2显然是合理的,在这种情况下{体系中Fe2+浓度比较低,[Fe(OH)2]m胶核或沉淀主要吸附的是OH-离子},许多学者也建议采用高浓度的NaOH溶液滴加到FeSO4溶液中来制备Fe(OH)2,实际上都是为了降低体系中的Fe2+离子浓度,减少[Fe(OH)2]m胶核或沉淀对Fe2+的吸附量。
而采用高浓度的NaOH溶液,反应后体系pH较大,使得体系中的c(Fe2+)浓度较小,Fe2+不易被吸附在[Fe(OH)2]m胶核或沉淀表面。
Fe(OH)2形成沉淀越慢,则吸附的Fe2+就会越多,这是因为此时Fe(OH)2周围的Fe2+浓度相对更高,这与FeCO3沉淀形成速率慢、更易吸附Fe2+的道理一样。
因此可以预测:快速加入NaOH溶液,Fe(OH)2吸附Fe2+更少;滴入NaOH溶液浓度越大,pH越大,Fe2+浓度越小,Fe(OH)2变为灰绿色也就越难,这就是许多学者建议采用高浓度NaOH溶液来制备Fe(OH)2的微观原因所在。
当Fe(OH)2沉淀物存在Fe(OH)3沉淀时(即实验体系中存在杂质Fe3+或氧气溶入),为什么Fe(OH)2更容易发生颜色的变化?是更容易被氧气氧化?还是因为这种情况下更容易吸附Fe2+?
形成晶体(沉淀)时一般存在着自范性规律,即当晶体(沉淀)形成时,若得到的晶体(沉淀)单一,晶体(沉淀)结构越均匀,也越紧密,若有杂质固体存在时,得到的沉淀便不够紧密,与溶液的接触面积会更大(快速沉淀将无法得到大晶体,沉淀之间空隙增多,晶体缺陷明显)。
而且很重要的是,同浓度下,Fe3+优先于Fe2+形成Fe(OH)3分子形成胶核,但实验中,Fe3+浓度往往远小于Fe2+浓度,因此,在一定范围内,Fe(OH)3与Fe(OH)2分子可以同时形成,使得到的沉淀物不纯净。沉淀物不纯净,得到的沉淀越不紧密,沉淀的表面积就增大,则沉淀吸附离子也越多、越快。因此,当溶液中存在Fe3+时,得到的Fe(OH)2沉淀更容易吸附Fe2+而发生颜色的变化。
同理,氧气的存在也显然会使形成的Fe(OH)2沉淀不纯净,沉淀表面积越大,更容易吸附Fe2+而使沉淀颜色变化。基于上述理论,FeSO4溶液的理想配制原则就是:(1)排除Fe3+干扰;(2)降低溶液含氧量,“正交试验法探讨氢氧化亚铁制备的最佳实验条件”[9]一文中的最佳实验条件就是配制好理想的FeSO4溶液。
4.3 实验验证Fe(OH)2沉淀的吸附作用
为了说明以上理论的合理性,在稍过量的NaOH溶液中滴入FeSO4溶液后(已排除Fe3+与溶解氧的干扰),发现沉淀能较长时间保持白色,但这一过程中若继续滴入FeSO4溶液,会发现沉淀量有所增大,就能很快观察到Fe(OH)2变为灰绿色。
为了进一步证明上述理论的合理性,笔者补充如下两组实验。
实验3 10mL 4 mol/L的NaOH溶液逐滴加入0.1 mol/L FeSO4溶液产生悬浮于液面的白色沉淀(带有较多灰绿色)。沉淀下沉后,部分灰绿色变为白色沉淀,改用8 mol/L NaOH溶液重复上述实验,则可以完全得到白色的Fe(OH)2沉淀。
实验4 在制备好的Fe(OH)2灰绿色沉淀的体系中,继续滴入高浓度的NaOH溶液,可看到灰绿色转化为白色。
以上实验充分说明Fe(OH)2之所以变为灰绿色的原因是其吸附了Fe2+离子,证明了上述理论的合理性。值得注意的是,潮湿的Fe(OH)2放在空气中,并非转化为灰绿色,而是转化为红褐色,这当然是Fe(OH)2被氧化为红褐色的Fe(OH)3的缘故。
显然,依据本文阐述的理论以及有关制备FeCO3沉淀事实,吸附行为是沉淀颜色变化的关键因素,上述实验现象证明笔者的观点是正确的。Fe(OH)2沉淀的颜色与是否带结晶水无关,和有无Fe(OH)3杂质相关性很小,而与吸附Fe2+有关。笔者重新做了带浅绿色的Fe(OH)2沉淀在水浴中加热的实验,得到的实验现象与徐建飞老师[10]的实验现象相似,进一步证明了Fe(OH)2确因吸附Fe2+而发生颜色的变化。对Fe(OH)2沉淀水浴加热后由绿变白,并有片状白色沉淀下沉的原因分析:由于Fe2+的水解是吸热反应,被吸附的Fe2+因水解而得到更多的沉淀物。
5 教学实验建议
实验还发现采用FeCl2与FeSO4溶液分别制备Fe(OH)2沉淀也有所差异,前者得到Fe(OH)2保持白色的时间更久,这可能是由于在FeCl2溶液中Fe2+可以与Cl-离子形成FeCl+离子(稳定常数为101.17),溶液中的FeCl+离子浓度比较高,计算0.1 mol/L的FeCl2溶液中的FeCl+浓度,大约为0.0664 mol/L(不考虑其水解的情况下),即FeCl2溶液中的Fe2+约有70%以FeCl+的形式存在,因此Fe(OH)2沉淀吸附FeCl+的效果更差{单个离子所带电荷数越多,越容易被胶核吸附,且FeCl+与组成[Fe(OH)2]m离子相似度降低},使得到Fe(OH)2保持白色的时间更长久。
教师如清楚地知道Fe(OH)2沉淀之所以变色的微观上的原因,在设计实验制备白色的Fe(OH)2沉淀时,只要抓住一个原则——保证Fe(OH)2沉淀时溶液中基本无Fe2+可吸附,即往高浓度、基本无溶解氧的NaOH溶液中滴加基本无Fe3+离子和溶解氧的FeCl2溶液来制备白色的Fe(OH)2沉淀是最为合理的实验方案。
参考文献:
[1]姜言霞,阮宝玲,毕华林,李晓林.适合中学课堂教学的氢氧化亚铁制备实验方案的研究[J].化学教育,2014,(23):47~49.
[2][9]贝伟浩.正交试验法探讨氢氧化亚铁制备的最佳实验条件[J].中学化学教学参考,2015,(8):102~103.
[3]张婉佳,董洪霞,黄监民.制备氢氧化亚铁的理论探讨及实验研究[J].化学世界,2014,(8):486~471.
[4]杨晓东.氢氧化亚铁制备实验的再探究[J].化学教学,2015,(2):56~58.
[5]张玩丽.氢氧化亚铁的制取实验再改进[J].中学化学教学参考,2014,(22):52.
[6][8][10]徐建飞,张平,杜淑贤.制备氢氧化亚铁实验方案再探究[J].化学教学,2015,(7):54~56.
[7]吴文中.例谈作图法在高中化学解题中的应用[J].化学教学,2015,(3):72~75.
