一株吡啶高效降解菌的鉴定及其降解特性
2016-10-20晋婷婷任嘉红张晖孙莎陈艳彬白凤麟
晋婷婷,任嘉红,张晖,孙莎,陈艳彬,白凤麟
一株吡啶高效降解菌的鉴定及其降解特性
晋婷婷*,任嘉红,张晖,孙莎,陈艳彬,白凤麟
长治学院生物科学与技术系,山西 长治 046011
对山西省长治市一家煤焦化厂经活性污泥处理后的废水中的吡啶降解菌进行了分离,并对其中一株吡啶高效降解菌JB27进行了分类鉴定及其吡啶降解特性分析。通过菌落形态观察、菌体显微观察、生理生化测定和16S rRNA基因序列分析对菌株JB27进行菌种分类;利用紫外分光光度计和可见光分光光度计分别测定培养基中吡啶质量浓度和菌液OD600值;分别测定菌株JB27在不同pH、温度、葡萄糖添加量以及初始吡啶质量浓度条件下的菌液OD600值和吡啶降解率。结果表明,菌株JB27为Shinella zoogloeoides;该菌株能利用吡啶作为唯一碳源;菌株JB27在pH 5.0~9.0条件下均能发挥较强的吡啶降解能力,其降解吡啶的最适pH为8.0或9.0;菌株JB27降解吡啶的最适温度为30 ℃;葡萄糖的添加会降低菌株JB27的吡啶降解速率,不利于该菌株对吡啶的降解;菌株JB27对吡啶的降解程度与菌液OD600值成正比,在吡啶初始浓度分别为500、1 000、1 500、2 500和3 000 mg·L-1的培养基中,可分别在3、4、4、5和6 d内降解掉99%以上的吡啶。菌株JB27的吡啶降解能力高于多数已报道吡啶降解菌,是一株吡啶高效降解菌,可作为煤化工废水中吡啶类化合物的生物降解的优良菌种资源。该研究可为该菌种的进一步应用提供理论依据。
吡啶降解菌;煤化工废水;分类鉴定;降解特性
引用格式:晋婷婷, 任嘉红, 张晖, 孙莎, 陈艳彬, 白凤麟. 一株吡啶高效降解菌的鉴定及其降解特性[J]. 生态环境学报, 2016,25(7): 1217-1224.
JIN Tingting, REN Jiahong, ZHANG Hui, SUN Sha, CHEN Yanbin, BAI Fenglin. Identification and Characterization of A Pyridine Degrading Bacterium [J]. Ecology and Environmental Sciences, 2016, 25(7): 1217-1224.
我国煤炭资源丰富,煤化工企业众多。据统计,煤化工废水排放量占全国工业废水排放量的30%。煤化工废水水质复杂,含有大量有毒有害物质,直接排放会严重污染环境,同时也会危害人和动物的健康(Wasi et al.,2013;Han et al.,2011;周学双等,2009)。目前,国内外普遍采用“预处理-生化处理-深度处理”这一工艺流程来处理煤化工废水(Zubakhin et al.,2011;黄开东等,2012)。其中,生化处理可除去大部分的有机污染物,是煤化工废水处理技术的核心。该方法应用范围广,处理能力大,设备简单,经济成本低,是最具经济效益的处理方案。
煤化工废水的组成成分十分复杂,包括酚类、多环芳香族化合物及含氮、氧、硫的杂环化合物等。按照被降解的难易程度可分为易降解有机物、可降解类有机物和难降解类有机物三类。其中,吡啶就属于难降解类有机物。吡啶类化合物易溶于水,容易通过渗透扩散到地下水系统,直接引起水环境的严重污染。目前国内外已陆续分离得到多株吡啶降解细菌,包括假单胞菌(Pseudomonas sp.)(Mohan et al.,2003)167-169、副球菌(Paracoccus sp.)(Qiao et al.,2010)、无色杆菌(Achromobacter sp.)(Deng et al.,2011)、节杆菌(Arthrobacter sp.)(Khasaeva et al.,2011)、贪铜菌(Cupriavidus sp.)(Ilori et al.,2015)、希瓦氏菌(Shewanella sp.)(Chatterjee et al.,2013)、根瘤菌(Rhizobium sp.)(Shen et al.,2015)2005-2009等。相对于目前已分离得到的酚类等易降解有机物降解菌种类而言,其降解菌种类依然非常少。分离筛选吡啶高效降解细菌对于煤化工废水中吡啶类化合物的生物降解至关重要。且不同来源的吡啶降解菌的吡啶降解能力及其降解吡啶的最适条件也不尽相同。
本文以从一家煤焦化厂废水中分离得到的一株吡啶高效降解菌为研究对象,对其进行分类鉴定和降解特性分析,为该菌种在煤化工废水生物处理过程中的应用提供理论依据。
1 材料与方法
1.1样品采集
实验样品采自山西省长治市一家煤焦化厂工业污水处理系统中的活性污泥池出水口。
1.2培养基
LB培养基:胰蛋白胨10 g·L-1,酵母粉5 g·L-1,NaCl 5 g·L-1,pH 7.4。MSM培养基:(NH4)2SO42.0 g·L-1,MgSO4·7H2O 0.2 g·L-1,CaCl2·2H2O 0.01 g·L-1,FeSO4·7H2O 0.001 g·L-1,Na2HPO4·12H2O 1.5 g·L-1,KH2PO41.5 g·L-1,pH 7.0。
1.3主要试剂和仪器
PCR扩增相关试剂,Takara公司;16S rRNA扩增通用引物:27F 5'-AGAGTTTGATCCTGGCTC AG-3',1492R 5'-GGTTACCTTGTTACGACTT-3',上海生工;PCR仪,德国Eppendorf公司;紫外分光光度计(TU-1901),北京谱析。
1.4吡啶降解菌的分离筛选
取0.5 m L样品加入50 m L MSM培养基(含500 mg·L-1吡啶)中,置于30 ℃、180 r·m in-1摇床上培养7 d。稀释涂布MSM固体培养基(含500 mg·L-1吡啶),30 ℃下培养。挑取不同形态单菌落,进行吡啶降解能力测定。
1.5吡啶降解能力测定
挑取待测菌株单菌落,接种到LB培养基中(含500 mg·L-1吡啶),30 ℃培养至对数期。离心收集菌体(10000 r·min-1,2 m in),用MSM洗涤两次,稀释至OD600=1.5。上述菌种5%转接至MSM中(含1000 mg·L-1吡啶),置于30 ℃、180 r·min-1摇床培养5 d,1 000 r·m in-1离心2 m in,吸取上清液测定吡啶质量浓度。吡啶质量浓度测定方法参见文献(周敏等,2011)。
1.6生理生化特性分析及分子鉴定
生化特性鉴定参见常见细菌系统鉴定手册(东秀珠等,2001)。基因组DNA的提取和16S rRNA的扩增参见Wan et al.(2007)的方法。16S rRNA序列测定后与EzTaxon数据库(Kim et al.,2012)已有的模式菌株进行比对,选取比对结果中相似度较高的前19位序列,利用CLUSTALW(Larkin et al.,2007)软件和菌株JB27的16S rRNA序列进行多重比对,利用MEGA 6.0软件(Tamura et al.,2013)构建系统发育树(Neighbor-Joining法)。
1.7pH对吡啶降解的影响
在Na2HPO4-KH2PO4缓冲体系下,使用0.1 mol·L-1的HCl或0.1 mol·L-1NaOH将MSM液体培养基(含1 000 mg·L-1吡啶)pH值分别调至5.0、6.0、7.0、8.0、9.0、10.0。分别接种菌株JB27,每天取样,分别测定培养液中吡啶质量浓度和培养液OD600。
1.8培养温度对吡啶降解的影响
将菌株JB27接种于MSM液体培养基(含1000 mg·L-1吡啶)中,分别置于25、30、37 ℃条件下摇床培养(180 r·m in-1)。每天取样,分别测定培养液中吡啶质量浓度和培养液OD600。
1.9葡萄糖添加对吡啶降解的影响
在MSM液体培养基(含1000 mg·L-1吡啶)分别加入质量浓度为500 mg·L-1和1000 mg·L-1的葡萄糖。分别接种JB27,每天取样,分别测定培养液中吡啶质量浓度和培养液OD600。
1.10菌株JB27对不同浓度吡啶的降解能力
在MSM液体培养基分别加入质量浓度为500、1 000、1 500、2 500、3 000 mg·L-1的吡啶。分别接种JB27,每天取样,分别测定培养液中吡啶质量浓度和培养液OD600。
2 结果与分析

图1 菌株JB27 16S rRNA序列扩增Fig. 1 Amplification profile of 16S rRNA from strain JB27
2.1菌株JB27生理生化特性分析及16S rRNA基因序列分析鉴定
对山西省长治市一家煤焦化厂生产废水进行采集,从中分离筛选能够以吡啶作为唯一碳源的吡啶降解菌。经分离筛选及吡啶降解能力测定,得到一株能高效降解吡啶的细菌菌株,将其命名为JB27。菌株JB27菌落形态呈圆形,黄色,不透明,表面光滑,边缘整齐,菌落中间鼓起。菌体革兰氏染色阴性,无芽孢,菌体呈短杆状,大小为0.5~0.8 μm×1.2~1.5 μm。菌株JB27伏普试验和丙二酸盐利用均为阳性;甲基红试验、吲哚试验、KOH、淀粉水解、卵磷脂酶、接触酶和氧化酶等实验结果显示均为阴性。对该菌株的16S rRNA序列进行扩增(图1),与EzTaxon数据库中的序列进行比对,发现其与Shinella zoogloeoides ATCC 19623相似度为99.86%,在16S rRNA系统发育树上与Shinella zoogloeoides ATCC 19623T位于同一分支(图2)。结合生理生化特性(表1),菌株JB27检测的各项生化特性与S.zoogloeoides ATCC 19623T一致(An et al.,2006)443-445,初步确定菌株JB27为S.zoogloeoides。其16S rRNA序列已上传至GenBank数据库,登录号为KX161838。

表1 菌株 JB27生理生化特性Table 1 Characteristics of Strain JB27
2.2pH对菌株JB27吡啶降解能力及生长的影响
图3和表2显示了菌株JB27在不同pH值条件下对吡啶的降解及生长情况。在pH分别为5.0、6.0、7.0、8.0、9.0条件下,随着培养时间的延长,培养基中吡啶质量浓度逐渐下降,在第3天时降至7.0 mg·L-1以下,达到99%以上的吡啶降解率(表2)。但是菌株JB27在这5个pH梯度环境下对吡啶的降解速率略有不同,按照吡啶降解速率排序依次为,pH9.0>pH8.0>pH5.0>pH6.0>pH7.0。相对应地,在吡啶质量浓度降至7.0 mg·L-1以下时的第3天,菌株JB27的OD600也达到最高值(图3B),在不同pH条件下的菌体生长速率与吡啶降解速率呈现出相同的趋势。然而,把菌株JB27培养在初始pH为10.0的培养基中,其对吡啶的降解能力急剧降低,培养至第4天时,培养基中吡啶的质量浓度仍高达631.9 mg·L-1,降解率仅为36.81%。由图3B可知,菌株JB27的生长在pH为10.0的培养基中受到了很大程度的限制,其OD600值最高只能达到0.17。以上结果说明,菌株对吡啶的降解与其生长成正比,只有当菌株JB27 OD600值达到0.6以上,才能发挥较高的吡啶降解能力。而且,该菌株在pH 5.0~9.0的培养条件下均能高效降解吡啶,在3 d内可达到99%以上的吡啶降解率。

图2 菌株JB27的系统发育树Fig. 2 Phylogenetic tree of strain JB27 based on 16S rRNA sequences
2.3温度对菌株JB27吡啶降解能力及生长的影响
在一定温度范围内,适当提高温度有利于菌体生长。为了探究有利于菌株JB27生长和降解吡啶的最适温度,我们分别试验了菌株JB27在25、30和37 ℃条件下的生长量和吡啶降解情况。如图4B所示,在25 ℃培养条件下,菌株JB27对数生长期显著延长,在相同培养时间下,菌体浓度明显低于30 ℃培养条件。当培养温度升高至37 ℃时,菌株JB27生长速率并未提高,而是出现了延迟期明显延长的现象,其达到的最高OD600值和30 ℃培养条件下的菌液OD600值相当。培养基中吡啶降解情况与菌体增长趋势相对应(图4A),在25 ℃培养条件下,培养基中吡啶质量浓度逐渐下降,直到第5天降至8.3 mg·L-1,达到99.17%的降解率(表3);在30 ℃培养条件下,培养基中吡啶质量浓度以较高速率下降,第3天即降至5.8 mg·L-1,此时菌株JB27的OD600也达到最高值(图4B);在37 ℃培养条件下,培养基中吡啶质量浓度在前3天以缓慢趋势下降,在菌株JB27的OD600达到最高值的第4天,迅速降至11.2 mg·L-1,达到98.88%的降解率。综上所述,菌株JB27在30 ℃条件下更容易发挥较高的吡啶降解能力。

图3 pH对菌株JB27吡啶降解能力(A)及生长(B)的影响Fig. 3 Effect of pH on pyridine-degrading (A) and grow th (B) of strain JB27
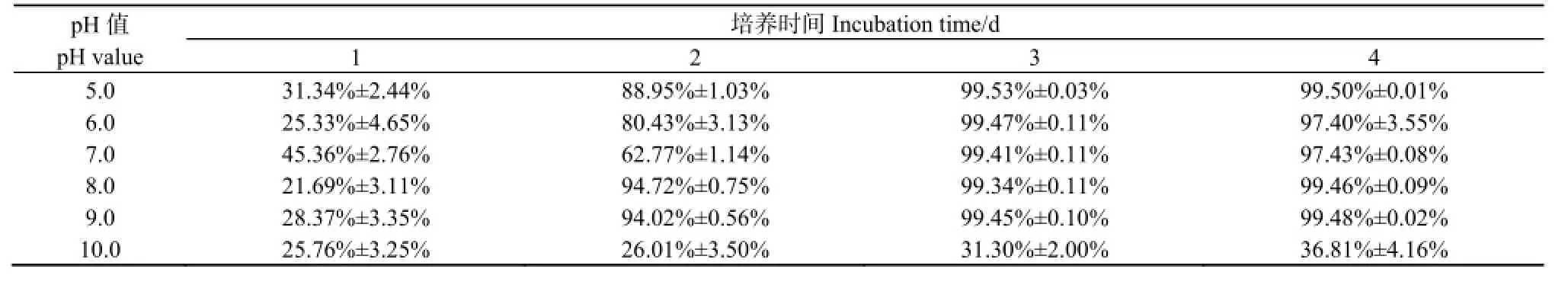
表2 不同pH条件下吡啶降解率Table 2 Pyridine-degrading efficiency at different pH values

图4 温度对菌株JB27吡啶降解能力(A)及生长(B)的影响Fig. 4 Effect of temperature on pyridine-degrading (A) and grow th (B) of strain JB27
2.4葡萄糖添加对菌株JB27吡啶降解能力及生长的影响
研究吡啶降解所用的培养基为MSM,未添加任何碳源。因此,菌株JB27只以吡啶作为碳源,从而对其进行降解。为了探究额外的碳源添加对菌株JB27吡啶降解能力的影响,在培养基中分别添加了500 mg·L-1和1000 mg·L-1的葡萄糖。如图5B所示,在添加了葡萄糖的培养基中,菌株JB27的OD600值也有所提高,且在含有1000 mg·L-1葡萄糖的培养基中其OD600值最高。相反地,菌株JB27在未添加葡萄糖的培养基中呈现出最高的吡啶降解速率(图5A)。由于葡萄糖和吡啶都可作为碳源物质被利用,所以菌株JB27在含有葡萄糖的培养基中因有丰富的碳源物质可利用而显示出较快的生长速率和较高的OD600值。在培养初期,菌株JB27优先选择利用葡萄糖,出现了对吡啶的降解速率较低的情况。随着葡萄糖被消耗殆尽,菌株JB27开始利用并降解吡啶。因此,在培养的第4天,所有培养基中吡啶浓度均降低至9 mg·L-1,达到99%以上的吡啶降解率(表4)。以上结果说明额外碳源的添加并不利于菌株JB27对吡啶的降解。
2.5吡啶初始质量浓度对菌株JB27吡啶降解能力及生长的影响
为了进一步验证菌株JB27的吡啶降解量,将培养基中的吡啶初始质量浓度梯度升高至了3000 mg·L-1。如图6所示,随着吡啶质量浓度的升高,菌株JB27对数生长期逐渐延长,且菌液OD600值也逐渐升高。在吡啶初始质量浓度为3000 mg·L-1的培养基中,菌株JB27的OD600值可达到1.11(图6B)。与此同时,随着培养基中吡啶初始质量浓度的不断提高,菌株JB27将其质量浓度降解至10 mg·L-1以下所用的时间也会相应延长,但最终都可降解掉99%以上的吡啶。在吡啶初始质量浓度分别为500、1000、1500、2500、3000 mg·L-1的培养基中,菌株降解掉99%以上吡啶所用的时间分别为3、4、4、5、6 d(表5)。截至目前为止,仅有一株能降解吡啶的细菌菌株(S.zoogloeoides BC026)被报道,但仅研究了菌株BC026对1806 mg·L-1吡啶的降解程度(孙庆华等,2008)2938-2941。本研究所分离得到的菌株JB27可在6 d内降解掉约3000 mg·L-1吡啶,因此,和S.zoogloeoides BC026相比,菌株JB27具有更高的吡啶降解应用潜力。
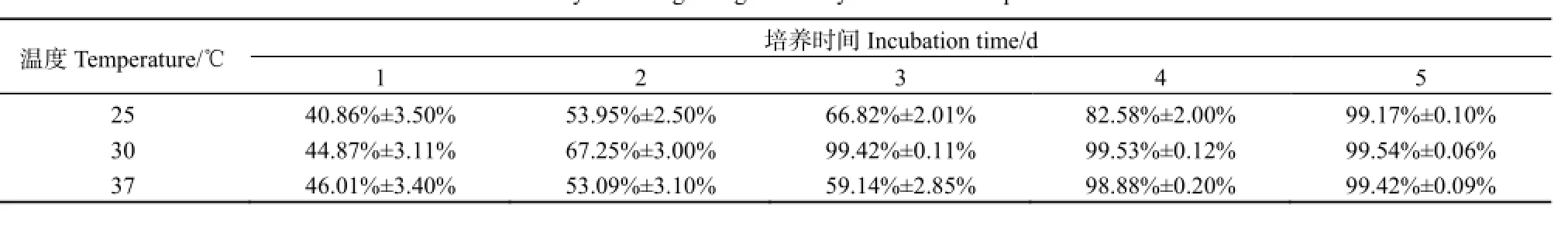
表3 不同温度条件下吡啶降解率Table 3 Pyridine-degrading efficiency at different temperature
3 结论与讨论

图5 葡萄糖添加对菌株JB27吡啶降解能力(A)及生长(B)的影响Fig. 5 Effect of additional glucose on pyridine-degrading (A) and grow th (B) of strain JB27

表4 不同浓度葡萄糖添加条件下吡啶降解率Table 4 Pyridine-degrading efficiency at different initial concentrations of glucose
3.1讨论
分离筛选吡啶高效降解菌对于煤化工废水中吡啶类化合物的生物处理至关重要。本研究所分离得到的吡啶降解菌株JB27,经鉴定为S.zoogloeoides。该菌种在2006年以前一直被称为生枝动胶菌(Zoogloea Ramigera),2006年被命名为S.zoogloeoides (An et al.,2006)443-448。此前,已有文献报道S.zoogloeoides可以降解工业废水中的某些有机污染物(Ahn et al.,1996;Kaech et al.,2005),还可作为生物吸附剂去除重金属(Kim et al.,2003;Sag~ et al.,1995)。然而,目前未有文献报道该菌种的吡啶降解能力。直到2008年,孙庆华等(2008)2938-2941第一次分离得到一株能够降解吡啶的S.zoogloeoides菌株BC026,但他们仅研究了菌株BC026对1806 mg·L-1吡啶的降解程度。在目前已报道的绝大多数吡啶降解菌中,其吡啶降解能力普遍低于3000 mg·L-1。例如,Mohan et al.(2003)167-170分离得到的一株假单胞菌(Pseudomonas sp.)PI2降解750 mg·L-1吡啶需要200 h;Mathur et al.(2008)于2008年报道了两株吡啶降解菌,腐败希瓦氏菌(Shewanella putrefaciens)和球形芽孢杆菌(Bacillus sphaericus),这两株菌在140 h和72 h时的吡啶降解能力分别为500 mg·L-1和200 mg·L-1;Li et al.(2009)分离得到的一株链霉菌(Streptomyces sp.)HJ02可以在8 d内降解2000 mg·L-1吡啶;2014年,Shen et al.(2015)2008-2010分离得到了一株根瘤菌(Rhizobium sp.)NJUST18,该菌株可降解高达2600 mg·L-1吡啶,但需要耗时230 h。而本文分离得到的S.zoogloeoides JB27,可在6 d内降解高达3000 mg·L-1的吡啶,并能达到99.61%的吡啶降解率。因此,菌株JB27是一株高效吡啶降解菌,具有较高应用潜力。

图6 吡啶初始浓度对菌株JB27吡啶降解能力(A)及生长(B)的影响Fig. 6 Effect of initial pyridine concentration on pyridine-degrading (A) and grow th (B) of strain JB27
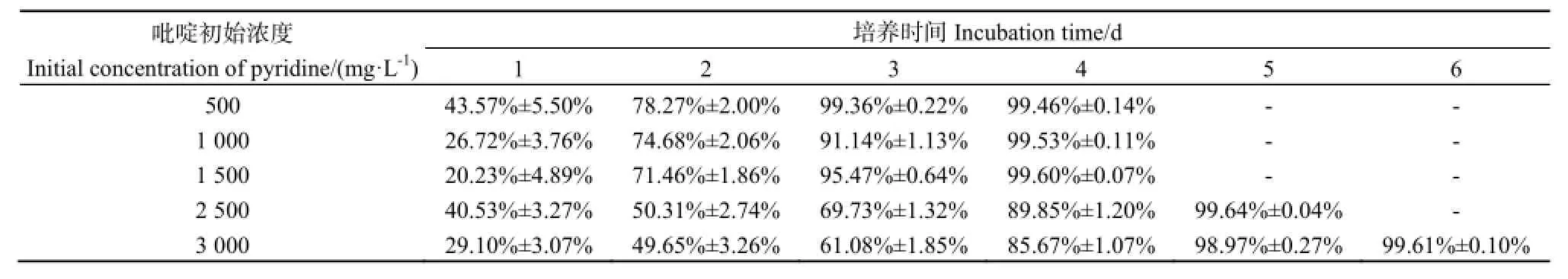
表5 不同浓度吡啶添加条件下吡啶降解率Table 5 Pyridine-degrading efficiency at different initial concentrations of pyridine
菌株JB27分离自经活性污泥处理后的废水。活性污泥中含有丰富的微生物,尤其是能够降解有机污染物的微生物。在降解废水中有机物的同时,部分菌种会进入废水中并从出水口流出。而且,生产废水在活性污泥池中一般会停留20 h左右,停留时间较长,因此活性污泥处理后水中携带的菌种可能具有更强的有机污染物耐受能力和降解力。菌株JB27具有高效的吡啶降解能力可能与其来源相关。
在进行吡啶降解研究过程中,使用的培养基MSM中未添加任何碳源物质,所以吡啶可以充当菌株JB27的碳源。通俗地讲,菌株JB27可以将吡啶当成营养来源从而满足自身生长需要的同时对其进行降解。因此,为了更深入地分析菌株JB27对吡啶的降解特性,本文还同时测定了菌体生长情况。研究发现,菌株JB27对吡啶的降解程度与菌体生长密切相关。当菌体处于对数生长期时,菌株JB27具有最高的吡啶降解速率。当菌液OD600达到最高值,开始进入平台期时,达到最大吡啶降解率。菌体OD600值必须达到0.6以上,菌株JB27才能正常发挥吡啶降解能力。菌液OD600值的提高也会相应提高吡啶降解能力。当培养基中吡啶初始浓度逐步升高时,菌体对数生长期显著延长,最终达到的OD600最高值也相应提高。与此同时,菌株在进入平台期的1~2 d内,可降解掉99%以上的吡啶。甚至可以在6 d内降解掉初始浓度为3 000 mg·L-1的吡啶(图6)。这说明菌株JB27可以充分利用吡啶作为碳源物质,在提高自身生物量的同时对吡啶进行降解,具有非常高的吡啶利用率和降解率。
本研究在培养基中额外添加了葡萄糖作为碳源物质。结果发现,额外添加碳源提高了菌株的生物量,但对吡啶的降解率却无显著影响。菌株JB27在生长过程中会优先选择利用葡萄糖,其次再去利用和降解吡啶,因此,葡萄糖的额外添加反而不利于吡啶的利用和降解(图5)。
通常情况下,在一定温度范围内,提高培养温度可加速菌体生长,但是菌种JB27却不同。该菌种在37 ℃条件下的生长速度明显低于30 ℃。该菌种更适合在30 ℃左右的温度条件下生长繁殖。因此,在实际应用中,应当避免在高温条件下应用该菌种进行吡啶的生物降解。
关于吡啶的降解过程,孙庆华等(2008)2942-2943和Shen et al.(2014)认为吡啶环在两处C-N键断开,生成氨氮(NH4+)。Bai et al.(2009)进一步研究发现,当以吡啶作为唯一碳源时,吡啶被降解为NH4+和CO2。当吡啶-MSM培养基中添加额外碳源时,由于培养基中碳氮比的升高,NH4+被进一步氧化为NO3-,菌体以NO3-作为氮源,对其进行逐步还原,依次形成NO2-、N2O,最终生成N2。Bai等(2009)认为,碳氮比是决定吡啶降解途径和降解程度的重要因素之一,对培养基中碳氮比进行合理控制,将有利于吡啶的充分降解。本研究的S.zoogloeoides JB27是否具有同样的吡啶降解规律,还需进一步通过相关实验验证。
3.2结论
本研究从山西省长治市一家煤焦化厂工业污水处理系统中的活性污泥池出水口废水中分离得到一株吡啶降解菌JB27,该菌株可以吡啶作为唯一碳源,经16S rRNA基因序列分析和生理生化特性分析,鉴定为Shinella zoogloeoides。菌株JB27降解吡啶的最适pH为8.0或9.0,最适温度为30 ℃。该菌株最快可在6 d内降解3 000 mg·L-1吡啶,其吡啶降解能力高于大多数吡啶降解菌,是一株吡啶高效降解菌,可作为煤化工废水中吡啶类化合物的生物处理的优良菌种资源。本研究结果可为该菌株的应用提供理论依据。
AHN D H, YUN C C, YOO Y J, et al. 1996. Improved treatment of tannery wastewater using Zoogloea ramigera and its extracellular polymer in an activated sludge process [J]. Biotechnology Letters,18(8): 917-922.
AN D S, IM W T, YANG H C, et al. 2006. Shinella granuli gen. nov., sp. nov., and proposal of the reclassification of Zoogloea ramigera ATCC 19623 as Shinella zoogloeoides sp. nov [J]. International Journal of Systematic and Evolutionary M icrobiology, 56(Pt 2):443-448.
BAI Y, SUN Q, ZHAO C, et al. 2009. Aerobic degradation of pyridine by a new bacterial strain, Shinella zoogloeoides BC026 [J]. Journal of Industrial M icrobiology Biotechnology, 36(11): 1391-1400.
CHATTERJEE S, BISWAS S, GANGULY S, et al. 2013. Isolation of pyridine degrading bacteria from soils contam inated w ith petrochem ical industry effluents in Purba Medinipur [J]. Journal of Biological Environment SCI, 7(20): 109-119.
DENG X, WEI C, REN Y, et al. 2011. Isolation and identification of Achromobacter sp. DN-06 and evaluation of its pyridine degradation kinetics [J]. Water, Air, and Soil Pollution, 221(1-4):365-375.
HAN M, LI G, SANG N, et al. 2011. Investigating the bio-toxicity of coking wastewater using Zea mays L. assay [J]. Ecotoxicology and Environmental Safety, 74(4): 1050-1056.
ILORI M O, PICARDAL F W, RODOLFO A, et al. 2015. Catabolic plasmid specifying polychlorinated biphenyl degradation in Cupriavidus sp. strain SK-4: Mobilization and expression in a pseudomonad [J]. Journal of basic m icrobiology, 55(3): 338-345.
KAECH A, VALLOTTON N, EGLI T. 2005. Isolation and characterization of heterotrophic bacteria able to grow aerobically w ith quaternary ammonium alcohols as sole source of carbon and nitrogen [J]. Systematic and Applied M icrobiology, 28(3):230-241.
KHASAEVA F, VASILYUK N, TERENTYEV P, et al. 2011. A novel soil bacterial strain degrading pyridines[J]. Environmental Chem istry Letters, 9(3): 439-445.
KIM O S, CHO Y J, LEE K, et al. 2012. Introducing EzTaxon-e: a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species [J]. International Journal of Systematic and Evolutionary M icrobiology, 62(Pt3): 716-721.
KIM S K, LEE C G, YUN H S. 2003. Heavy metal adsorption characteristics of extracellular polysaccharide produced by Zoogloea ramigera grown on various carbon sources [J]. Journal of M icrobiology and Biotechnology, 13(5): 745-750.
LARKIN M A, BLACKSHIELDS G, BROWN N P, et al. 2007. Clustal W and Clustal X version 2.0 [J]. Bioinformatics, 23(21):2947-2948.
LI J, CAI W, CAI J. 2009. The characteristics and mechanisms of pyridine biodegradation by Streptomyces sp. [J]. Journal of Hazardous Materials, 165(1-3): 950-954.
MATHUR A K, MAJUMDER C B, CHATTERJEE S, et al. 2008. Biodegradation of pyridine by the new bacterial isolates S. putrefaciens and B. sphaericus [J]. Journal of Hazardous Materials,157(2-3): 335-343.
MOHAN S V, SISTLA S, GURU R K, et al. 2003. M icrobial degradation of pyridine using Pseudomonas sp. and isolation of plasmid responsible for degradation [J]. Waste M anagement, 23(2):167-171.
QIAO L, WANG J. 2010. M icrobial degradation of pyridine by Paracoccus sp. isolated from contaminated soil [J]. Journal of Hazardous Materials, 176(1): 220-225.
SAG~ Y, KUTSAL T. 1995. Biosorption of heavy metals by Zoogloea ramigera: use of adsorption isotherms and a comparison of biosorption characteristics [J]. Chem ical Engineering Journal andthe Biochem ical Engineering Journal, 60(1-3): 181-188.
SHEN J, ZHANG X, CHEN D, et al. 2014. Kinetics study of pyridine biodegradation by a novel bacterial strain, Rhizobium sp. NJUST18 [J]. Bioprocess and Biosystems Engineering, 37(6):1185-1192.
SHEN J, ZHANG X, CHEN D, et al. 2015. Characteristics of pyridine biodegradation by a novel bacterial strain, Rhizobium sp. NJUST18 [J]. Desalination and Water Treatment, 53(7):2005-2013.
TAMURA K, STECHER G, PETERSON D, et al. 2013. MEGA 6:molecular evolutionary genetics analysis version 6.0 [J]. Molecular Biology and Evolution, 30(12): 2725-2729.
WAN X, LIU H, LIAO Y, et al. 2007. Isolation of a novel strain of Aeromonas media producing high levels of DOPA-melanin and assessment of the photoprotective role of the melanin in bioinsecticide applications [J]. Journal of App lied M icrobiology,103(6): 2533-2541.
WASI S, TABREZ S, AHMAD M. 2013. Toxicological effects of major environmental pollutants: an overview [J]. Environmental Monitoring and Assessment, 185(3): 2585-2593.
ZUBAKHIN N P, KLUSHIN V N, DM ITRIEVA D A, et al. 2011. Removing petroleum products from coke-plant wastewater by means of coal concentrates and coking products [J]. Coke and Chem istry, 54(4): 129-132.
东秀珠, 蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社: 353-398.
黄开东, 李强, 汪炎. 2012. 煤化工废水“零排放”技术及工程应用现状分析[J]. 工业用水与废水, 43(5): 1-6.
孙庆华, 柏耀辉, 赵翠, 等. 2008. Shinella zoogloeoides BC026对吡啶的降解特性研究[J]. 环境科学, 29(10): 2938-2943.
周敏, 王小虎, 魏松波, 等. 2011. 焦化废水吡啶降解菌的筛选及降解条件[J]. 燃料与化工, 42(2): 44-49.
周学双, 赵秋月. 2009. 对我国煤炭利用与煤化工产业发展的环保思索[J]. 中国煤炭, 35(11): 106-109.
Identification and Characterization of A Pyridine Degrading Bacterium
JIN Tingting*, REN Jiahong, ZHANG Hui, SUN Sha, CHEN Yanbin, BAI Fenglin
Department of Biological Science and Technology, Changzhi College, Changzhi 046011, China
In this study, we isolated pyridine-degrading bacteria from the activated sludge treating coking wastewater of a coal coking plant in Changzhi, Shanxi province. A bacterial strain JB27 w ith high pyridine degradation capability was isolated and identified. The characterization of pyridine degrading was also analyzed. Strain JB27 w as classified and identified through colony morphology observation, m icroscopic observation, physiological characteristics and 16S rRNA sequence analysis. The mass concentration of pyridine and OD600value of the culture of strain JB27 were determined w ith ultraviolet spectrophotometer and visible spectrophotometer respectively. We also analyzed the pyridine-degrading efficiency and OD600of cultures of strain JB27 at different pH values, temperatures, initial mass concentration of glucose and pyridine. Strain JB27 was identified as Shinella zoogloeoides. It could grow using pyridine as only carbon resource. Strain JB27 degraded pyridine over a w ide range of pH (pH 5.0~9.0). The optimal pH value for pyridine degradation was 8.0 or 9.0. The optimal tem perature w as 30 ℃. Addition of glucose decreased pyridine degradation rate, w as unfavourable for the degradation of pyridine by strain JB27. Pyridine-degrading efficiency was proportionate to the OD600of cultures. In the media with 500, 1 000, 1 500, 2500 and 3000 mg·L-1pyridine, strain JB27 could degrade over 99% pyridine w ithin three, four, four, five and six days respectively. The pyridine degradation capability of strain JB27 was higher than many pyridine-degrading strains. S.zoogloeoides JB27 is an efficient pyridine degrading strain and w ill be the excellent one for the biodegradation of pyridine in coking wastewater. Results in this paper provide theory evidence for the application of strain JB27.
pyridine degrading bacterium; coking wastew ater; classification and identification; pyridine degrading characteristics
10.16258/j.cnki.1674-5906.2016.07.018
X172
A
1674-5906(2016)07-1217-08
国家级大学生创新创业训练计划项目(201410122003);山西省高等学校大学生创新创业训练项目(2014428);山西省高等学校科技创新项目(2016176)
晋婷婷(1987年生),女,讲师,博士,研究方向为环境微生物。E-mail: jintingi@163.com *通信作者
2016-06-28
