盐胁迫对白榆无性系抗氧化酶活性及丙二醛的影响
2016-10-20苏丹李红丽董智张晓晓贾淑友
苏丹,李红丽,3,董智,3†,张晓晓,贾淑友
(1.山东省土壤侵蚀与生态修复重点实验室,271018,山东泰安;2.山东农业大学林学院,271018,山东泰安; 3.泰山森林生态定位站,271018,山东泰安)
盐胁迫对白榆无性系抗氧化酶活性及丙二醛的影响
苏丹1,2,李红丽1,2,3,董智1,2,3†,张晓晓1,2,贾淑友1,2
(1.山东省土壤侵蚀与生态修复重点实验室,271018,山东泰安;2.山东农业大学林学院,271018,山东泰安; 3.泰山森林生态定位站,271018,山东泰安)
为了促进滨海盐渍荒漠化地区的植被恢复、引种栽培与盐碱土的改良利用,以3个白榆无性系Y65225、Y46和Y51为试验材料,采用盆栽模拟方法,分析白榆无性系在不同浓度(0.0%、0.3%、0.5%、0.7%和0.9%)NaCl处理下抗氧化酶(SOD、POD和CAT)活性、丙二醛(MDA)含量变化及各指标的相关性,并运用隶属函数法,综合评价3个白榆无性系的耐盐性。结果表明:在各盐浓度胁迫下,Y51能够维持较高的抗氧化酶活性,抗氧化能力最强; Y46的抗氧化酶活性下降最大,抗氧化能力最差,Y46的MDA含量增加幅度最大,受到的盐害最大;Y51的MDA含量增加幅度最小,受到的盐害最小。3个白榆无性系的SOD活性与POD活性,呈极显著正相关,CAT活性与SOD活性、POD活性相关性不显著,CAT、POD活性与MDA含量相关性不强,SOD活性与MDA含量呈显著负相关关系,即SOD活性的增加,可显著减少MDA的积累,增强其抗盐性。综合各项指标,Y51抗盐能力最强,Y65225次之, Y46最差。建议在滨海盐碱地区造林时,优先采用Y51无性系。研究结果将为今后白榆无性系在盐碱地的栽培,提供一定的参考。
白榆无性系;抗氧化酶;丙二醛;耐盐性;滨海盐碱地
土地的盐渍化造成土壤成为盐土、碱土或盐化、碱化土壤,影响植物的生长与生存,造成生物产量的下降或永久性丧失,解决土地盐碱化的根本途径在于恢复植被、改善土壤结构[1]。植被恢复的关键在于耐盐植物种的筛选,而植物耐盐性生理、生化指标是研究耐盐能力的基础,关于耐盐植物的生理特性及耐盐性评价,一直受到众多学者的关注[2-3]。滨海盐碱地的地下水及土壤中的含盐量高,且主要成分是NaCl[4],土壤条件恶劣,土地生产力低,严重威胁区域农林牧业的可持续发展。土壤中的盐分多少,直接影响种子的萌发和植物的成活,限制了植物的生长和产量[5],而种植耐盐植物可减少土壤蒸发量,阻止地表返盐,从而降低土壤的盐碱化程度[6],是改良盐碱地生态环境的重要途径,对于生态系统的良性循环和永久性建设均有长远的益处[7]。S. R.Niknam等[8]研究表明,温室幼苗的筛选与田间成株植物耐盐性选择并无显著差异,因此,可以通过育种、盆栽和大田试验等方法,筛选出耐盐性较强的品种。
白榆(Ulmus pumila)是我国分布最为广泛和重要的速生阔叶用材树种,是北方广大平原、沙荒地营造用材林和防护林、盐碱地造林及四旁绿化的重要树种[9],具有良好的耐旱、耐寒、耐盐碱和抗风能力。开展白榆优良无性系抗盐性的筛选研究,对于生物改良盐碱地具有重要意义。目前,关于白榆的研究多为其育苗和栽培技术[10-12],而对于白榆无性系的耐盐性,多集中于盐胁迫下的生长量和生长状况[13]、相对电导率[14]等的变化,盐胁迫对种子萌发、出苗和幼苗生长的影响[15],白榆的光合特性及游离脯氨酸、可溶性糖的变化特征[16]等方面;但对不同盐分浓度胁迫下,白榆无性系抗氧化酶活性及丙二醛变化的研究鲜见报道。基于此,本文通过研究5个NaCl盐分胁迫,对3个白榆无性系抗氧化酶活性和丙二醛含量的影响,揭示其对盐分胁迫的响应与适应机制,进而分析其耐盐性强弱,为滨海盐碱地造林绿化苗木的选育、植被恢复以及生态改良提供科学的理论依据。
1 材料与方法
1.1试验材料
试验地点位于山东农业大学林学实验站(E 36° 16',N 117°11'),全部试验在长度25 m、宽度10 m、高度3m、四周通风的塑料遮雨棚内完成,确保生长季节降雨过程不影响盆栽材料的水分控制。试验用材为山东省林业科学院苗圃提供的长势一致的3种一年生白榆无性系盆栽苗,其编号分别是Y65225、Y46和Y51,各无性系组培苗,经大田炼苗后,植入高40 cm、直径20 cm的花盆中。花盆底部开孔,并用无纺布遮盖,保证盆内土壤不外流,且可通过底部开孔吸水。盆内装有普通壤土、细沙与泥碳土,并按2∶1∶1的干质量比混合的土壤,土壤高度为花盆高度的3/4,保持各盆土壤的重量一致。于2014年6月份,将无性系苗植入塑料大棚,排除其他环境干扰,同时,定期浇水,保证其成活和生长。移入大棚后,记录其初期生长高度、地径和分枝数等基本情况,以后每隔半个月记录一次,待生长稳定后,开始进行盐处理。各无性系在不同盐浓度处理下,苗高与地径的净生长量差别较大(表1),差异显著(P<0.05)。

表1 盐胁迫下3个白榆无性系的净生长量Tab.1 Net growth of three elm clones under salt stress
1.2试验处理
基于滨海盐碱地土壤盐分以NaCl为主的特征, 2014年7月5日,配制质量分数分别为0(CK)、0.3%、0.5%、0.7%和0.9%(9 g/L)的NaCl溶液进行盐处理,每个梯度处理6个重复,每个白榆无性系30盆,3个无性系共计90盆。处理过程中,根据白榆的需水量,将花盆浸泡于相应的盐溶液中,使其通过花盆底部的开孔充分吸水,一周2~3次,每次浸泡时间6~10 h左右。每经过3次盐水浸泡,进行一次洗盐。浸泡时,将花盆的3/4至4/5处浸于盐水中,对照组选择同样的处理方式浸泡于自来水中。对于0.7%和0.9%处理,为了防止植株猝死,在前3次,即一个洗盐周期内,浸泡于0.5%的盐溶液中,一次洗盐之后,再浸泡于各自相应盐分梯度内。清洗时,用自来水从花盆上部灌水,缓慢灌多次,将花盆浇透至盆内有水流出,以达到去除花盆中盐分的目的,防止盐分在花盆内过度积累,导致更高浓度的盐害。盆栽苗洗盐静置3 h后,随即再进行盐水浸泡处理,如此反复处理4轮后,开始各项内容测试。为保证苗木正常生长,不同盐处理与对照组均直接加入25%Hoagland(霍格兰溶液)作为营养液。每次盐处理之后,根据大棚光线、温度适当轮换调整各盐分梯度、无性系盆栽苗的摆放位置,以消除位置效应引起的生长量差异问题。除了正常盐水浸泡处理和洗盐过程之外,试验苗不额外浇水。试验苗除常规采样外,试验期间避免人为修剪。
1.3测定指标及方法
主要测定不同盐梯度下白榆叶片的抗氧化酶活性与丙二醛(MDA)含量,抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)与过氧化氢酶(CAT)。SOD活性采用氮蓝四唑(NBT)光化还原法测定,POD活性采用愈创木酚显色法测定,CAT活性采用紫外吸收法测定,MDA含量采用硫代巴比妥酸(TBA)法测定[17-18]。
1.4耐盐性评价方法
白榆无性系耐盐性评价采用隶属函数法[19],计算3种白榆无性系各测定指标,并对其耐盐性指标进行排序,综合评价其耐盐性,筛选出耐盐性强的品种。耐盐性隶属函数值的计算方法如下。
如果指标与耐盐性呈正相关,则

如果指标与耐盐性呈负相关,则
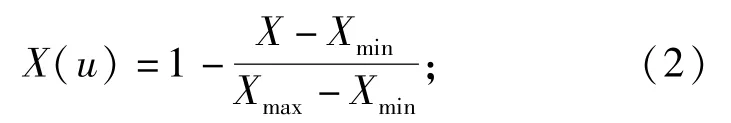
测定指标隶属函数值的平均值

式中:u为测定的指标;X为某一指标的测定值;Xmax为某一指标的测定值中的最大值;Xmin为某一指标的测定值中的最小值;计算各耐盐性指标隶属函数值的平均值Δ,其Δ值越大,耐盐性越强。
1.5数据处理方法
实验数据处理和相关分析用Microsoft Excel 2003和SPSS19软件完成。
2 结果与分析
2.1盐胁迫对白榆无性系抗氧化酶活性的影响
2.1.1盐胁迫对白榆无性系SOD活性的影响
SOD是活性氧的主要清除剂,通过清除活性氧,控制膜脂过氧化作用,从而降低活性氧对膜系统的伤害。图1显示,3个白榆无性系叶片中的SOD活性均在盐的质量分数为0.3%时达到峰值,之后,盐的质量分数升高,SOD活性降低。方差分析表明,同一无性系、不同盐质量分数处理间,SOD活性差异显著(P<0.05)。多重比较表明,对于Y65225来说,除0.5%盐处理SOD活性与CK间差异不显著外,其余质量分数间差异明显Y46各质量分数间SOD差异显著,而Y51则仅0.3%质量分数与其他质量分数间的SOD差异明显,其余质量分数间没有显著差异。当盐的质量分数为0.9%时,Y65225、Y46和Y51与对照相比,分别降低了23.66%、27.84%和1.15%,Y65225和Y46的SOD活性较对照均显著降低。Y51的SOD活性,除在0.3%的盐质量分数下与CK相比显著增加外,在其余各种盐质量分数下变化不大,且在0.9%的高盐质量分数胁迫下,Y51能够维持较高的SOD活性,说明Y51的抗氧化能力较强。
2.1.2盐胁迫对白榆无性系POD活性的影响
POD通过催化其它底物,消除SOD清除活性氧过程中产生的过量的过氧化氢,使具有毒害作用的过氧化氢维持在一个较低的水平。图2显示,白榆无性系Y65225、Y46和Y51叶片的POD活性,在盐质量分数为0.3%时显著增加,当盐质量分数大于0.3%,盐质量分数增加POD活性降低。方差分析表明,在0.3%~0.7%的盐质量分数区间,Y51的POD活性差异不显著,且一直维持较高水平,而Y65225和Y46则显著降低;在0.9%的高盐质量分数胁迫下,与对照相比,Y65225和Y46 2个品系,分别降低了42.43%和86.29%,而Y51的POD活性在0.9%的高盐质量分数下,仍然高于对照,即在高盐质量分数下,Y51仍能维持较高的POD活性,来抵抗过氧化氢对细胞的毒害作用,与Y65225和Y46相比,Y51的抵抗盐胁迫能力更强。

图1 不同质量分数盐胁迫对白榆无性系SOD活性的影响Fig.1 Effects of different concentrations of salt stress on SOD(dismutase)activities in elm clones

图2 不同质量分数盐胁迫对白榆无性系POD活性的影响Fig.2 Effects of different concentrations of salt stress on POD(peroxidase)activities in elm clones
2.1.3盐胁迫对白榆无性系CAT活性的影响
CAT可通过消除植物体内过多的过氧化氢,而使其维持在低质量分数水平,以此保护细胞的膜结构,防御盐分对细胞的伤害及氧化胁迫带来的损伤。由图3可知,Y65225和Y46的CAT活性在盐质量分数为0.3%时降低,在盐质量分数为0.9%时,较CK分别降低了51.56%和62.86%。Y51的CAT活性在盐质量分数为0.3%时,显著降低;在盐质量分数为0.5%时,显著升高,且高于对照;在盐质量分数为0.7%时,降低到对照水平以下;在0.9%的高盐质量分数下,CAT活性又有所升高,且方差分析表明,与0.7%盐质量分数下的CAT活性相比差异显著。综上所述,低盐质量分数胁迫可以降低CAT活性,高盐质量分数胁迫下,Y46的CAT活性最低,Y51对于盐质量分数的变化反应最为敏感,尤其是在高盐质量分数胁迫下,仍能够提高CAT活性抵御盐胁迫。

图3 不同质量分数盐胁迫对白榆无性系CAT活性的影响Fig.3 Effects of different concentrations of salt stress on CAT(catalase)activities in elm clones
2.2盐胁迫对白榆无性系MDA含量的影响
MDA是植物在逆境下膜脂过氧化的主要产物,其含量的多少直接反映膜脂过氧化程度。由图4看出,3个白榆无性系MDA含量呈现盐质量分数越大,其质量分数越多的现象。在盐质量分数为0.3%时,Y46的MDA含量较CK显著增加,Y65225的MDA含量增加不显著,而Y51则有所降低;当盐质量分数继续增大,Y51的MDA含量虽有所增加,但差异不显著,在0.9%的高盐质量分数胁迫下,与CK相比,Y65225、Y46和Y51的MDA含量分别增加36.41%、115.58%和23.37%,即Y46的MDA含量增加幅度最大,Y65225次之,Y51最小。
2.3白榆无性系各指标间的相关性分析

图4 不同质量分数盐胁迫对白榆无性系MDA含量的影响Fig.4 Effects of different concentrations of salt stress on MDA (malondialdehyde)mass content in elm clones
在不同质量分数盐胁迫下,对3个白榆无性系的抗氧化酶活性及丙二醛含量进行相关性分析,结果由表2可知,SOD与POD呈极显著正相关(P<0.01),即SOD活性增加,则POD活性也增加。SOD、POD与CAT活性间呈正相关关系,但相关性不显著。抗氧化酶活性与MDA含量呈负相关关系,其中,SOD活性与MDA含量呈显著负相关(P<0.05),即SOD活性增加消除过多的活性氧,可以降低膜脂过氧化作用,而作为膜脂过氧化作用产物的MDA含量会随之减少。由抗氧化酶、MDA各指标间的相关性可知,白榆无性系在盐胁迫的逆境条件下,能够协调统一地抵御逆境胁迫,保持植物体细胞的完整性,维持植物的正常代谢和生长。

表2 盐胁迫下白榆无性系各指标间的相关分析Tab.2 Correlation analysis among the indices of elm clones under salt stress
2.4白榆无性系耐盐能力综合评价
利用隶属函数法,对3个白榆无性系的抗氧化酶活性及丙二醛含量进行耐盐性综合评价,其耐盐能力排序结果如表3所示,表中数值越高,表明该无性系在该指标下耐盐力越强。Y51的SOD活性、POD活性和CAT活性隶属值均为最高,即在这3个指标上的耐盐性较其他2个无性系强,而Y65225在MDA含量上表现出较强的耐盐性。从3个无性系的各指标的平均值中可以得出:Y51的耐盐性最强,Y65225次之,Y46的耐盐性最差。
3 结论与讨论
盐胁迫对植物的伤害作用被认为是盐对植物的原初直接伤害作用。植物的有氧代谢过程中,能够将氧气还原成水。这个过程是植物生长和发育重要的能量来源,但当植物受到逆境胁迫时,还原过程不完全,就会产生活性氧[20-21]。活性氧具有很强的氧化能力,可与植物组织中的生物大分子发生反应,并发生膜脂过氧化作用,降低保护酶的活性。植物体本身拥有一套抗氧化酶防御系统,通过清除活性氧来减轻其对植物体造成的损伤,其中,最主要的抗氧化酶是SOD、POD和CAT等。在抗氧化酶系统中, SOD可将活性氧歧化为H2O2与O2,控制脂氧化,减少膜系统的伤害,而H2O2对植物也具有毒害作用, POD和CAT则是H2O2的主要清除剂[22]。杜世章等[23]研究表明,豇豆幼苗的抗氧化酶活性在一定盐质量分数范围内增加,当超过该盐质量分数后,抗氧化酶活性降低,在受到盐胁迫时,豇豆通过抗氧化酶活性的升高来提高其应对NaCl胁迫的能力。笔者研究中,3个白榆无性系在盐质量分数低于0.3%时SOD活性及POD活性升高,说明在受到盐胁迫时,白榆能够积极做出响应,通过提高抗氧化酶活性,来减轻活性氧对植物产生的伤害;盐质量分数高于0.3%时,超过了白榆无性系的耐受能力,抗氧化酶活性下降,其自身调节能力便会降低。3个白榆无性系的CAT活性与其研究的结果不同,随着盐质量分数的升高变化规律性不强,且CAT活性较少,说明白榆无性系的抗氧化作用主要是依靠SOD和POD,而CAT起到的作用不大。3个白榆无性系中, Y51在各盐质量分数胁迫下,能够维持较高的抗氧化酶活性,Y46在各盐质量分数下,抗氧化酶活性最低,说明Y51的抗氧化能力最强,Y65225次之,Y46的抗氧化能力最弱。
活性氧诱导的膜脂过氧化作用是外界胁迫造成的细胞水平上的伤害,膜脂过氧化作用的主要产物MDA是反映氧化伤害的常用指标,MDA含量增加幅度的大小,反映了其抵抗盐胁迫的能力的强弱[24]。MDA通过影响细胞对离子的吸收、积累及活性氧代谢系统的平衡,进而破坏植物细胞膜透性,并影响其生理代谢[25]。本研究表明,盐质量分数增大,MDA含量也增加。在低盐质量分数下,抗氧化酶活性均有不同程度的增加,减轻活性氧对植物的膜脂过氧化作用,因而,在低盐质量分数处理下, MDA含量增加不明显;但在高盐质量分数下,SOD和POD活性均下降,使得细胞内的H2O2积累增加,引起自由基的连锁反应,发生的膜脂过氧化作用破坏膜结构的完整性,导致MDA含量升高,这是植物抗氧化酶分解消除活性氧的反应。这一结果与郑世英等[26]的研究结果相同。在0.9%的高盐质量分数下,Y46的MDA含量与对照相比,增加幅度最大,说明盐胁迫对其损伤最大,抗盐能力最弱;Y51的MDA含量与对照相比,增加幅度最小,即Y51的膜脂过氧化作用最弱,抵御盐胁迫的能力最强。
袁琳等[27]研究结果表明,SOD、POD和CAT之间呈正相关关系,本实验结果与其研究相吻合,其中,SOD与POD的活性呈极显著正相关关系,两者共同作用抵御盐胁迫的损伤,而两者与CAT活性的相关性不大,说明SOD、POD与CAT的协同作用不明显。MDA含量表明了氧化伤害的程度,各指标相关性分析表明,抗氧化酶活性与MDA呈现负相关关系,这与袁琳等研究结果相反,可能是由于研究的植物种不同,抗氧化酶与丙二醛之间的协同作用的强弱不同所致。
运用隶属函数法,对3个白榆无性系的耐盐能力综合评判的结果表明,Y51耐盐能力最强,Y46耐盐能力最差,建议在滨海盐碱地区造林时,优先采用Y51无性系。
[1] 李红丽,丁国栋,董智,等.中捷农场滨海盐碱地立地类型划分及其植被恢复技术[J].中国水土保持科学,2010,8(5):86. Li Hongli,Ding Guodong,Dong Zhi,et al.Site classification and vegetation restoration technique of coastal saline land in the Zhongjie farm[J].Science of Soil and Water Conservation,2010,8(5):86.(in Chinese)
[2] Marcar N,Ismail S,Hossain A.Trees,shrubs and grasses for saltlands[M].Canberra:Australian Centre for International Agricultural Research,1999,211-213.
[3] 张建锋,李吉跃,宋玉民,等.植物耐盐机理与耐盐植物选育研究进展[J].世界林业研究,2003,16 (2):16. Zhang Jianfeng,Li Jiyue,Song Yumin,et al.Advances in research on the mechanism of plant salinity tolerance and breeding of salt-tolerant plants[J].World Forestry Research,2003,16(2):16.(in Chinese)
[4] 刘玉涛.隔盐措施对滨海盐碱地土壤水盐运动及四个树种生长与光合作用的影响[D].泰安:山东农业大学,2010:1-2. Liu Yutao.Effect of salt-isolated treatments on soil water and saltmovementand growth characteristics photosynthesis of four trees in coastal saline-alkaline land[D].Tai'an:Shandong Agricultural University,2010:1-2.(in Chinese)
[5] Munns R.Comparative physiology of salt and water stress [J].Plant,Cell and Environment,2002,25(2):239.
[6] 李金彪,陈金林,刘广明,等.滨海盐碱地绿化理论技术研究进展[J].土壤通报,2014,45(1):246. Li Jinbiao,Chen Jinlin,Liu Guangming,etal.Advances in Research on theory and technology of garden greening on coastal saline land[J].Chinese Journal of Soil Science,2014,45(1):246.(in Chinese)
[7] 罗廷彬,任崴,谢春虹.新疆盐碱地生物改良的必要性与可行性[J].干旱区研究,2001,18(1):46. Luo Tingbin,Ren Wei,Xie Chunhong.Necessity and feasibility of biotic improving the saline and alkaline land in Xinjiang[J].Arid Zone Research,2001,18(1):46. (in Chinese)
[8] Niknam SR,Mccomb JA.Salt tolerance screening of selected Australian woody species:a review[J].Forest E-cology and Management,2000,139(1):1.
[9] 吴丽芝,昭日格,高平升,等.6个白榆种群遗传多样性的RAPD分析[J].干旱区资源与环境,2013,27 (11):57. Wu Lizhi,Zhao Rige,Gao Pingsheng,etal.Genetic diversity of six populations in Ulmuspumila by RAPD[J]. Journal of Arid Land Resources and Environment,2013, 27(11):57.(in Chinese)
[10] 杨喜田,杨臻,曾玲玲,等.不同育苗方式对移栽后侧柏和白榆幼苗根系生长的影响[J].生态学报, 2010,30(1):86. Yang Xitian,Yang Zhen,Zeng Lingling,et al.Effects of different seedling stock types on root growth of Platycladus orientalis and Ulmus pumila’s transplants[J]. Acta Ecologica Sinica,2010,30(1):86.(in Chinese)
[11] 刘易超,黄印冉,张均营,等.白榆新品种‘阳光女孩’嫁接繁育技术研究[J].中国农学报,2015,31 (10):17. Liu Yichao,Huang Yinran,Zhang Junying,et al. Grafting technology of the new Ulmus Cultivar‘Yangguang Nvhai’[J].Chinese Agricultural Science Bulletin,2015,31(10):17.(in Chinese)
[12] 杜振宇,马海林,马丙尧,等.滨海盐碱地混交林效应研究[J].西北林学院学报,2015,30(1):144. Du Zhenyu,Ma Hailin,Ma Bingyao,et al.Effects of mixed forests in coastal saline soil[J].Journal of Northwest Forestry University,2015,30(1):144.(in Chinese)
[13] 慕德宇.离体培养条件下12个白榆优良无性系氯化钠盐分抗性筛选的研究[J].山东大学学报(理学版),2013,48(3):19. Mu Deyu.A research of screening of salt-tolerance of12 elm clones in vitro culture[J].Journal of Shandong U-niversity(Natural Science),2013,48(3):19.(in Chinese)
[14] 夏尚光,张金池,梁淑英.NaCl胁迫对3种榆树幼苗生理特性的影响[J].河北农业大学学报,2008, 31(2):52. Xia Shangguang,Zhang Jinchi,Liang Shuying.Effectof NaCl stress on physiological characteristics of three elm species seedlings[J].Journal of Agricultural University of Hebei.2008,31(2):52.(in Chinese)
[15] 刘炳响,王志刚,杨敏生,等.模拟盐胁迫对白榆种子发芽、出苗及幼苗生长的影响[J].草业学报, 2012,21(5):39. Liu Bingxiang,Wang Zhigang,Yang Minsheng,et al. Effects of simulated salt stress on seed germination, seedling emergence and growth of Ulmus pumila[J]. Acta Prataculturae Sinica,2012,21(5):39.(in Chinese)
[16] 刘炳响,王志刚,梁海永,等.盐胁迫对不同生境白榆生理特性与耐盐性的影响[J].应用生态学报, 2012,23(6):1481. Liu Bingxiang,Wang Zhigang,Liang Haiyong,et al. Effects of salt stress on physiological characters and salttolerance of Ulmus pumila in different habitats[J].Chinese Journal of Applied Ecology,2012,23(6): 1481.(in Chinese)
[17] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:121-123. Li Hesheng.Principle and technology of plantphysiological and biochemical experiments[M].Beijing:Higher Education Press,2000:121-123.(in Chinese)
[18] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003:274-276. Zhang Zhiliang,Qu Weijing.Techniques of plant physiological experiment[M].Beijing:Higher Education Press,2003:274-276.(in Chinese)
[19] 李善春.NaCl盐胁迫下5种地被观赏竹生理特性的研究[D].南京:南京林业大学,2005:72-77. Li Shanchun.Study on the physiological characteristic of five dwarf ornamental bamboos under NaCl stress[D]. Nanjing:Nanjing Forestry University,2005:72-77.(in Chinese)
[20] Fridovich L.Superoxide radical and superoxide dismutases[J].Annual Review Biochemistry,1995,64(7): 97.
[21] Alscher R G,Donahue JL,Cramer C L.Reactive oxygen species and antioxidants:relationships in green cells [J].Physiologia Plantarum,1997,100(2):224.
[22] Lidon F C,Teixeira M G.Oxy radicals production and control in the chloroplast of Mn-treated rice[J].Plant Science,2000,152(1):7.
[23] 杜世章,代其林,奉斌,等.不同浓度NaCl胁迫处理下豇豆幼苗抗氧化酶活性的变化[J].基因组学与应用物学,2011,30(3):351. Du Shizhang,Dai Qilin,Feng Bin,et al.Changes of antioxidant enzymes activities in cowpea(Vigna unguiculata Linn.)seedlings under different concentrative NaCl stress[J].Genomics and Applied Biology,2011, 30(3):351.(in Chinese)
[24] Cavalcanti F R,Lima JP,Ferreira-Silva S L,et al. Roots and leaves display contrasting oxidative response during salt stress and recovery in cowpea[J].Journal of Plant Physiology,2007,164(5):591.
[25] 朱晓军,梁永超,杨劲松,等.钙对盐胁迫下水稻幼苗抗氧化酶活性和膜脂过氧化作用的影响[J].土壤学报,2005,42(3):453. Zhu Xiaojun,Liang Yongchao,Yang Jinsong,et al. Effect of exogenous calcium on antioxidant enzyme activity and lipid peroxidation of rice seedlings under salt stress[J].Acta Pedologica Sinica,2005,42(3):453. (in Chinese)
[26] 郑世英,商学芳,王景平.可见分光光度法测定盐胁迫下玉米幼苗抗氧化酶活性及丙二醛含量[J].生物技术通报,2010,7(24):106. Zheng Shiying,Shang Xuefang,Wang Jingping.Determination of antioxidant enzyme activity and contents of MDA in maize seedlings under salt stress with visible spectrophotometry[J].Biotechnology Bulletin,2010,7 (24):106.(in Chinese)
[27] 袁琳,克热木,张利权,等.NaCl胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响[J].植物生态学报,2005,29(6):985. Yuan Lin,Karim Ali,Zhang Liquan,et al.Effects of NaCl stress on active oxygen metabolism and membrane stability in Pistacia vera seedlings[J].Acta Phytoecologica Sinica,2005,29(6):985.(in Chinese)
Effects of salt stress on activities of antioxidant enzymes and MDA of elm clones
Su Dan1,2,Li Hongli1,2,3,Dong Zhi1,2,3,Zhang Xiaoxiao1,2,Jia Shuyou1,2
(1.Shandong Provincial Key Laboratory of Soil Erosion and Ecological Restoration,271018,Tai'an,Shandong,China;2.Forestry College of Shandong Agricultural University,271018,Tai'an,Shandong,China;3.Taishan Forest Ecosystem Research Station,271018,Tai'an,Shandong,China)
[Background]The coastal saline soil is formed by the seawater immersion in the river sediments,with salting and salt characteristics of a typical modern seawater effects.The typical characteristic of coastal saline-alkali soil is that the content of NaCl and the groundwater level are high. Chlorides,sulfates and salt content in the soil directly affect the survival of the germination of seeds, limiting the growth and yield of plants,which has become themost direct factor of vegetation restoration in coastal saline-alkali soil area.Ulmus pumila L.is the most widely distributed and important fastgrowing hardwood timber species that has solid tolerance to drought,cold,salt and wind.It is the most important timber species in vast north plains,saline-alkali areas and desert to construct useful afforestation,shelter forest and greenings.[M ethods]In order to cultivate,modify and utilize salinized soil of coastal saline area,3 elm clones(Y65225,Y46 and Y51)were chosen as testmaterials,wateringwith 5 salt concentrations of 0.0%,0.3%,0.5%,0.7%,and 0.9%by pot-cultivated experiments in the greenhouse.The activities of dismutase(SOD),catalase(CAT),peroxidase(POD)and mass content ofmalondialdehyde(MDA)were determined in this study.The change of antioxidant enzymes activity and mass content of MDA and the correlation of the indexes were analyzed.In addition,salt resistance of the 3 clones was comprehensively evaluated by subordination function method.[Results] Y51 sustained high antioxidant enzyme activity under different salt concentrations,meaning it had the strongest antioxidant capacity.While as the antioxidant capacity of Y46 was the worst,because its antioxidant enzyme activity decreased in greatest.MDA was an important indicator of injured cell membrane,which shows that the seedlings are efficiently influenced by themembrane lipid peroxidation. The activities ofMDA increased with the salt stress increasing,the greatest increasewas from Y46,while the smallest from Y51 and the salt injury to Y51 was the least.The correlation analysis of the measurement indicators for3 elm clones showed that the correlation of SOD activity and POD activity were significant;besides the CAT activity presented no significant correlation with the above two indicators. The activities of CAT and POD had little significance with the mass content of MDA.Moreover,the activity of SOD showed certain negative correlation with themass content of MDA,i.e.,the increase of SOD significantly reduced the accumulation of MDA mass content,and therefore enhanced the salt resistance of the elm clones.[Conclusions]Ultimately,through overall assessment,salt resistance of Y51 was the highest,less for Y65225 and the lowest for Y46,indicating that they belonged to the middling salt-tolerant elm clones.We recommend that Y51 is the preferred clone in afforestation in the coastal areas.The results of this papermay also provide a certain theoretical significance for cultivating elm clones in the future.
elm clones;antioxidant enzyme;MDA;salt resistance;coastal saline area
S725.1
A
1672-3007(2016)02-0009-08
10.16843/j.sswc.2016.02.002
2015-06-19
2016-01-25
项目名称:世界银行贷款山东生态造林项目“山东生态造林项目生态效益监测与评估”(SEAP-JC-2);中国水利水电科学研究院科研专项“基于含钙废弃物的盐碱土改良技术研究(泥基本科研1575)
苏丹(1992—),女,硕士研究生。主要研究方向:荒漠化防治。E-mail:ximenjingxuan@163.com
简介:董智(1971—),男,博士,副教授,硕士生导师。主要研究方向:荒漠化防治。E-mail:nmgdz@163.com
