富营养化水体中盐度对香蒲去除氮磷作用的影响
2016-10-19刘小川
杨 洁,刘 波,刘小川,张 凯
(天津市水利科学研究院,天津 300061)
富营养化水体中盐度对香蒲去除氮磷作用的影响
杨洁,刘波,刘小川,张凯
(天津市水利科学研究院,天津300061)

富营养化;盐度;氮;磷;生理指标;香蒲
水体富营养化是全球性的重大水环境问题。富营养化水体中富集大量的氮、磷等营养物质,可引起藻类及其他浮游生物迅速繁殖,水体溶解氧含量下降,水质恶化,鱼类及其他生物大量死亡,导致水体生态环境急剧退化。随着对富营养化水体生态系统研究的深入,人们逐渐认识到富营养化控制是一个典型的生态问题。按照生态效率原理(又称1/10规律),食物链网越长,转换损耗越多,因此取出原初生产物,对减少水体中营养盐的效率就高,其中直接去除藻类和水生高等植物,对削减水体中营养物质的效率远高于取出鱼类等资源[1]。
水生高等植物是生态系统中重要的初级生产者,对富营养化水体中的营养物质具有吸附沉淀、吸收代谢、富集浓缩等多种功能。此外,水生植物还具有创造环境多样性、保护生物多样性的生态功能。水生植物的存在,有利于形成一个良好的水生态系统,并能在较长时间内保持水质的稳定性。因此,恢复和重建水生高等植物是富营养化水体治理和生态恢复的关键。
已有大量研究表明,水生植物对水中氮磷等营养物质的去除受植物种类[2]、光照、温度、水体pH值、水位变化、水中营养盐含量、底质条件等因素的影响。但在含盐量高的富营养化水体中,除上述影响因素外,盐度是植物生长最主要的限制因子。植物在盐胁迫环境下,其生长发育及生理生化都会受到一定的影响,从而影响植物对水中营养物质的吸收和转化。目前关于这方面的研究较少,因此,本研究针对含盐量高的富营养化水体,选取淡水中常用的大型挺水植物香蒲(TyphaangustifoliaL.),评价香蒲对盐的耐受性以及盐胁迫对香蒲生理生态影响,探讨富营养化水体中盐度对香蒲去除水中氮磷的影响,为在滨海盐碱地区富营养化水体的防治提供技术支撑。
1 材料与方法
1.1材料
试验植物选用天津市北大港水库的土著植物香蒲,选取高矮和粗壮程度相近的植株,种植在7 L并装有2 kg石英砂的塑料桶中,每种植物栽植3~4桶,每桶4~5株,首先用1.5 L 1/2 Hoagland溶液[3]缓苗2周。
1.2试验设计
1.2.1香蒲耐盐性试验
缓苗完成后,选择生长基本一致、带根的植株(平均高度为61 cm±3.2 cm),修剪整齐后种植在7 L并装有2 kg石英砂的塑料桶进行盐胁迫试验。不同浓度的NaCl溶液采用NaCl与Hoagland溶液配制得到,设置4个盐度梯度,分别为0.50%、1.00%、1.50%和2.00%。对照组(CK)不含有NaCl。上述每个处理组均设3个重复。胁迫期间每隔3 d换水1次,保持盐溶液浓度的稳定。每天观察和记录植物的生长状况,试验周期为25 d。考虑到挺水植物的景观效果,因此在香蒲耐盐性评价中根据植物的存活阈值[4](植物存活阈值是指植株生长在一定盐浓度的土壤或水体中,植株死亡数超过50%时的土壤或水体的盐浓度)来确定植物的耐盐程度。
1.2.2盐胁迫对植物去除水中氮磷影响试验
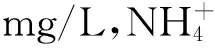

1.2.3盐胁迫对植物生理生化指标影响试验
植物的盐胁迫处理方法与1.2.1相同,设置4个盐度,分别为0、0.30%、0.50%和1.00%,每个处理组设置3个重复。在植株受盐胁迫的第2天、5天、8天、14天和第19天的上午8:00—9:00取植株3~5片成熟叶片的中上部,采样后迅速带回试验室,用蒸馏水洗净、擦干、称重,然后测定叶绿素、丙二醛、脯氨酸和过氧化氢酶4种生理指标。
1.3分析方法

植物生理指标测定方法是,叶绿素:无水乙醇法(Amon法)提取并测定,由Lambert-Beer定律计算不同色素成分的含量[5];丙二醛(MDA):硫代巴比妥酸氧化法[6];脯氨酸(Pro):酸性印酸酮法[6]。
数据分析与处理采用Excel和SPSS13.0进行数据统计和分析。采用单因素方差分析法对不同配置处理组的水体处理效果进行显著性差异分析,对不满足方差齐性检验数据进行Dunnett’C检验。
2 结果与讨论
2.1香蒲耐盐能力评价
经观察记录,在0和0.50%盐度下香蒲生长良好,无明显胁迫症状。在1.00%的盐度水平下,植株叶尖或叶缘有枯黄症状,但很快又长出新叶,且新叶生长良好。但在1.50%和2.00%的盐度水平下,在胁迫的第一周植株叶片即表现出明显的受害症状,大量叶片变黄、卷曲甚至死亡。所有植株在2.00%的盐度水平下,在第一周内即全部死亡。经统计,在0.05%、0.50%和1.00%的盐度下,香蒲存活率分别为98%、95%和68%。结合存活率的大小,香蒲的耐盐存活阈值可达到1.00%。
2.2不同盐度下香蒲对水中氮磷的去除效果


图1 不同盐度下香蒲对水中TN和-N的去除
富营养化水体中,水生植物系统对氮的去除主要通过植物的吸收和根际微生物的硝化和反硝化过程实现。从前述研究可以看到盐度的增加影响了香蒲的正常生长。有研究[7-8]指出,盐度作为一种非生物抑制剂,会影响植物根系正常生长以及根系分泌物的产生,而这些均会对根系微生物生长和新陈代谢产生显著抑制作用。此外,大量Na+的存在对植物组织氨氮吸收也会产生显著的抑制作用[9],从而导致高盐度下香蒲对水中氮吸收效率下降。Brown 等[10]在研究中指出,逐渐增加的盐度会显著地抑制植物-土壤系统对总氮和无机氮的去除。Klomjek等[11]在其研究中也提出高盐浓度是引起植物对水中氮去除效果较差的主要原因。

表1 不同盐度下香蒲对水体中氮磷的去除率 %
注:每列上的值表示在不同盐度下对营养盐的平均去除率,其中同一列上平均值后是相同的字母,则表示不同盐度下植物对营养盐去除率差异不显著(p≥ 0.05),反之,差异显著(p<0.05)。
与无植物空白组相比,香蒲在设定盐度范围内对水中TP具有显著去除效果。19 d后,水体中TP质量浓度可由初始时的3.67 mg/L降到0.01 ~1.35 mg/L(图2)。盐度对香蒲去除TP的影响显著(p<0.05)。0、0.30%、0.50%和1.00%盐度下,TP的平均去除率分别为99.75%、97.38%、97.07%和63.34%(表1)。

图2 不同盐度下香蒲对水中TP的去除
种有水生植物的系统中,水体中磷的去除主要通过基质吸附和固化、植物吸收、微生物吸收和同化3种方式。本项研究表明香蒲对总磷具有较高的去除效率,可作为去除水中磷的先锋物种。随着水体中盐度的增加,特别是当盐度为1.00%时,水体中TP去除率显著下降,分析原因,一方面是盐度的增加影响了植物的正常生长,另一方面是对植物根际周围的嗜磷菌对磷的吸收产生了抑制作用。
2.3不同盐度下香蒲叶片中主要生理指标变化
2.3.1叶绿素含量的变化
叶绿体是植物进行光合作用的重要器官,其中叶绿素是叶绿体的重要组成部分,也是重要的光合作用物质。叶绿素含量的多少在一定程度上反映了植物光合作用的高低,从而影响植物的生长[12]。
由图3可以看出,盐胁迫对香蒲的叶绿体结构造成了一定程度的伤害,盐胁迫下香蒲叶片组织中叶绿素含量较对照显著下降。此外,在NaCl胁迫条件下,香蒲叶片组织中叶绿素含量随时间呈先上升后下降的趋势,胁迫第19天时, 0.30%、0.50%和1.00%盐度水平下,叶片组织中叶绿素含量分别较对照下降了42.3%、49.4%和59.6%。这说明香蒲叶片组织中叶绿体对NaCl胁迫反应是非常敏感,叶绿素含量可作为香蒲在盐胁迫下的一个重要的检测指标。

注:指植物湿重情况下的ρ(Chl-a)。图3 不同盐度下香蒲叶片中叶绿素含量变化
2.3.2脯氨酸含量的变化
图4为不同盐度下香蒲叶片组织中脯氨酸含量随胁迫时间的变化情况。从图4可知,当盐度小于0.50%时,植物组织内脯氨酸含量随盐度增加和胁迫时间的延长变化不大,但当盐度增加到1.00% 时,叶片组织内的脯氨酸含量激增,胁迫至第8天时最高,含量较对照增加了58.8%,再延长胁迫时间叶片组织中脯氨酸含量呈缓慢下降趋势,至第19天仍较对照增加了24%。植物对盐害的响应机制之一就是迅速产生小分子相溶性有机物来调节渗透胁迫[13-14]。其中脯氨酸是许多植物在盐胁迫下产生比较广泛的相溶性小分子有机物质。脯氨酸的积累是植物抵抗渗透胁迫的一种有效的保护性措施,保护酶和膜系统免受毒害。在较高盐度(1.00%)胁迫下,脯氨酸含量明显升高,说明香蒲会通过积累脯氨酸来调节体内细胞的渗透势,从而缓解盐胁迫对其造成的伤害。有研究[15]指出,在通常情况下,仅当培养液中盐浓度达到一定阈值时,植物体内才开始积累脯氨酸。对于香蒲而言,其NaCl胁迫下的阈值为1.00%,这与前述2.1中通过香蒲外部形态特征得到的耐盐存活阈值相吻合。

注:指植物湿重情况下的脯氨酸含量。图4 不同盐度下香蒲叶片中脯氨酸含量变化
2.3.3丙二醛(MDA)含量的变化
在盐胁迫下,植物在叶绿体和线粒体内会产生大量的氧自由基,如过氧化氢和氢氧基等,过剩自由基的毒害之一是引发或加剧膜质过氧化作用,造成细胞膜系统损伤,严重时会导致植物细胞的死亡。丙二醛(MDA)是一种膜脂过氧化的产物。有研究[16-17]表明,其含量与细胞膜系统的伤害程度有密切关系,植物在逆境胁迫或衰老过程中,随着胁迫强度的加大,MDA含量会逐渐升高。
图5为不同盐度下香蒲叶片组织中丙二醛含量随胁迫时间的变化情况。在低盐条件(0.30%)下,香蒲叶片中丙二醛含量与对照相比没有明显差异。当盐度为0.50%时,丙二醛含量随胁迫时间呈先上升后下降并趋于稳定的趋势,第5天时丙二醛达到2.54 μmol/g(植物湿重情况下),较对照增加了106%,随后急剧下降并趋于稳定,至胁迫第11天,与对照相比差别不大。说明香蒲在该盐度下存在应激反应和适应过程,可以通过自我修复来抵抗盐害。但当盐度增加到1.00%时,香蒲叶片组织中的丙二醛含量在胁迫初始的第2天就急剧上升,为3.25 μmol/g(植物湿重情况下),较对照增加了175%。随着胁迫时间的增加,丙二醛含量有所下降,但下降幅度不大,一直保持在2.15~2.64 μmol/g(植物湿重情况下),比对照增加了59.3%~95.6%。说明在该盐度下,香蒲的细胞膜系统受到伤害。这也解释了为什么在1.00% NaCl胁迫下香蒲生长情况和对水中氮磷的去除效果显著下降。

注:指植物湿重情况下的丙二醛含量。图5 不同盐度下香蒲叶片中丙二醛MDA含量变化
3 结 论
a. 香蒲能耐受一定的盐度,当盐度不大于1.00%时,香蒲可正常生长、繁殖。香蒲的耐盐存活阈值为1.00%。在0、0.50%和1.00%的盐度下,香蒲存活率分别为98%、95%和68%。

c. 香蒲叶片组织中叶绿体对NaCl胁迫反应最敏感,盐胁迫下香蒲叶片组织中叶绿素含量均较对照显著下降。当盐度小于0.50%时,香蒲可以通过自我修复来抵抗盐害,植物组织内脯氨酸和丙二醛含量随盐度增加和胁迫时间的延长变化不大。
d. 在较高盐度(1.00%)胁迫下,香蒲会通过积累脯氨酸来调节体内细胞的渗透势。但叶片组织中丙二醛含量显著增加,植物叶片组织的细胞膜系统受到伤害,解释了在1.00%NaCl胁迫下香蒲生长情况和对水中氮磷的去除效果显著下降的原因。
[ 1 ] 濮培民,王国祥,李正魁,等. 健康水生态系统的退化及其修复:理论、技术及应用[J]. 湖泊科学,2001,13(3):193-203.(PU Peimin, WANG Guoxiang, LI Zhengkui, et al. Degradation of healthy aqua-ecosystem and its remediation: theory, technology and application[J]. Journal of Lake Sciences, 2001, 13(3):193-203.(in Chinese))
[ 2 ] 刘春光,王春生,李贺,等. 几种大型水生植物对富营养化水体中氮和磷的去除效果[J]. 农业环境科学学报,2006,25(增刊1):635-638.(LIU Chunguang, WANG Chunsheng, LI HE, et al. Removal efficiency for nitrogen and phosphorus in eutrophic waterbody by Macrophytes[J]. Journal of Agro-Environment Science, 2006, 25(sup1): 635-638.(in Chinese))
[ 3 ] HOAGLAND D R, ARNON D I. The water-culture method for growing plants without soil[J]. Calif Agric Expt Sta Circ, 1950, 347: 1-32.
[ 4 ] 赵可夫,范海.盐生植物及其对盐渍生境的适应生理[M].北京:科学出版社,2005.
[ 5 ] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[ 6 ] 武维华.植物生理学[M]. 北京:高等教育出版社,2003.
[ 7 ] HU M H, AO Y S, YANG X E, et al. Treating eutrophic water for nutrient reduction using an aquatic macrophyte(IpomoeaaquaticForsskal) in a deep flow technique system[J]. Agricultural Water Management,2008, 95(5):607-615.
[ 8 ] VACCA G, WAND H, NIKOLAUSZ M, et al. Effect of plants and filter materials on bacteria removal in pilot-scale constructed wetlands[J]. Water Research,2005, 39:1361-1373.
[ 9 ] BRADLEY P M, MORRIS J T. The influence of salinity on the kinetics of NH4+uptake in Spartina Alterniflora[J].Oecologia, 1991, 85: 375-380.
[10] BROWN J J, GLEEN E P, FITZSIMMONS K M, et al. Halophytes for the treatment of saline aquaculture effluent[J]. Aquaculture, 1999, 17(5): 255-268.
[11] KLOMJEK P, NITISORAVUT S, Constructed treatment wetlands: a study of eight plant species under saline conditions[J]. Chemosphere, 2005, 58:585-593.
[12] 汪贵斌,曹福亮. 盐胁迫对落羽杉生理及生长的影响[J]. 南京林业大学学报(自然科学版),2003,27(3):11-14.(WANG Guibin, CAO Fuliang. Effect of salinity on growth and physiology of bald cypress seedlings[J].Journal of Nanjing Forestry University(Natural Sciences Edition), 2003, 27(3): 11-14.(in Chinese))
[13] WANG Z Q, YUAN Y Z, QU J Q, et al. Glutamine synthetase and glutamate dehydrogenase contribute differentially to proline accumulation in leaves of wheat(triticum aestivum) seedlings exposed to different salinity[J]. J. Plant Physiol.,2007, 164: 695-701.
[14] PAGETER M, BRAGATO C, MALAGOLI H, et al. Osmotic and ionic effects of NaCl and Na2SO4salinity on Phragmites australis[J]. Aquat Bot, 2009, 90: 43-51.[15] 肖强,郑海雷,陈瑶,等. 盐度对互花米草生长及脯氨酸、可溶性糖和蛋白质含量的影响[J]. 生态学杂志,2005,24(4):373-376.(XIAO Qiang, ZHENG Hailei, CHEN Yao, et al. Efeects of salinity on the growth and proline, soluble sugar and protein contents of Spartina alterniflora[J]. Chinese Journal of Ecology,2005, 24 (4):373-376.(in Chinese))
[16] MELONI D A, OLIVA M A, MARTINEZ C A, et al. Photosynthesis and activity of superoxide dismutase,peroxidase and glutathione reductase in cotton under salt stress[J]. Environ Exp Bot, 2003, 49: 69-76.
[17] ABRAHAM G, DHAR D W. Induction of salt tolerance in azolla microphylla kaulf through modulation of antioxidant enzymes and ion transport[J]. Protoplasma, 2010, 245: 105-111.
Effects of salinity on removal of nitrogen and phosphorus from eutrophic water usingTyphaangustifoliaL.
YANG Jie, LIU Bo, LIU Xiaochuan, ZHANG Kai
(TianjinHydraulicResearchInstitute,Tianjin300061,China)

eutrophication; salinity; nitrogen; phosphorus; physiological indices;TyphaangustifoliaL.

10.3880/j.issn.1004-6933.2016.05.012
国家“十二五”水专项(2012ZX07203-002);天津市水务局科技项目(KY2015-03)
杨洁(1979—),女,高级工程师,博士,主要从事水环境治理及生态修复研究。E-mail:yj@tjhri.com
X171
A
1004-6933(2016)05-0058-05
2015-11-30编辑:彭桃英)
