波纹巴非蛤5个地理群体的遗传多样性分析
2016-10-18徐小伟张鹏飞虞晋晋黄妙琴柯才焕
骆 轩,徐小伟,张鹏飞,虞晋晋,黄妙琴,柯才焕
(厦门大学 海洋与地球学院,福建省海洋生物资源开发利用协同创新中心,福建厦门361102)

波纹巴非蛤5个地理群体的遗传多样性分析
骆轩,徐小伟,张鹏飞,虞晋晋,黄妙琴,柯才焕*
(厦门大学 海洋与地球学院,福建省海洋生物资源开发利用协同创新中心,福建厦门361102)
采用形态特征和微卫星分子标记对采自菲律宾(PH)、泰国(TH)、福建云霄(YX)、海南儋州(HN)和广西北海(BH)的5个地理群体的波纹巴非蛤(Paphiaundulata)进行遗传多样性分析.形态差异分析结果显示,国外群体和国内群体形态差异明显:2个国外群体(PH和TH)形态接近,聚为一支;国内支系中,YX和HN群体的形态较近,先聚为一支,而BH群体的外部形态与前两者差异较大.Hardy-Weinberg 平衡检验检测到所有群体在5个位点上均出现不同程度地偏离平衡.5个群体间遗传分化指数(FST,0.000 5~0.183 1)、基因流值(Nm,2.230 46~1 066.23)以及分子方差分析(AMOVA,群体间的变异贡献率为10.21%,p<0.000 1)结果表明,群体间存在中等程度的分化.基于遗传距离的非加权组平均法(UPGMA)聚类分析显示:2个国外群体和3个国内群体分别聚为一支,再聚为一个整体;国内支系中,YX和BH群体先聚为一体,再与HN群体聚类.研究结果揭示了波纹巴非蛤较高的遗传多样性水平和中等程度的遗传分化水平,同时也暗示其现有的遗传分化程度受到人类生产活动的干扰.
波纹巴非蛤;遗传多样性;形态特征;微卫星;地理群体
遗传多样性是生物多样性的主要形式之一,多指种内遗传多样性[1],是生命进化和物种分化的基础,更是评价自然生物资源的重要依据[2].遗传多样性的高低决定了一个物种抵御恶劣环境的能力和自身进化的潜力.
波纹巴非蛤(Paphiaundulata)隶属帘蛤科(Veneridae)[3],是我国东南沿海一种重要的经济贝类,在我国自然分布于浙江南部、福建、广东、海南和广西沿岸海域,俗称“油蛤”、“花蚶”和“花甲螺”[4].由于营养价值高且经济效益好,波纹巴非蛤现已成为一个优良的海水养殖品种.然而,近年来随着需求的增加和出口量的增大,波纹巴非蛤所面临的采捕压力也逐年增大,其海区自然资源受到了严重破坏.目前,国内外对波纹巴非蛤的研究还主要集中于生物学和生态学特性[4-7]、增养殖技术[8-9]、食品应用[10]以及微卫星标记开发[11]等方面,有关其遗传多样性的研究鲜有报道.
通过对我国东南沿海各个波纹巴非蛤产区的资源调查发现,市售波纹巴非蛤来源混杂,其中广西北海(BH)、海南儋州(HN)及福建云霄(YX)几处的波纹巴非蛤几乎占据了整个波纹巴非蛤的市场,并且相互间存在着交换和苗种贸易,可见人类水产活动对其自然状态的干扰强度日渐增大.这种非自然的交流对种质保持是不利的,长此以往将影响我国东南沿海波纹巴非蛤的遗传多样性水平.因此,充分认识波纹巴非蛤群体的遗传多样性现状对其种质资源的合理开发、利用和保护具有重要意义.
贝类的形态学差异建立在一定的遗传基础之上,因而不同地理种群的表型差异也能在一定程度上体现其遗传多样性.虽然已有关于波纹巴非蛤形态差异分析的报道[12],但结合分子标记分析能更充分反映群体内和群体间的遗传变异水平.微卫星DNA标记具有多态性高、重复性好、共显性等优势,已广泛应用于长牡蛎(Crassostreagigas)[13]、虾夷扇贝(Patinopectenyessoensis)[14]、中国蛤蜊(Mactrachinensis)[15]、栉江珧(Atrinapectinata)[16]、香港巨牡蛎(Crassostreahongkongensis)[17]和魁蚶(Scapharcabroughtonii)[18]等海洋双壳贝类的遗传多样性研究.本研究基于形态特征与微卫星标记,分析了波纹巴非蛤的遗传多样性,以期为其种质资源的利用和保护提供基础数据和科学依据.
1 材料与方法
1.1样品采集与处理
实验样品于2011 年12月至 2013年12月分别采自泰国(TH)、菲律宾(PH)、YX、HN和BH自然海区,各采样点地理位置如图1所示.每个群体包含的个体数不少于30,活体样本经冰块保鲜运回实验室后,随机选取外壳完好的个体,取其斧足及闭壳肌肌肉样保存于95%(体积分数)乙醇中以备DNA的提取,壳样经洗净擦干后以备测量.
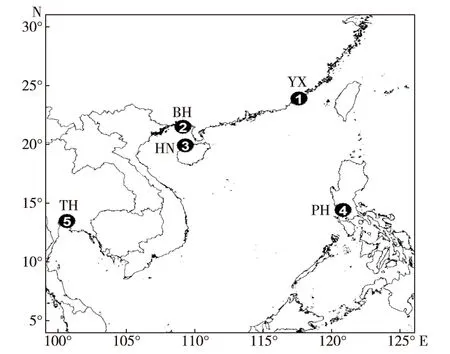
图1 采样点的地理位置Fig.1Locations of the sampling stations
1.2表观形态参数的测量
采用游标卡尺作为测量工具(精确到0.01 mm),获得壳长(LS,前端到后端的距离)、壳高(HS,壳顶到腹缘的距离)、壳宽(WS,左右两壳面间最大的距离)、韧带长(LH,铰合部背面褐色几丁质韧带的长度)、前端-腹缘距(AF,前端到腹缘的距离)、后端-腹缘距(AP,后端到腹缘的距离)6个数量性状,各测量部位见图2.参考刘建勇等[12]用电子天平(精确到0.01 g)称得壳质量(mS,去除软体部分并吸干表面水分后的壳质量).

图2 波纹巴非蛤形态学测量Fig.2Morphological measurements of P. undulata
1.3基因组DNA的提取
采用北京天根生化科技有限公司的海洋动物组织基因组DNA提取试剂盒提取波纹巴非蛤的基因组DNA,用1%(质量分数)的琼脂糖凝胶电泳检测其纯度,用微量紫外分光光度计(ND 2000)检测其浓度,随后将其稀释到适合PCR的最佳浓度,置于4 ℃冰箱中保存备用.
1.4微卫星引物的合成
本研究采用8对能够同时在5个波纹巴非蛤群体中进行有效扩增、结果稳定且重复性高的微卫星引物(表1),并由上海生工生物工程股份有限公司合成.
1.5PCR扩增及产物检测
每个群体随机选取32个个体用于PCR反应.PCR体系为20 μL,内含10×PCR Buffer(含Mg2+) 2 μL,Taq酶(5 U/μL) 0.16 μL,正、反向引物(10 mmol/L)各0.8 μL,dNTPs(10 mmol/L) 1.6 μL,用ddH2O补足至20 μL.PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸7 min;10 ℃保存.将PCR产物送至上海生工生物工程股份有限公司,使用ABI公司的3730测序仪进行毛细管电泳测序分析.
1.6数据分析
1.6.1形态数据分析
表1 8对微卫星引物的特征
Tab.1 Characterization of 8 microsatellite primer pairs
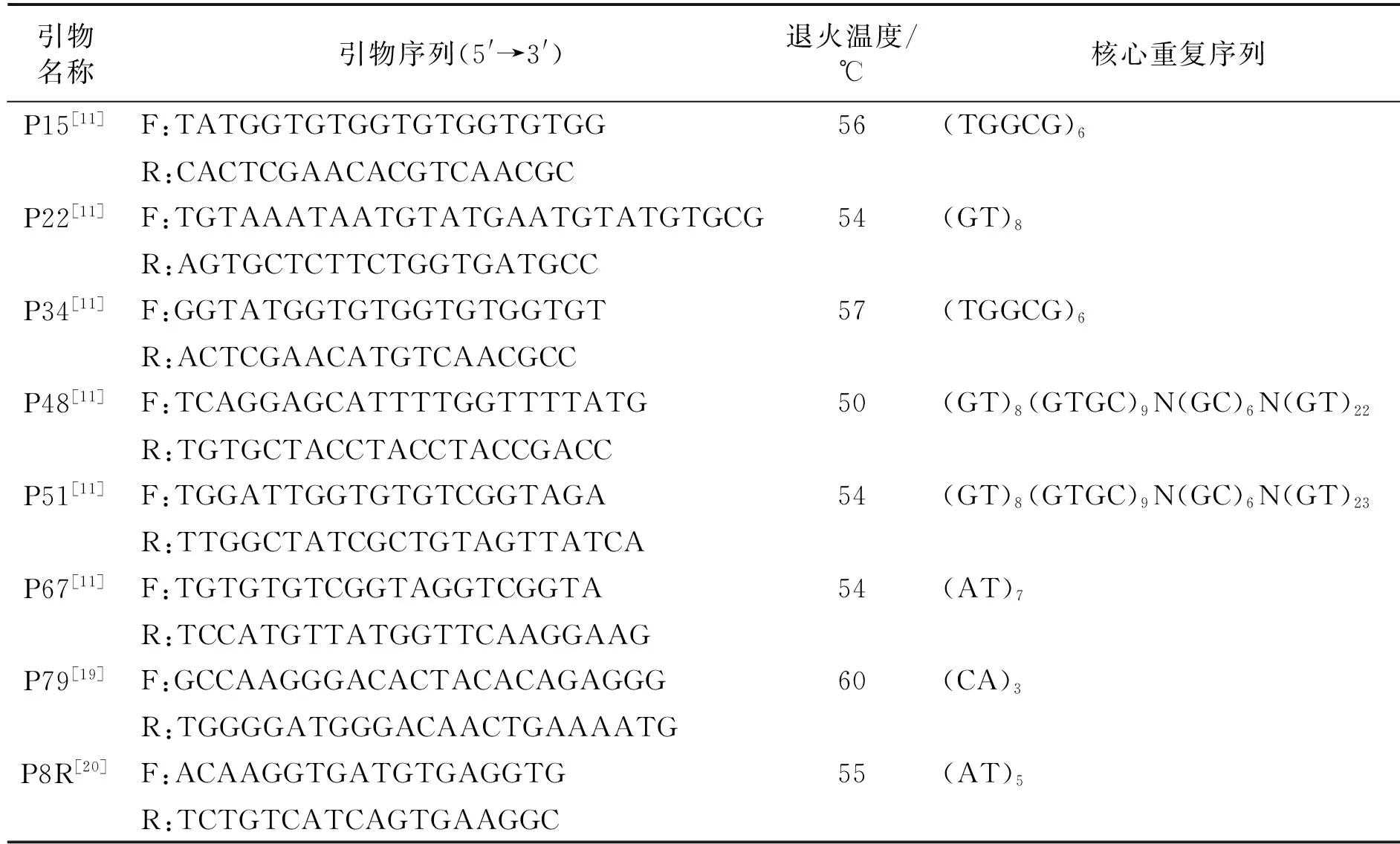
引物名称引物序列(5'→3')退火温度/℃核心重复序列目的片段长度/bpP15[11]F:TATGGTGTGGTGTGGTGTGG56(TGGCG)694~146R:CACTCGAACACGTCAACGCP22[11]F:TGTAAATAATGTATGAATGTATGTGCG54(GT)8264~356R:AGTGCTCTTCTGGTGATGCCP34[11]F:GGTATGGTGTGGTGTGGTGT57(TGGCG)690~144R:ACTCGAACATGTCAACGCCP48[11]F:TCAGGAGCATTTTGGTTTTATG50(GT)8(GTGC)9N(GC)6N(GT)22202~294R:TGTGCTACCTACCTACCGACCP51[11]F:TGGATTGGTGTGTCGGTAGA54(GT)8(GTGC)9N(GC)6N(GT)23180~276R:TTGGCTATCGCTGTAGTTATCAP67[11]F:TGTGTGTCGGTAGGTCGGTA54(AT)7262~288R:TCCATGTTATGGTTCAAGGAAGP79[19]F:GCCAAGGGACACTACACAGAGGG60(CA)3180~219R:TGGGGATGGGACAACTGAAAATGP8R[20]F:ACAAGGTGATGTGAGGTG55(AT)5139~168R:TCTGTCATCAGTGAAGGC
为消除不同群体波纹巴非蛤规格大小对形态特征造成的影响,选用比例性状作为形态特征校正值来衡量各群体间的差异,共选用5个比例性状(分别为HS/LS,WS/LS、LH/LS、mS、LS和AF/AP),采用SPSS 20.0软件进行分析.利用聚类分析、主成分分析和判别分析等多种多元统计分析方法对5个波纹巴非蛤群体的形态差异进行研究.
1.6.2微卫星数据分析
利用POPGENE32[21]计算各位点的Shannon′s多态信息指数(PIC)、等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、固定指数(Fis)、Hardy-Weinberg遗传偏离指数(HWD)、群体间的遗传分化系数(FST)、群体间的遗传距离(GD)和遗传相似性系数(GI).采用MEGA 6.0[22]软件根据已获得的GD,对5个群体进行聚类分析构建亲缘关系图.
利用Arlequin 3.5软件[23]对5个群体间和群体内的遗传变异进行分子方差分析(analysis of molecular variance,AMOVA),探讨群体间的遗传结构.
2 结果与分析
2.1形态特征分析
2.1.1表观形态参数测量
5个波纹巴非蛤群体的表观形态特征参数测量结果如表2所示.
2.1.2聚类分析
聚类分析(图3)表明:国内3个群体和国外2个群体差异明显,各自聚成一支;其中,YX群体与HN群体距离最短,TH群体与PH群体次之,说明两组形态都比较接近;而BH群体与YX、HN群体趋异程度较大.
2.1.3主成分分析
对所有样本的5个比例性状进行主成分分析后,得到2个主成分PC1和PC2,贡献率分别为38.114%和29.221%,累计贡献率为67.335%,即2个主成分可以解释不同群体之间形态差异的67.335%(表3).在PC1中,HS/LS的影响最大,贡献率为 87.0%;WS/LS次之,贡献率为76.6%.PC2中mS/LS影响最大,贡献率为79.4%.
PC1和PC2的散布图见图4.由图可见5个群体大体分成2簇:左上方主要为2个国外群体的重叠区,几乎难以区分;右下方则为3个国内群体的重叠区,其中YX与HN重叠区明显,而BH群体与前两者趋异程度更大.该分布规律与聚类分析结果一致.
表2 波纹巴非蛤5个地理群体样本数及形态测量指标
Tab.2 The sample size and morphological indices of five P. undulata populations
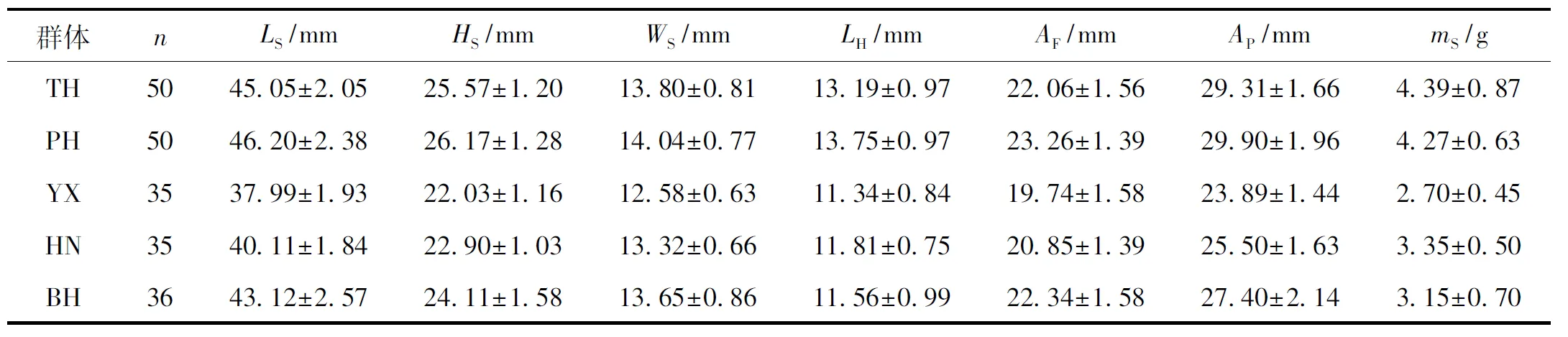
群体nLS/mmHS/mmWS/mmLH/mmAF/mmAP/mmmS/gTH5045.05±2.0525.57±1.2013.80±0.8113.19±0.9722.06±1.5629.31±1.664.39±0.87PH5046.20±2.3826.17±1.2814.04±0.7713.75±0.9723.26±1.3929.90±1.964.27±0.63YX3537.99±1.9322.03±1.1612.58±0.6311.34±0.8419.74±1.5823.89±1.442.70±0.45HN3540.11±1.8422.90±1.0313.32±0.6611.81±0.7520.85±1.3925.50±1.633.35±0.50BH3643.12±2.5724.11±1.5813.65±0.8611.56±0.9922.34±1.5827.40±2.143.15±0.70
2.1.4判别分析
通过逐步判别分析,筛选出4个比例性状的特征值建立5个波纹巴非蛤群体的判别函数.
X1、X2、X3、X4分别代表HS/LS、WS/LS、LH/LS、mS/LS4个比例性状的特征值.
5个群体的费歇尔判别公式如下:

图3 波纹巴非蛤5个地理群体聚类分析图Fig.3Diagram of cluster analysis of five P. undulata populations
YPH=3 289.824X1+123.88X2+448.522X3-
652.233X4-988.107,
YTH=3 288.987X1+110.671X2+482.855X3-
692.221X4-989.962,
YYX=3 267.434X1+456.939X2+465.905X3-
968.773X4-1 060.37,
YHN=3 176.063X1+485.317X2+442.205X3-
858.268X4-1 018.68,
YBH=3 186.31X1+409.991X2+346.032X3-
868.656X4-972.148.

表3 波纹巴非蛤形态特征的主成分的负荷值和贡献率

图4 波纹巴非蛤5个地理种群的第一、二主成分的散布图Fig.4Scatter diagram for PC1 and PC2 of five P. undulata populations
判别分析结果如表4所示:判别准确率P1为54.0%~80.0%,判别准确率P2为18.0%~52.0%,5个群体的综合判别准确率为65.0%.

表4 波纹巴非蛤5个群体的判别分析结果
2.2微卫星数据分析
2.2.1群体内的遗传多样性
本研究采用8个微卫星分子标记对5个波纹巴非蛤群体共160个个体进行遗传多样性分析.由表5可知:5个群体的遗传差异较小,平均Na为7.500~12.252,平均Ne为3.169~3.588,平均Ho为 0.963~0.986,平均He为0.670~0.706,平均PIC为1.391~1.648.综合各遗传多样性指数看,5个群体中TH群体的遗传多样性最高(平均He为 0.706,平均PIC为1.648),HN群体的遗传多样性最低(平均He为 0.679,平均PIC为1.391).
Hardy-Weinberg平衡检测得到的HWD表明,所有群体除了在P67、P79、P8R 3个位点上表现为平衡状态外,在其他5个位点均表现为偏离平衡,表明5个波纹巴非蛤地理群体均不同程度地偏离平衡状态.

表5 8个微卫星位点在5个波纹巴非蛤群体上的遗传多样性及Hardy-Weinberg平衡检验
2.2.2群体间的遗传分化及基因流(Nm)分析
AMOVA分析结果(表6)表明,10.21%的遗传差异来源于群体间,且达到极显著水平(p<0.000 1),17.77%来自于群体内,个体间的遗传变异占总遗传变异的72.02%.5个群体间两两分化的FST和Nm见表7.FST介于0.000 5~0.183 1之间,除YX与BH群体外,其余两两群体间的遗传分化均达到极显著水平(p<0.000 1).3个国内群体(YX、HN和BH)和2个国外群体(PH和TH)两两比较的FST比国内群体间两两比较的FST更大,表明国内和国外的波纹巴非蛤群体遗传分化显著.YX与BH群体的FST最小,且差异不显著.5个群体间两两的Nm均为正值,YX与BH群体间的估测值高达1 066.23,其次为HN与BH群体,Nm为9.955 93,表明5个群体间均存在较频繁的基因交流,分化水平有限(FST最大仅为0.183 1).
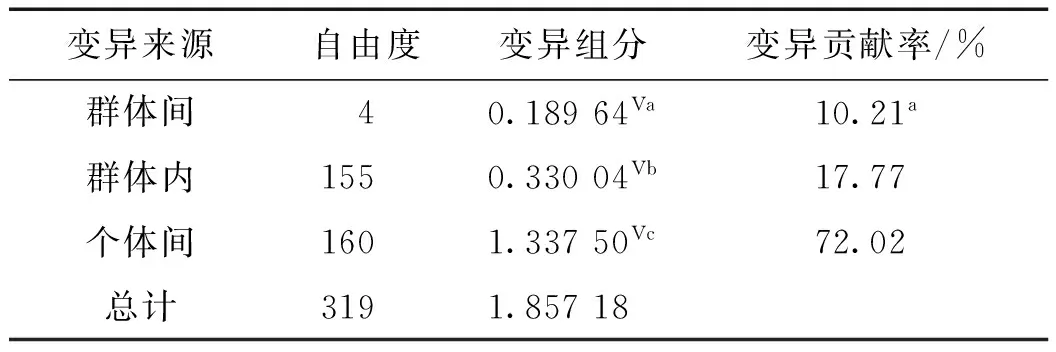
表6 波纹巴非蛤5个地理群体的AMOVA
注:Va,Vb,Vc表示差异显著;a表示p< 0.000 1.
2.2.3遗传距离与聚类分析
按照1978年Nei[24]提出的方法计算出5个群体之间的GD和GI,结果(表7)表明:YX群体和BH群体的GD最近(0.008 0),遗传一致性最高(GI为0.992 0);PH群体和HN群体的GD最远(0.115 3),遗传一致性最低(GI为0.891 1).

表7 波纹巴非蛤5个地理群体间的遗传分化系数、基因流、遗传相似性指数和遗传距离
注:**表示p< 0.000 1.
根据各群体之间的GD构建UPGMA 树,聚类分析结果(图5)表明:国外的PH与TH群体GD较近聚成一支;国内的BH与YX群体GD较近,首先聚成一支,再与HN群体聚为一类.
3 讨 论
3.15个地理群体的形态差异
本研究中,波纹巴非蛤5个地理群体形态特征的主成分分析与聚类分析结果基本一致,5个群体大致分成两簇,簇内群体间的主成分分别存在不同程度的重叠区域.国外2个群体(PH与TH)重叠率较高,形态难以区分,国内3个群体中YX与HN的重叠明显,而BH群体与二者趋异较大,该结果与刘建勇等[12]对波纹巴非蛤的群体分析结果一致,说明几个地理群体之间在形态上既相似又存在明显的差异.然而,本研究构建的2个主成分的累计贡献率仅为67.335%,不符合累计贡献率大于或等于85%的要求,说明用几个相互独立的因子来概括波纹巴非蛤不同群体间的形态差异并不适宜.
本研究的判别分析中,HS/LS、WS/LS、LH/LS和mS/LS4个比例性状进入判别式,具有较大的判别贡献.对5个群体的判别准确率P1为54.0%~80.0%,判别准确率P2为18.0%~52.0%,其综合判别率为65.0%,低于翡翠贻贝(Pernavirdis(Linnaeus))[25]、毛蚶(Scapharcasubcrenata(Lischke))[26]、真曲巴非蛤(Paphiaeuglypta)[27]和缢蛏(Sinonovaculaconstricta)[28].但判别准确率也受判别种群跨度和差异复杂程度影响,低判别准确率可能与种内判别有关.判别结果与实际结果基本相符,说明所构建的判别函数是基本可靠的.
3.25个地理群体的遗传多样性
本研究所选用的8个微卫星位点的PIC为0.831~2.229,平均值为1.391~1.648,根据Botstein等[29]提出的标准,属于高多态性(PIC>0.5),表明所用标记可提供丰富的遗传信息,适用于波纹巴非蛤遗传多样性的分析;He和Na能体现出群体的遗传变异程度,He越高则遗传变异越大,遗传信息含量丰富.波纹巴非蛤5个地理群体的平均He为0.670~0.706,平均Na为7.500~12.252,高于魁蚶[30]和缢蛏[31]群体,与皱纹盘鲍(Haliotisdiscushannai)[32]和合浦珠母贝(Pinctadamartensii)[33-34]相似,表明其遗传多样性仍处于较高水平.
3.3形态聚类与微卫星数据聚类的比较
一般认为,在聚类分析中,聚类的先后顺序反映了物种或种群间亲缘关系的远近.本研究中,形态聚类和微卫星数据聚类的结果具有一定的相似性,均分为2个独立的分支,分别对应国外群体和国内群体,这说明形态学表型的差异是建立在一定的遗传基础之上的.然而,二者也有细微差别:在国内群体分支中,形态聚类的结果是YX群体先与HN群体聚为一支,然后再与BH群体聚为一支;而微卫星数据聚类的结果则是YX群体先与BH群体聚为一支,再与HN群体聚为一支.波纹巴非蛤为浅海底栖贝类,其生活史要经历幼虫浮游期,BH和HN同处北部湾内,BH群体与HN群体间基因交流的可能性较大.因此,不论是形态聚类还是微卫星数据聚类,理论上,都应该是BH群体与HN群体间先聚为一支,而后再与YX群体聚为一支.然而,形态聚类和微卫星数据聚类的结果均未与理论情况相符合.究其原因,可能是由于波纹巴非蛤在我国广泛分布于福建浅海内湾、广东沿岸、雷州半岛西面、海南浅海和北部湾海域,是一种具有较高市场地位的经济贝类[4],而BH、HN和YX等作为海水贝类养殖发达区,相互之间存在频繁的人为引种、贸易及增养放流等活动[34-35].因此,波纹巴非蛤国内群体的遗传特点极有可能受到了人为活动的影响.
虽然波纹巴非蛤5个地理群体间存在一定程度的遗传分化,但从两两群体间的FST值(0.000 5~0.183 1)以及群体间的Nm(YX与BH群体间的估测值高达1 066.23)可知,波纹巴非蛤各群体间存在着充分的基因交流.而YX和BH群体间的GD最近(0.008 0),GI最高(0.992 0),更是从侧面说明广西和福建两省的水产贸易活动较为频繁,以至于波纹巴非蛤的BH和YX群体的GD相对更近.
从形态聚类和微卫星数据聚类特点出发,本研究推断波纹巴非蛤的遗传多样性特点在一定程度上受到了人为活动的干扰.尽管本研究监测到的波纹巴非蛤遗传多样性仍处于较高水平,但考虑到人类活动对海洋生物遗传多多样性的影响潜力,建议在在今后资源管理和利用中,应加强对波纹巴非蛤的遗传资源的保护,维持原种特性,避免因人为的基因渗透导致遗传多样性的丢失,以保证波纹巴非蛤种质资源的可持续利用.
[1]GRAY J S.Marine biodiversity:patterns,threats and conservation needs[J].Biodiversity & Conservation,1997,6(1):153-175.
[2]崔朝霞,张恒,宋林生,等.中国重要海洋动物遗传多样性的研究进展[J].生物多样性,2011,19(6):815-833.
[3]庄启谦.中国动物志:软体动物门[M].北京:科学出版社,2001:278.
[4]左江鹏,黄旭忠,黄雪芬,等.波纹巴非蛤的生物学及养殖技术[J].水产科技,2008,35(4):16-18.
[5]陈坚,柯爱英,范景水,等.波纹巴非蛤生物学性状及生态习性的初步观察[J].浙江海洋学院学报(自然科学版),2008,26(3):343-346.
[6]LEETHOCHAVALIT S,CHALERMWAT K,UPA-THAME S,et al.Occurrence ofPerkinsussp. in undu-lated surf clamsPaphiaundulatafrom the Gulf of Thailand[J].Diseases of Aquatic Organisms,2004,60(2):165-171.
[7]马庆涛,林清,李春晓,等.不同因素对深澳湾波纹巴非蛤滤水率的影响[J].热带生物学报,2015,6(1):5.
[8]王万东.波纹巴非蛤人工育苗技术的初步研究[J].养殖与饲料,2010(8):14-17.
[9]黄松木,方火顺,吴和平,等.云霄礁美海区波纹巴非蛤生物学特性及增殖研究[J].福建水产,1984(3):14-19.
[10]关志强,李敏,宋小勇,等.冻藏条件对文蛤和波纹巴非蛤组织结构影响的实验研究[J].食品与发酵工业,2007,33(1):147-153.
[11]郭昱嵩,谢子强,邓岳文,等.利用 FIASCO 技术进行波纹巴非蛤微卫星 DNA 标记分离与筛选的研究[J].中国农学通报,2012,28(17):160-164.
[12]刘建勇,吴继兴,孙成波.我国东南沿海5个波纹巴非蛤 (Paphiaundulata)地理群体的形态差异分析[J].海洋与湖沼,2010,41(1):114-120.
[13]LI Q,YU H,YU R.Genetic variability assessed by mi-crosatellites in cultured populations of the Pacific oyster (Crassostreagigas) in China[J].Aquaculture,2006,259(1):95-102.
[14]AN H S,LEE Y G,PARK J Y,et al.Genetic characte-rization of four East Asian giant scallop (Mizuhopectenyessoensis) populations using microsatellite markers[J].Aquaculture Research,2009,40(5):619-624.
[15]NI L H,LI Q,KONG L F.Microsatellites reveal fine-scale genetic structure of the Chinese surf clamMactrachinensis(Mollusca,Bivalvia,Mactridae) in Northern China[J].Marine Ecology,2011,32(4):488-497.
[16]AN H S,LEE J W,DONG C M.Population genetic structure of Korean pen shell (Atrinapectinata) in Korea inferred from microsatellite marker analysis[J].Genes & Genomics,2012,34(6):681-688.
[17]LI L,WU X Y,YU Z N.Genetic diversity and substantial population differentiation inCrassostreahongkongensisrevealed by mitochondrial DNA[J].Marine Genomics,2013,11:31-37.
[18]YU H,GAO S,CHEN A L,et al.Genetic diversity and population structure of the ark shellScapharcabrough-toniialong the coast of China based on microsatellites[J].Biochemical Systematics and Ecology,2015,58:235-241.
[19]孙宏,李佳凯,武祥伟,等.基于转录组测序的波纹巴非蛤微卫星标记研究[J].集美大学学报(自然科学版),2015,20(4):260-265.
[20]闫喜武,虞志飞,秦艳杰,等.菲律宾蛤仔EST-SSRs标记开发及不同地理群体遗传多样性[J].生态学报,2011,31(15):4190-4198.
[21]YEH F C,YANG R,BOYLE T J, et al.POPGENE 32,Microsoft Windows-based freeware for population genetic analysis[M].Alberta:Molecular Biology and Biotechnology Centre,University of Alberta,2000:153-156.
[22]TAMURA K,STECHER G,PETERSON D,et al.MEGA6:molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[23]EXCOFFIER L,LISCHER H E L.Arlequin suite ver 3.5:a new series of programs to perform population genetics analyses under Linux and Windows[J].Molecular Ecology Resources,2010,10(3):564-567.
[24]NEI M.Estimation of average heterozygosity and genetic distance from a small number of individuals[J].Genetics,1978,89(3):583-590.
[25]王庆恒,师尚丽,杜晓东,等.翡翠贻贝三个野生种群形态性状的差异分析[J].广东海洋大学学报,2009,29(6):7-11.
[26]宋菲菲.山东近岸毛蚶群体的形态学和遗传学研究[D].青岛:中国海洋大学,2013:44-58.
[27]刘建勇,孙成波,李文,等.我国南海4个真曲巴非蛤自然种群的形态差异分析[J].热带生物学报,2010,1(1):72-77.
[28]刘达博,牛东红,姜志勇,等.缢蛏7群体的形态差异与判别分析[J].海洋渔业,2009,31(4):363-368.
[29]BOTSTEIN D,WHITE R L,SKOLNICK M,et al.Construction of a genetic-linkage map in man using restriction fragment length polymorphisms[J].American Journal of Human Genetics,1980,32(3):314-331.
[30]田吉腾,刘志鸿,杨爱国,等.魁蚶4个地理群体遗传多样性微卫星分析[J].渔业科学进展,2013,34(6):59-67.
[31]刘博,邵艳卿,王侃,等.4个缢蛏群体遗传多样性和系统发生关系的微卫星分析[J].海洋科学,2013,37(8):96-102.
[32]李莉,孙振兴,杨树德,等.用微卫星标记分析皱纹盘鲍群体的遗传变异[J].遗传,2006,28(12):1549-1554.
[33]曲妮妮.合浦珠母贝微卫星DNA标记分离与遗传多样性研究[D].武汉:华中农业大学,2008:42-52.
[34]彭敏,陈秀荔,蒋伟明,等.企鹅珍珠贝不同地理群体遗传多样性的fAFLP分析[J].水生生物学报,2012,36(1):102-108.
[35]严加坤,杨爱国,周丽青,等.基于线粒体16S rRNA基因研究5个栉江珧野生群体的遗传多样性[J].海洋科学,2013,37(2):36-42.
Genetic Diversity Analysis of Five Populations of Paphia undulata
LUO Xuan,XU Xiaowei,ZHANG Pengfei,YU Jinjin,HUANG Miaoqin,KE Caihuan*
(Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, College of Ocean & Earth Sciences,Xiamen University,Xiamen 361102,China)
Genetic diversity of five populations ofPaphiaundulatasampled from Philippines (PH),Thailand (TH),Fujian Yunxiao (YX),Hainan Danzhou (HN) and Guangxi Beihai (BH) was studied using the morphological variation analysis and 8 micro-satellite markers.The morphological variations showed significant differences between the Chinese group and the exotic group.Within the Chinese group,the samples from YX and HN populations were rather similar in morphology,whereas BH population differed greatly from the above two populations.Meanwhile,significant departures from Hardy-Weinberg equilibrium were observed in 5 of the 8 microsatellite loci in all the 5 populations.The lines ofFST(0.000 5 to 0.183 1),Nm(2.230 46 to 1 066.23) and AMOVA analysis (10.21% of genetic variation was distributed within groups with the significant value,p<0.000 1) across all populations indicated that there was medium level of divergence among the 5P.undulatapopulations.The UPGMA clustering tree based on genetic distance demonstrated that the populations of PH and TH clustered into one group,and the other three Chinese populations clustered into one other group.Within the Chinese group,the HN population clustered into one group,while the populations of YX and BH clustered together,which indicated that the YX population was more closely related to the BH population.In this study,high levels of genetic diversity within populations and moderate levels of genetic differentiation among populations were presented forP.undulata.Our data also revealed that the genetic pattern ofP.undulatawas likely to be disturbed by human-mediated passive dispersal via aquaculture activities.These results would provide scientific basis for the conservation and reasonable utilization of natural resources ofP.undulata.
Paphiaundulata;genetic diversity;morphological traits;microsatellites;population
10.6043/j.issn.0438-0479.201605101农业生产专题
2016-05-04录用日期:2016-06-23
海洋公益性行业科研专项(201205021-2);国家贝类产业技术体系项目(CARS-48)
chke@xmu.edu.cn
骆轩,徐小伟,张鹏飞,等.波纹巴非蛤5个地理群体的遗传多样性分析[J].厦门大学学报(自然科学版),2016,55(5):637-645.
LUO X,XU X W,ZHANG P F,et al.Genetic diversity analysis of five populations ofPaphiaundulata[J].Journal of Xiamen University(Natural Science),2016,55(5):637-645.(in Chinese)
S 968.3
A
0438-0479(2016)05-0637-09
