非诺呋他林猝灭BSA荧光的机理研究及分析应用
2016-10-15马红燕王艳妮黄莉莉
马红燕*, 王艳妮, 黄莉莉
(延安大学化学与化工学院,陕西延安 716000)
血清白蛋白是血浆中含量最丰富的一种载体蛋白[1],药物进入血浆后首先与血清白蛋白结合,然后再被运送到身体各部位。因此,从不同角度研究蛋白质和药物分子的相互作用对于药物的储存和运输具有重要的意义[2]。目前对牛血清白蛋白(BSA)作为载体蛋白与药物相互作用的研究已有很多报道,如平衡透析法、紫外分光光度法、电化学法、拉曼光谱法、荧光光谱法[3]等。但以生物大分子作为荧光试剂,利用其内源性荧光的变化来进行药物定量分析的报道较少[4]。
非诺呋他林(Phenulphthalein,PP)是一种刺激性泻药,可与碱性肠液相遇形成一种可溶性盐,刺激结肠壁,增加肠的蠕动,促使粪便排出,它的作用温和持久。许多减肥保健药中非法添加非诺呋他林,长期服用会诱发顽固性便秘、流产、甚至肠癌等疾病[5]。因此,建立快速、灵敏检测非诺呋他林的方法显得尤为重要。目前非诺呋他林含量的测定有高效液相色谱法[6]、电化学发光法[7]、紫外分光光度法[8]和拉曼光谱法[9]等。荧光分析法由于其特有的高灵敏度和选择性在药物分析中倍受青睐[10],但由于非诺呋他林本身无荧光,无法利用荧光光谱法对其进行直接测定,用间接荧光法测定的研究也未见有文献报道。
实验发现,在pH=7.4的Tris-HCl缓冲溶液中,非诺呋他林的加入可使BSA的内源性荧光猝灭,荧光猝灭值△F在一定范围内与非诺呋他林的浓度成正比关系,据此提出了以生物大分子BSA为荧光试剂,以荧光猝灭法测定非诺呋他林的新方法。探讨了非诺呋他林对BSA的荧光猝灭机理, 求得了两者的结合常数、结合位点数、结合距离,并通过计算相应的热力学参数确定了作用力类型, 并用同步荧光光谱技术考察了非诺呋他林引起的BSA构象变化。
1 实验部分
1.1 仪器与试剂
F-4500型荧光光度计(日本,日立公司);FLSP920型瞬态稳态荧光光谱仪(英国,爱丁堡公司);8453型紫外-可见分光光度计(美国,安捷伦公司)。
非诺呋他林标准溶液:1.0×10-3mol/L,准确称取0.0159g非诺呋他林标准品(中国药品生物制品检定所),用无水乙醇溶解并定容至50 mL容量瓶中,使用时逐级稀释。牛血清白蛋白标准溶液(BSA,国药集团化学试剂有限公司):1.0×10-5mol/L,冰箱中保存。pH=7.4的Tris-HCl缓冲溶液。所用试剂均为分析纯,实验用水为超纯水。
非诺呋他林片剂分别来自山西亨瑞达制药有限公司(批号:130107)和临汾宝珠制药有限公司(批号:130401)。
1.2 实验方法
在25 mL比色管中,依次加入1.0 mL BSA溶液,4.0 mL的Tris-HCl缓冲溶液,适量的非诺呋他林溶液,用水定容至刻度,摇匀。室温下放置20 min,用1 cm荧光皿,于λex=283 nm处,扫描 300~500 nm的发射光谱,于λem=344 nm处测定其荧光强度F,同时测定试剂空白的荧光强度F0,计算△F=F0-F。荧光激发和发射狭缝宽度均为5.0 nm。
配制3组溶液分别置于20、30、37 ℃恒温水浴中恒温20 min作为待测溶液,固定荧光激发波长为283 nm,扫描 300 ~500 nm的发射光谱,记录数据,做荧光猝灭Stern-Volmer方程曲线和荧光猝灭双对数曲线;以缓冲溶液为参比,测定BSA、非诺呋他林、BSA-非诺呋他林溶液的紫外吸收光谱;固定荧光发射与激发的波长差分别为△λ=15 nm和 △λ=60 nm,扫描同步荧光光谱。
2 结果与讨论
2.1 荧光光谱图
按实验方法进行激发、发射光谱扫描,结果见图1。由图1可知,在pH=7.4的Tris-HCl缓冲溶液中,BSA具有很强的内源性荧光,其激发和发射波长分别为283 nm和344 nm。随着非诺呋他林浓度的增加,BSA的荧光依次猝灭,表明非诺呋他林与BSA间存在相互作用。在一定浓度范围内,体系的△F值随非诺呋他林溶液浓度的增加而增大,并且呈线性关系,因此可用于非诺呋他林含量的测定。
2.2 非诺呋他林的分析条件
2.2.1酸度及缓冲溶液种类的选择研究了不同pH对体系△F值的影响。结果表明:pH=7.4时,体系的△F值最大。同时考察了Tris-HCl、Na2HPO4-NaH2PO4、柠檬酸-Na2HPO4、NaOH-KH2PO4、B-R等缓冲溶液对体系荧光强度的影响。结果表明:选择Tris-HCl缓冲溶液时体系的△F值最大且稳定,适宜用量在3.5~7.0 mL。实验选择加入4.0 mL pH=7.4的Tris-HCl缓冲液来调节体系酸度。
2.2.2BSA用量的选择研究了BSA溶液浓度对体系△F值的影响。结果表明,BSA用量少时灵敏度较高,但线性范围窄,兼顾灵敏度和线性范围两方面考虑,实验选择加入1.0×10-5mol/L的BSA溶液1.0 mL。
2.2.3表面活性剂和β-环糊精的影响研究了十二烷基三甲基溴化铵、吐温80、溴代十六烷基吡啶、十二烷基苯磺酸钠、溴化十六烷基三甲基铵、β-环糊精等对体系△F值的影响。研究结果表明,上述几种表面活性剂和β- CD对体系△F值均无增敏作用。
2.2.4稳定性实验按实验方法配制溶液,每隔10 min测定一次荧光强度。结果表明,放置20 min后体系的△F值达到最大,且荧光强度在24 h内基本稳定。
2.2.5共存物质的干扰在选定的实验条件下,当非诺呋他林浓度为2.0×10-7mol/L时,以相对误差不超过±5%为限,1 000倍的葡萄糖、果糖、蔗糖、淀粉、尿素、Mn2+、Ca2+、Cu2+、Mg2+、K+,500倍的Ni2+、Cd2+,200倍的Pb2+,100倍的Eu3+,10倍的Fe3+不干扰测定。
2.3 非诺呋他林的分析特性
在选定的实验条件下,非诺呋他林溶液在8.0×10-9~2.8×10-7mol/L范围内,荧光强度与浓度呈良好的线性关系,线性回归方程为:△F=1.0×109c(mol/L)+4.6,相关系数为0.9955。对浓度为2.0×10-7mol/L非诺呋他林溶液平行测定5次,其相对标准偏差(RSD)为0.86%。以3S0/S计算方法检出限为5.4×10-9mol/L。
2.4 样品测定
随机抽取同一批号的非诺呋他林片剂10片,准确称取其质量,研磨,称取研细后的粉末适量(相当于0.0500 g非诺呋他林),加入乙醇搅拌溶解后,定容于50 mL容量瓶中,摇匀,静置10 min,干过滤,弃去初滤液,移取一定量续滤液,按照实验方法测定,同时进行加标回收实验,结果见表1。

表1 样品测定及回收率实验(n=5)
2.5 非诺呋他林对BSA作用机理的研究
蛋白质分子中因含有色氨酸、酪氨酸等氨基酸残基而产生较强的荧光。在严格控制pH值和温度的条件下,能使BSA发生荧光猝灭的原因有以下三种可能:动态猝灭、静态猝灭以及非辐射能量转移的影响[3]。
2.5.1温度对猝灭常数的影响通过Stern-Volmer方程[11]得到不同温度下的KSV和Kq值,结果列于表2。由表2可知随温度升高,KSV逐渐降低,表明是静态猝灭过程。同时非诺呋他林对BSA的猝灭过程在不同温度下的Kq值均大于各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数2×1010L/(mol·s),进一步证明该猝灭是静态的。
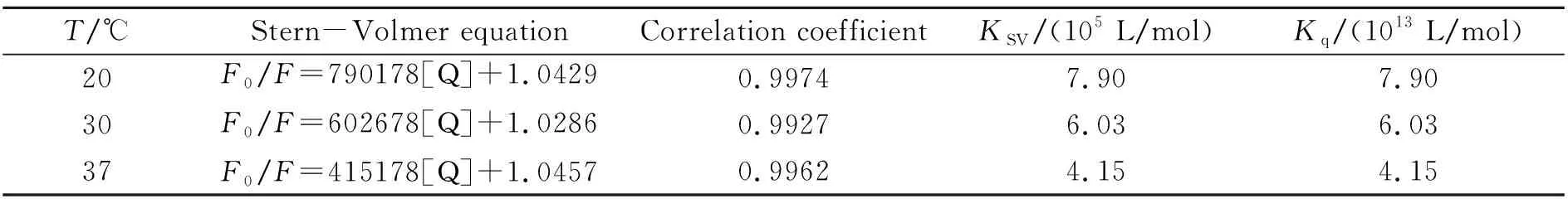
表2 不同温度下非诺呋他林与BSA结合的猝灭常数
2.5.2非诺呋他林与BSA的表观结合常数KA,结合位点数n以及作用力类型的确定因为静态猝灭作用是导致非诺呋他林对BSA 荧光猝灭的主要原因,所以用静态猝灭公式求得不同温度下,所得结合位点数n值均约为1;KA则随温度升高而减小,即BSA-非诺呋他林体系的稳定性随温度升高而降低,也表明非诺呋他林对BSA的荧光猝灭为静态猝灭,结果见表3。
根据热力学函数与作用力类型的关系推断[12],非诺呋他林与BSA之间主要为静电引力。△G<0,该结合反应可自发进行。△H<0,该反应为放热反应,因此降低温度有助于猝灭反应的进行,这与静态常数KA随温度的升高依次降低相吻合。
2.5.3非诺呋他林与BSA之间的结合距离BSA与非诺呋他林物质的量的比为1∶1时,BSA的发射光谱与非诺呋他林的吸收光谱有一定的重叠(图2)。根据Förster的偶极-偶极非辐射能量转移理论[13],计算出作用距离r=1.86 nm。r<7 nm,表明非诺呋他林和BSA之间发生了非辐射能量转移。
2.5.4紫外吸收光谱BSA、非诺呋他林、BSA-非诺呋他林溶液的紫外吸收光谱如图3所示。由图3可知,非诺呋他林的加入使BSA在275 nm处的吸收峰强度降低,说明非诺呋他林与BSA在基态时生成不发光的配合物,从而引起BSA紫外吸收光谱的变化。因此可进一步推断非诺呋他林对BSA的荧光猝灭过程为静态猝灭[14]。
2.5.5荧光寿命的测定于FLSP920瞬态稳态荧光光谱仪上测定BSA和BSA-非诺呋他林的荧光衰减曲线,拟合结果显示BSA与BSA-非诺呋他林体系的荧光寿命τ均为6.39 ns(100%)。BSA和BSA-非诺呋他林体系的荧光寿命比值τ0/τ=1,说明有无猝灭剂非诺呋他林时荧光寿命均未发生改变,故非诺呋他林对BSA的荧光猝灭机理为静态猝灭[15]。
2.5.6非诺呋他林对BSA构象的影响BSA中的酪氨酸、色氨酸残基的最大发射波长与环境有关,因此可依据最大发射波长的变化判断BSA构象是否改变。当△λ=15 nm和△λ=60 nm分别为酪氨酸和色氨酸残基的光谱特征[16]。固定BSA浓度并逐渐增大非诺呋他林的浓度扫描同步荧光图,结果显示,酪氨酸残基和色氨酸残基的特征荧光强度均随非诺呋他林浓度的增大而减小。酪氨酸的最大发射峰未发生变化,而色氨酸的最大发射峰发生了轻微的蓝移,表明在作用过程中非诺呋他林与色氨酸残基更接近、作用力更强,影响了色氨酸所处的微环境,而对酪氨酸的构象影响不大。
3 结论
在pH=7.4的Tris-HCl缓冲溶液中,基于非诺呋他林使BSA内源性荧光显著猝灭的现象,提出了高灵敏度定量测定非诺呋他林含量的荧光分析新方法。借助荧光寿命、温度对猝灭常数的影响以及紫外吸收光谱,研究了非诺呋他林与BSA之间的猝灭作用机理,非诺呋他林对BSA的荧光猝灭属于静态荧光猝灭,且发生了非辐射能量转移。求得了非诺呋他林与BSA的结合常数、结合位点数、结合距离和热力学参数,热力学数据表明二者主要靠静电引力相结合。该研究拓展了生物大分子在药物荧光分析中的应用范围,为临床非诺呋他林的荧光测定提供了新方法。
