过表达根瘤血红蛋白基因对活跃链霉菌那西肽产量的影响
2016-10-14莫秋燕宋元达
莫秋燕,宋元达
(江南大学食品学院食品与健康研究中心,江苏无锡 214122)
过表达根瘤血红蛋白基因对活跃链霉菌那西肽产量的影响
莫秋燕,宋元达*
(江南大学食品学院食品与健康研究中心,江苏无锡 214122)
[目的]采用过表达根瘤血红蛋白基因改善活跃链霉菌的溶氧表达,以提高那西肽的产量。[方法]通过全基因组合成的方法得到根瘤菌血红蛋白基因(sm),连接到整合型质粒pIB139上,构建表达载体pIB139-sm。通过大肠杆菌-链霉菌结合转移的方法将sm基因整合到活跃链霉菌基因组上,通过PCR验证各转化子目的片段已整合到活跃链霉菌基因组上,并进行大量筛选得到重组菌株。[结果]经SDS-PAGE和CO结合差示光谱分析,结果显示,目的蛋白均已成功表达且具有相应的蛋白活性。摇瓶培养结果显示,SmfHb表达对菌体生长和那西肽产量有明显的促进作用,过表达SmfHb的重组菌株那西肽产量达1 245.7 μg/mL,比原始菌株提高39.6%。[结论]过表达sm基因提高那西肽产量的作用优于vhb。
根瘤菌血红蛋白;活跃链霉菌;那西肽
那西肽是一种新型的动物饲料添加剂,对革兰氏阴性菌有较强的抑菌作用[1],能增加动物的抗病能力,促进动物生长[2-3],提高饲料利用率,此外还具有水溶性差、在动物体内无残留的特点[4-6]。那西肽的主要产生菌为活跃链霉菌(Streptomycesactuosus),其在工业发酵过程常因菌丝内的结球造成溶氧不足甚至发生自溶,导致发酵产量的降低[7]。
细菌血红蛋白属于一类特殊的血红蛋白类似蛋白。研究表明,细菌血红蛋白参与改善氧在细菌体内的输送,以支持细胞在低氧环境下进行有氧代谢[8-11]。根瘤菌血红蛋白(SmfHb)是一种新发现的黄素血红蛋白[12]。目前对根瘤菌血红蛋白的研究较少,但研究表明在变铅青链霉菌中表达SmfHb能有效地提高其次生代谢产物放线紫红素的产量[13]。笔者构建表达SmfHb基因的工程菌株,以透明颤菌血红蛋白(VHb)的表达作为对照,用过SmfHb的表达改善活跃链霉菌的溶氧环境,以期提高那西肽的产量,降低工业化生产成本。
1 材料与方法
1.1材料
1.1.1培养基。斜面培养基:葡萄糖 4 g/L,麦芽糖1.3 g/L,酵母4 g/L,KNO31.0 g/L,K2HPO40.5 g/L,MgSO40.5 g/L,NaCl 0.5 g/L,微量元素A 10 mL/L,CaCO30.1 g/L,琼脂 15 g/L,pH 6.8~7.0。种子培养基:葡萄糖40 g/L,玉米淀粉30 g/L,牛肉膏3 g/L,(NH4)2SO43 g/L,MnSO40.5g/L,pH 6.8~7.0。发酵培养基:玉米淀粉80 g/L,葡萄糖5 g/L,酵母提取物5 g/L,CaCO34 g/L,(NH4)2SO41 g/L,MnSO40.5 g/L,KNO30.5 g/L,pH 6.8~7.0。
1.1.2仪器。EL3002型电子天平、EL204型分析天平、pH计购自METTER TOLE DO,PCR仪(T100 Thermal Cycler)、Power pac核酸电泳仪、Geldoc 2000凝胶成像仪购自Bio-Rad;Nano Drop 2000分光光度计、Legend Micro17型离心机、Legend Micro 21R型冷冻离心机、ST40R型冷冻离心机购自Thermo公司;漩涡振荡器、磁力搅拌器购自IKA;真空冷冻干燥机购自LABCONCO;UV-VIS液相色谱仪购自岛津公司。
1.1.3菌株、质粒与引物。活跃链霉菌(Streptomycesactuosus)、E.colitop10、E.coliET12567(pUZ8002)、质粒pIB139。试验所用引物vhb-F:GTCCCATATGATGTTAGACCAGCAAACCAT,vhb-R:GTCCTCTAGATTATTCAACCGCTTGAG CGT;sm-F:GTCCCATATGATGCTCACTCAGAAGACCAAGG,sm-R:GTCCTCTAGATCACTCGGCAAACAGATCGG。
1.2方法
1.2.1重组质粒pIB139-sm的构建。根据NCBI中公布的sm和vhb核苷酸序列,采用全基因合成的方法得到基因sm,将合成的基因连入过度载体pUC57中,并进行测序基因验证。将质粒pIB139以XbaⅠ和NdeⅠ进行双酶切,纯化后,与基因sm片段连接并转入大肠杆菌ET12567(pUZ8002)中,在含有安普霉素的LB平板上筛选阳性转化子得到重组质粒pIB139-sm。
1.2.2结合转移及验证。吸取E.coliET12567(pUZ8002,pIB139-sm/pIB139-vhb)10 μL接种至5 mL LB(试管培养,加入25 ng/mL氯霉素,50 ng/mL卡那霉素,30 ng/mL安普霉素)中,37 ℃摇床过夜培养。第2天按1∶100的比例接种至10 mL LB中,加入25 ng/mL氯霉素、50 ng/mL卡那霉素、30 ng/mL安普霉素,37 ℃培养至OD为0.4左右。收集菌体于4 ℃、5 000 r/min离心4 min,用预冷的10 mL LB洗涤2次,并用1 mL LB重悬,待用。
向产孢子的茄子瓶中加入6 mL灭菌蒸馏水,用接种环将孢子全部刮下,并将孢子悬液全部转移至50 mL灭菌离心管,重复2次。将收集的全部孢子悬液充分振荡,使孢子分散,经过一层纱布过滤,离心,去掉上清,将孢子(108个/mL)重悬于500 μL 2×YT培养基中,50 ℃水浴10 min刺激孢子萌发,室温自然冷却。
将500 μL大肠杆菌悬液和500 μL链霉菌孢子悬液充分混合,每50 μL涂一块MS平板,总共20块,置于28 ℃培养18 h。将1 mL萘啶酮酸(25 μg/mL)和1 mL安普霉素(30 μg/mL)加入18 mL灭菌蒸馏水中,每个平板加入1 mL溶液,重新铺板,使得液体覆盖整个平板,28 ℃继续培养2 d直至转化子出现。
1.2.3转化子的筛选验证。随机挑取选择性平板上长出的单菌落菌丝于新的MS平板传代3次,以验证转化子的稳定性。稳定遗传的转化子菌丝在斜面培养基上28 ℃培养5~7 d后收取孢子,调整孢子浓度为1×108个/mL,-20 ℃保存于20%甘油管中。保菌后将剩余菌体用接种棒收集并离心分离得到,并提取链霉菌基因组,以此为模板,以vhb-F/vhb-R和sm-F/sm-R为引物,PCR验证目的片段是否整合到基因组中。
1.2.4高效液相法检测那西肽产量。色谱条件为色谱柱:Waters symmetry C18column,流速:乙腈-0.025%磷酸溶液(52/48),流速:1.0 mL/min,检测波长:350 nm,柱温:室温,进样量:10 μL。
1.2.5转化子的筛选验证。随机挑取选择性平板上长出的单菌落菌丝于新的MS平板连续传代3次,以验证转化子的稳定性。稳定遗传的转化子菌丝涂布于斜面培养基上,28 ℃培养5~7 d后收取孢子,调整孢子浓度为1×108个/mL,-20 ℃保存于20%甘油管中。用接种棒收集剩余菌体用布氏漏斗真空抽滤分离,并以活跃链霉菌总DNA为模板,分别以sm-F/sm-R和vhb-F/vhb-R为引物,PCR验证目的片段是否整合到基因组中。反应体系及扩增条件基本相同,其中,退火温度为58 ℃,延伸时间为2 min,取PCR产物2 μL进行凝胶电泳检测。
1.2.6CO结合差示光谱。5 000 r/min离心10 min收集活跃链霉菌发酵液的菌丝体(如果菌丝体结团,可将菌丝体用玻璃匀浆器研磨破碎菌体小球),用蒸馏水离心洗涤数次,沉淀悬浮于10 mL pH 7.8磷酸缓冲液,将悬浮液置于冰上,用超声波细胞破碎机超声破碎30次(超声处理10 s,停20 s,冰浴放置2 min,然后重复操作)。取样在显微镜下观察直至丝状菌丝体消失、细胞碎片聚团即可(如果菌丝体破碎效率低,可采取反复冻融结合超声破碎处理)。将超声破碎液体于5 000 r/min离心5 min,去除细胞碎片。取上层裂解液5 mL,分别加入少量连二亚硫酸钠。
通入CO气体10 min,以出发菌菌体破碎后的上层裂解液做参比,用分光光度计在420 nm处测定OD。
1.2.7活跃链霉菌生物量的测定。用10 mL移液管吸取发酵液10 mL,1 000 r/min离心10 min。弃上清,沉淀用10 mL蒸馏水洗涤3遍后冷冻干燥,将得到的干菌体称重,1 L发酵液中干菌体的重量即为菌体生物量。
2 结果与分析
2.1重组活跃链霉菌的PCR验证重组质粒pIB139-sm通过结合转移的方法转化活跃链霉菌,挑取9个单菌落穿斜面,并进行PCR验证。同时,将空质粒pIB139转入活跃链霉菌中作为对照菌株。PCR验证图谱见图1,由图1可知,除泳道第1、5外其余均扩增出大小约为1 000 bp的片段,为S.actuosus/pIB139-sm阳性转化子,说明成功构建重组菌株。且导入空质粒的对照菌株能在安普霉素培养基上生长,说明对照菌株已成功构建。
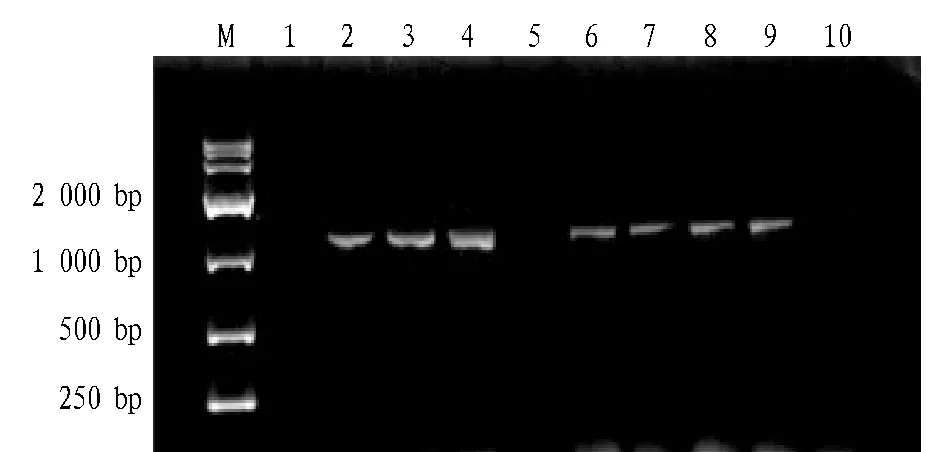
注:M.DNA Marker;1~9:S.actuosus/pIB139-sm转化子;10.对照菌株。Note:M.DNA Marker;1-9.S.actuosus/pIB139-sm transformant;10.Control strains.图1 重组菌株S.actuosus/pIB139-sm的PCR验证Fig.1 Confirmation of strain S.actuosus/pIB139-sm by PCR
2.2转化子的筛选经2轮筛选后,选取整合sm基因的重组链霉菌转化子各10株分别标记为S1~S10。将所选转化子传斜面后进行摇瓶发酵,发酵液HPLC测定结果见表1。由表1可知,大多数重组转化子的发酵效价升高,有约30%的菌株发酵效价与原始菌株的产量下降,各个转化子之间那西肽产量差距较大。其原因:在接合转移的热激活过程、萌发过程以及多次的洗涤过程中对菌体细胞产生较为严重的损伤;质粒上的整合位点是随机的,这可能导致质粒整合使得菌体的生长和次级代谢产物的合成受到影响。过表达vhb基因的链霉菌重组转化子中有6株那西肽产量有所提高,其中,菌株V7增加明显,可达127.4%。过表达根瘤菌血红蛋白基因(sm)的链霉菌重组转化子中有7株产量增加,其中,菌株S5那西肽产量是原菌株的132.1%。各个转化子在连续传代3次后,综合考虑那西肽产量及菌株稳定性,选取转化子V7、S5用于后续研究,并命名为MG-1、MG-2。
2.3重组菌株蛋白表达的SDS-PAGE分析将原始菌株及重组菌株S.actuosus/pIB139-vhb、S.actuosus/pIB139-sm在培养基中培养后,离心收集菌体并用液氮破碎细胞,制备蛋白电泳样品,每个泳道中上样的蛋白含量相同。
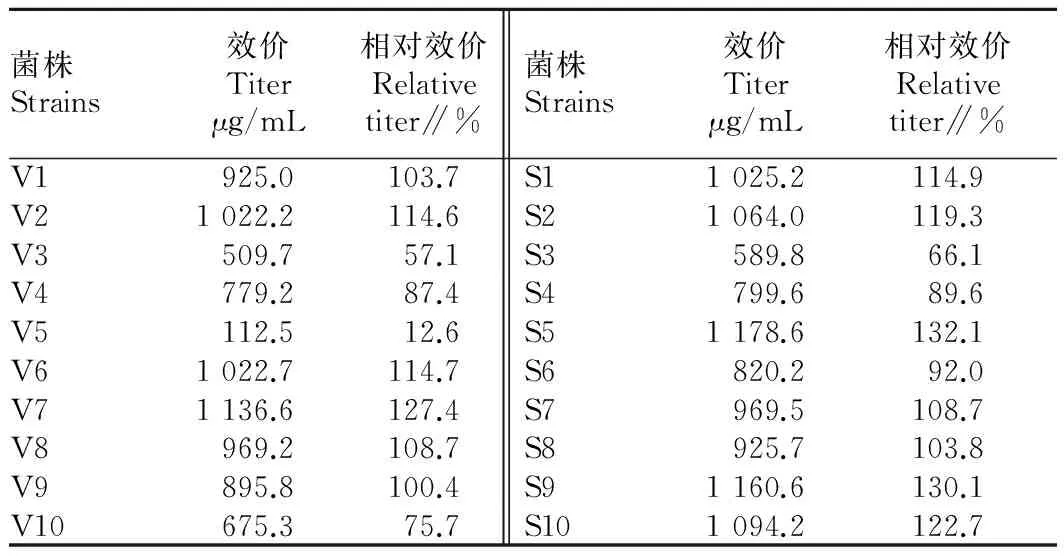
表1 重组菌株转化子筛选
透明颤菌血红蛋白(VHb)和根瘤菌红血蛋白(SmfHb)的理论分子量大小分别为15.724和44.673 ku。由图2可知,目的蛋白均有表达且大小与理论值相符,而对照菌株未发现相应的条带。
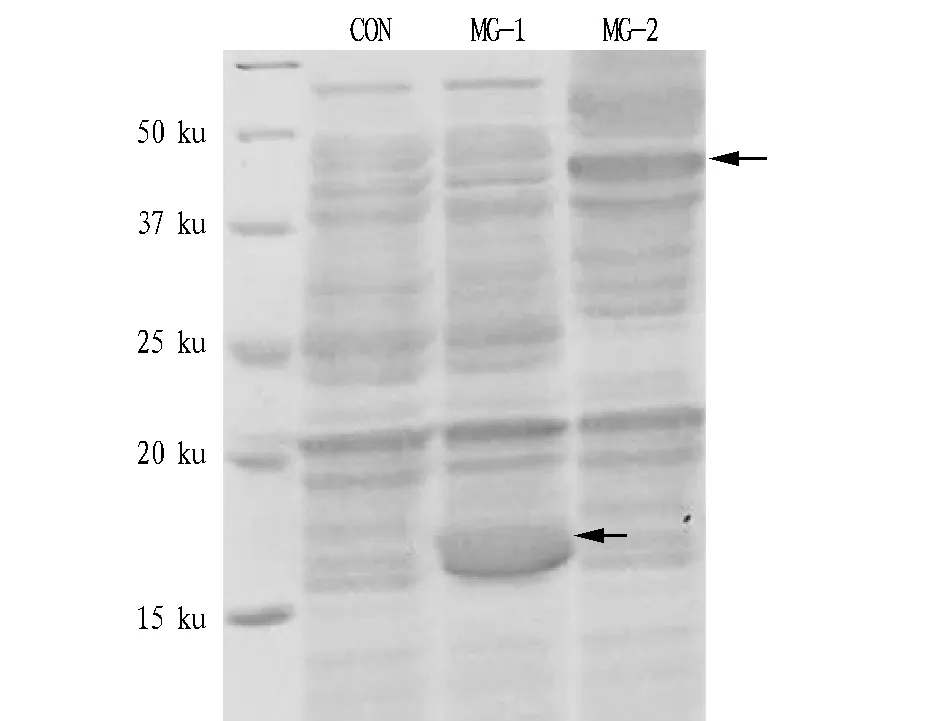
图2 重组活跃链霉菌蛋白质表达Fig.2 Protein expression of reconbinant S.actuosus
2.4重组菌株中细菌血红蛋白活性分析SmfHb和VHb的蛋白活性采用一氧化碳结合差示光谱分析,CO与还原态的血红蛋白结合后,在420 nm处有最大吸收值。将重组活跃链霉菌细胞破碎液的50%通入CO,以未通CO的破碎液为对照,采用紫外分光光度计在400~500 nm波长下进行扫描。结果发现,重组菌株在420 nm处有特征吸收峰,而对照菌株在此处未出现此吸收峰,表明sm和vhb基因已在活跃链霉菌中表达出有生物活性的SmfHb和VHb蛋白(图3)。
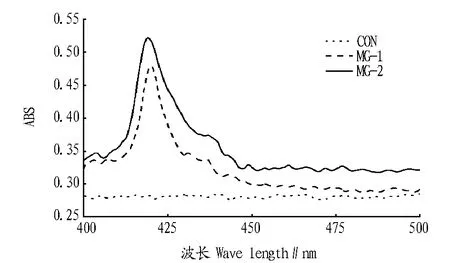
图3 活跃链霉菌细胞提取液的CO结合差示光谱Fig.3 CO binding difference spectrum of cell extracts from S.actuosus
2.5重组链霉菌的生长及那西肽产量的分析重组菌株构建成功后,在250 mL摇瓶中对原始菌株(WT)、对照菌株(CON)和重组菌株MG-1、MG-2于28 ℃、200 r/min培养7 d,结果见图4。由图4可知,SmfHb和VHb均对菌体的生长和那西肽的产量有明显的促进作用,其中,过表达SmfHb的重组菌株MG-2那西肽产量达1 245.7 μg/mL,比原始菌株提高39.6%。虽然过表达VHb的重组菌株MG-1的生物量高于MG-2,但其那西肽产量却略低于MG-2,且菌株MG-2单位质量那西肽的产量达303.8 μg/mg,比原始菌株提高32.8%,而MG-1仅比原始菌株高2%。由此可知,VHb是通过提高活跃链霉菌的生物量来增加那西肽的产量,从而提高单位质量那西肽的产量。
导入空质粒pIB139的对照菌株的那西肽产量与出发菌株无明显差别,说明空质粒pIB139本身并不会对菌株的生长及产量产生影响,故可在后期试验中排除质粒pIB139对那西肽产量的影响。
图4 重组菌株摇瓶培养的生物量(A)、那西肽产量(B)和生物量(C) Fig.4 Biomass(A),nosiheptideyield(B)andnosiheptide/biomass(C)inrecombinantstrainsundershake-flaskculture
3 结论
该试验通过在活跃链霉菌中过表达vhb和sm细菌血红蛋白基因,分别得到vhb、sm过表达菌株MG-1、MG-2以改善其在发酵过程中溶氧不足的问题。过表达sm基因的重组菌株MG-2的那西肽产量达1 245.7 μg/mL,比原始菌株提高39.6%。虽然过表达vhb的重组菌株MG-1的生物量高于MG-2,但MG-1的那西肽产量略低于MG-2,且菌株MG-2单位质量那西肽的产量达303.8 μg/mg,比原始菌株提高32.8%,而MG-1仅比原始菌株高2%,说明过表达sm基因提高那西肽产量的作用优于vhb。
[1] BENAZET F,CARTIER M,FLORENT J,et al.Nosiheptide,a sulfur-containing peptide antibiotic isolated fromstreptomyces actuosus 40037 [J].Experientia,1980,36(4):414-416.
[2] KOBAYASHI I,NAGANO K,KAMAI H.Nosiheptide,as an antibiotic for feed additives-2 effectiveness and safety [J].Mitsubishi Chemical R & D review,1988,2(1):53-64.
[3] 萨仁娜,佟建明.那西肽对肉仔鸡维生素营养和生产性能的影响 [J].饲料工业,1997(4):7-9.
[4] 周佩,李继扬.诺西肽突变生物合成的研究(I)[J].中国抗生素杂志,1995,20(3):159-162.
[5] 李红军.那西肽对肉仔鸡生长性能的影响及其作用机理的探讨[D].杭州:浙江大学,2004.
[6] 戴贤君.那西肽对宝石鲈生长性能及小肠绒毛的影响[J].中国动物保健,2006,6):42-3.
[7] 文莹,李季伦.透明颤菌血红蛋白基因在阿维链霉菌中的表达[J].微生物学报,2000,40(1):50-56.
[8] KALLIO P T,BOLLINGER C J,KOSKENKORVA T,et al.Assessment of biotechnologically relevant characteristics of heterologous hemoglobins inE.coli[J].Methods Enzymol,2008,436:255-272.
[9] ZHANG L,LI Y J,WANG Z N,et al.Recent developments and future prospects of vitreoscilla hemoglobin application in metabolic engineering [J].Biotechnology advances,2007,25:123-136.
[10] WEI X X,CHEN G Q.Applications of the VHb genevgbfor improved microbial fermentation processes [J].Methods in enzymology,2008,436:273-287.
[11] KHOSLA C,CURTIS J E,DEMODENA J,et al.Expression of intracellular hemoglobin improves protein synthesis in oxygen-limited escherichia coli [J].Biotechnology,1990,8(9):849-853.
[12] LIRA-RUAN V,SARATH G,KLUCAS R V,et al.In silico analysis of a flavohemoglobin from sinorhizobium meliloti strain 1021 [J].Microbiol Res,2003,158(3):215-227.
[13] KIM Y J,SA S O,CHANG Y K,et al.Overexpression of shinorhizobium meliloti hemoprotein in streptomyces lividans to enhance secondary metabolite production [J].J Microbiol Biotechnol,2007,17(12):2066-2070.
Effects of Overexpressing Hemoprotein Gene fromSinorhizobiummelilotion Nosiheptide Yield ofStreptomycesactuosus
MO Qiu-yan, SONG Yuan-da*
(Food and Health Research Center, School of Food and Health, Jiangnan University, Wuxi, Jiangsu 214122)
[Objective] To improve the dissolved oxygen expression ofStreptomycesactuosusby overexpressing hemoprotein Gene fromSinorhizobiummeliloti, and to enhance the yield of nosiheptide. [Method]Sinorhizobiummelilotihemoglobin gene (sm) was obtained through the whole gene synthesis method, which were cloned into the plasmid pIB139 to construct expression vectors pIB139-sm. The plasmid containingsmwas introduced intoStreptomycesactuosusthrough conjugal transfer betweenE.coliandStreptomces. The transformants were verified by PCR, and then were purified by several cycles of single-colony screen. [Result] The expression and activity of SmfHb was confirmed by SDS-PAGE and CO-difference spectrum analysis, respectively. Flask culture experiment results showed that the nosiheptide yield in SmfHb-overexpressing strain (1 245.7 μg/mL) was increased by 39.6% (P< 0.05) compared with the control strain (892.5 μg/mL). [Conclusion] Overexpressingsmgene is superior tovhbin enhancing the yield of nosiheptide yield.
Sinorhizobiummeliloti;Streptomycesactuosus; Nosiheptide
莫秋燕(1990- ),女,浙江杭州人,硕士研究生,研究方向:食品生物技术。*通讯作者,教授,博士,博士生导师,从事微生物功能脂质研究。
2016-04-25
S 188
A
0517-6611(2016)24-157-03
