大型溞ChE和NAGase间接竞争和非竞争ELISA方法的比较
2016-10-14郎倩萍李少南郑佳豪张文萍
郎倩萍, 李少南, 郑佳豪, 张文萍
(浙江大学农药与环境独立研究所,浙江杭州 310029)
大型溞ChE和NAGase间接竞争和非竞争ELISA方法的比较
郎倩萍, 李少南*, 郑佳豪, 张文萍
(浙江大学农药与环境独立研究所,浙江杭州 310029)
[目的]探索间接非竞争ELISA和间接竞争ELISA法测定大型溞ChE和NAGase的试验条件及方法灵敏度。[方法]分别采用间接竞争和间接非竞争ELISA方法测定大型溞ChE和NAGase。[结果]对于ChE,间接非竞争ELISA的最适抗原浓度和抗体稀释倍数分别为1.466 μg/mL和1∶10 000,灵敏度为7.426 7 ng/mL;间接竞争ELISA的最适抗原浓度和抗体稀释倍数分别为5.277 μg/mL和1∶8 000,灵敏度为0.163 4 ng/mL。对于NAGase,间接非竞争ELISA的最适抗原浓度和抗体稀释倍数分别为8.961 μg/mL和1∶6 000,灵敏度为4.199 9 ng/mL;间接竞争ELISA的最适抗原浓度和抗体稀释倍数分别为6.450 μg/mL和1∶4 000,灵敏度为0.250 8 ng/mL。[结论]无论是ChE还是NAGase,间接竞争ELISA在最适抗体浓度下的检测灵敏度均高于间接非竞争ELISA,加之其操作简便,间接竞争ELISA在生物和环境样品ChE和NAGase含量检测中值得推广应用。
胆碱酯酶;氨基葡糖糖苷酶;间接竞争ELISA;间接非竞争ELISA;大型溞
在水生生态毒理研究中和环境监测上,人们常利用ChE和NAGase作为农药,特别是有机磷和氨基甲酸酯类杀虫剂水体污染的生物指示物[1-2]。因为水体中NAGase比较容易失去活性,大型溞体内ChE在受到某些刺激下容易高于正常值,所以通过大型溞ChE、NAGase酶活性变化来了解农药对溞类的毒性或作为指示物监测农药对水体污染,其结果存在一定的不准确性。如果建立ChE、NAGase的酶联免疫吸附测定(ELISA)方法来测定农药暴露下的溞体内ChE含量变化和水环境中NAGase含量的变化,就可以使结果更准确。
刘洪翠等[3-4]建立了大型溞ChE、NAGase的间接非竞争ELISA。间接竞争ELISA方法是利用已知抗原包被固相载体,加入待检测样品和限量抗体后,已知抗原与样品中待检抗原竞争性结合限量抗体,不同浓度的待检抗原对已知抗原与抗体结合形成不等的抑制率。在一定范围内,该抑制率与待检样品浓度呈现线性关系,因此,可通过抑制率反映出样品中待检样品的浓度[5]。竞争ELISA法常用于检测食品和药品中农药残留、毒素、各种化学品等有毒有害物质[6]。该方法在病毒、特种蛋白等的检测上取得了很好的成效[7-8]。Wang等[9]建立间接竞争ELISA法用于检测羊乳中是否掺伪牛乳,最低检测限为0.35 ng/mL,相对标准偏差小于12%,适用于检测高温高压处理的乳制品,加之操作简单高效,应用于大规模高通量样品筛查及羊乳样本中牛奶蛋白半定量分析。Xie等[10]制备黄曲霉毒素B1单克隆(AFB_1)抗体,建立间接竞争ELISA检测方法用于受污染样品中的AFB_1,检测限为1.04 mug/L,且特异性高,可用于实际样品中黄曲霉毒素B1的快速筛检。笔者比较了间接非竞争ELISA和间接竞争ELISA法测定大型溞ChE和NAGase的试验条件及方法灵敏度,以期为间接竞争ELISA检测方法在生物和环境样品ChE和NAGase含量检测中的应用提供理论依据。
1 材料与方法
1.1材料
1.1.1抗原和抗体。大型溞ChE:按照杨艳霞的方法[11]分离纯化大型溞体内的ChE,得到电泳纯ChE。大型溞ChE-IgG:由浙江杭州华安生物技术有限公司制备。以纯化的ChE蛋白免疫新西兰大白兔,得到兔抗ChE多克隆抗血清,纯化后得到ChE-IgG,浓度为3.35 mg/mL。大型溞NAGase:按照曾晨杰的方法[4]分离纯化大型溞体内的NAGase,得到电泳纯的NAGase。大型溞NAGase抗体:以纯化的NAGase蛋白免疫新西兰大白兔,得到兔抗NAGase多克隆抗血清,效价为1∶8 000。
1.1.2试剂。稀释液:pH 7.4,0.01 mol/L磷酸盐(PBS)缓冲液。包被液:pH 9.6,0.20 mol/L碳酸盐(CBS)缓冲液。洗涤液:pH 7.4,0.01 mol/L PBST缓冲溶液,即pH 7.4,0.01 mol/L PBS缓冲液加体积分数为0.1%的吐温-20。封闭液:质量分数为2.0%脱脂奶粉。显色剂:EL-TMB显色试剂盒,3,3,5,5-四甲基联苯胺(TMB)无色物质,作为供氢体,在辣根过氧化物酶作用下,可被氧化生成蓝色的产物,主要吸收峰在370和652 nm,加入酸后变黄,在450 nm波长处有最大吸收峰,购自上海生工生物工程有限公司。
1.2方法
1.2.1间接非竞争ELISA试验。
1.2.1.1抗原抗体最适工作浓度的选择。用方阵试验法对间接非竞争ELISA 法抗体抗原最适工作浓度进行选择,其基本操作如下:用CBS将酶稀释成不同蛋白质浓度后包被于固相载体,每一种包被浓度设置不同的抗体稀释倍数,然后按间接非竞争ELISA法的基本步骤进行操作。当OD450值约为1、抗原抗体用量最少、对照孔的OD450值小于0.1时,抗原抗体浓度即为最适工作浓度[12]。
1.2.1.2间接非竞争ELISA 法基本操作步骤。包被不同蛋白浓度的酶在96孔酶标板,每孔100 μL,装入保湿盒内,放入37 ℃培养箱中,静置2 h,PBST洗涤3次;用质量分数为2.0%的脱脂奶粉封闭,每孔200 μL,装入保湿盒内,放入37 ℃培养箱中,静置0.5 h,用PBST洗涤3 次;加入经质量分数为2.0%的脱脂奶粉稀释的最适浓度抗体100 μL,放入37 ℃培养箱中,静置1 h,用PBST洗涤3次;加入经质量分数为20%的脱脂奶粉稀释5 000倍的羊抗兔酶标IgG-HRP液100 μL,放入37 ℃培养箱中1 h,PBST洗涤3次;加入显色剂,每孔100 μL,37 ℃培养箱培养15 min;每孔加入2 mol/L硫酸50 μL终止反应,并用Molecular Devices VERSA max microplate reader测定各孔的OD450值[12]。
1.2.1.3标准曲线绘制。将标准品(纯化酶液)用含1 mmol/L EDTA的50 mmol/L Tris-HCl缓冲液(pH 8.1)稀释成系列质量浓度,按“1.2.1.1”得到的最适抗体稀释倍数稀释抗体,用“1.2.1.2”所示的间接非竞争ELISA方法测定其与系列浓度标准品反应的OD450值,用分析软件CurveExpert 2.2中的Exponential Association(2)拟合标准曲线[3]。
1.2.1.4灵敏度检测。灵敏度是指该法能够检测出待测抗原的最低量,即最小检出量;测定10个0 μg/mL标准液,计算OD450的平均值(X)和标准差(SD),根据公式Z=X+2SD
求出最低检测限,在标准曲线上查出Z所对应的浓度即为标准品最小检出量[13]。
1.2.2间接竞争ELISA试验。
1.2.2.1抗原抗体最适工作浓度的选择。用方阵试验法对间接竞争ELISA 法抗体抗原最适工作浓度进行选择,其基本操作如下:用CBS将酶稀释成不同蛋白质量浓度后包被固相载体,每一种包被浓度设置不同的抗体稀释倍数,然后按间接竞争ELISA法的基本步骤进行操作。当OD450值约为1,抗原抗体用量最少时的抗原抗体浓度即为最适工作浓度[14]。
1.2.2.2间接竞争ELISA 法基本操作步骤。包被最适浓度的抗原在96孔酶标板,每孔100 μL,装入保湿盒内,放入37 ℃养箱中静置2 h,PBST洗涤3次;用质量分数为2.0%的脱脂奶粉封闭,每孔200 μL,装入保湿盒内,放入37 ℃培养箱中,静置0.5 h,用PBST洗涤3次;加入50 μL抗原,再加入经质量分数为2.0%的脱脂奶粉稀释的最适浓度抗体50 μL,放入37 ℃培养箱中,静置1 h,用PBST洗涤3次;加入经质量分数为2.0%的脱脂奶粉稀释5 000倍的羊抗兔酶标IgG-HRP液100 μL,放入37 ℃培养箱中1 h,PBST洗涤3 次;加入显色剂,每孔100 μL,37 ℃培养箱培养15 min;每孔加入2 mol/L硫酸50 μL终止反应,并用Molecular Devices VERSA max microplate reader测定各孔的OD450值。参考Reinhold Kittelberger的方法并稍作改进[14]。
1.2.2.3标准曲线绘制。将标准品(纯化酶液)用含1 mmol/L EDTA的50 mmol/L Tris-HCl缓冲液(pH 8.1)稀释成系列质量浓度,按“1.2.2.1”得到的最适抗原抗体稀释倍数稀释抗体,用“1.2.2.2”所示的间接竞争ELISA方法测定其与系列浓度标准品反应的OD450值,用分析软件CurveExpert 2.2中的线性模型拟合标准曲线[15]。
1.2.2.4灵敏度检测。灵敏度是指该法能够检测出待测抗原的最低量,即最小检出量;测定10个0 μg/mL标准液,计算OD450的平均值(X)和标准差(SD),根据公式Y=[(X-2SD)/X]×100%求出最低检测限,在标准曲线上查出Y所对应的浓度即为标准品最小检出量[15]。
2 结果与分析
2.1胆碱酯酶间接非竞争ELISA
2.1.1最适抗原抗体浓度。由表1可知,当抗体稀释倍数是10 000倍时,随着抗原浓度的增加,OD450 nm值也随之升高,当抗原浓度为1.466 μg/mL时,OD450 nm值约为1.0,以抗原浓度为1.466 μg/mL作为包被原,测定抗体稀释倍数对OD450 nm值的影响,随着抗体稀释倍数的增加,OD450 nm值随之减小,抗体稀释倍数为10 000时OD450 nm值约为1.0,抗体的最适工作浓度为1∶10 000。即当抗体稀释倍数为10 000、抗原浓度为1 466 μg/mL时达到了抗原抗体用量最少,OD450nm值约为1.0。
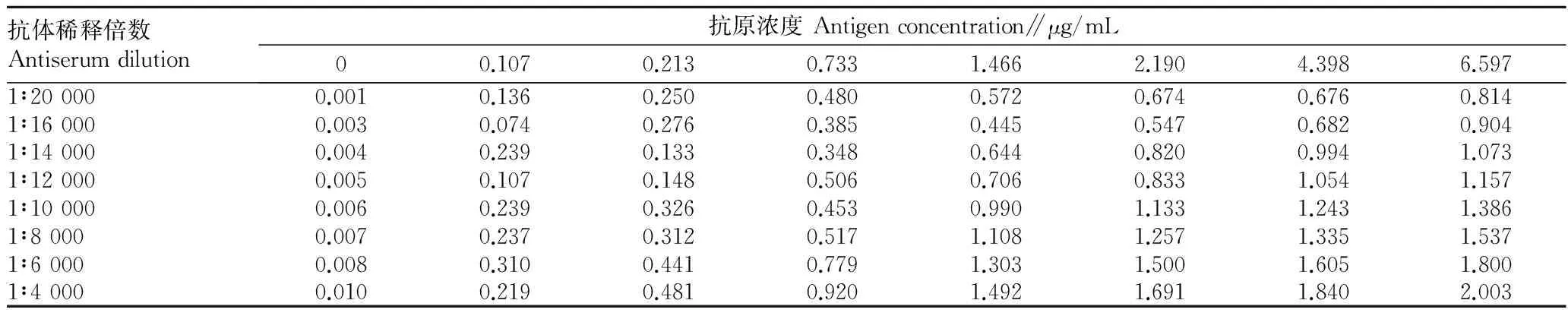
表1 ChE间接非竞争ELISA法最适抗原抗体浓度测定结果(OD450 nm值)
2.1.2标准曲线。将标准品稀释成系列浓度(0~10 μg/mL),抗体1∶10 000稀释,得到的标准曲线如图1所示。曲线方程为:Y=1.439 9×(1-e-0.810 6x),相关系数r=0.985 4,标准误差S=0.271 6。
2.1.3灵敏度。由“2.1.2”标准曲线和公式可得出ChE间接非竞争ELISA的灵敏度为7.426 7 ng/mL (X=0.006 4,2SD=0.002 1)。
2.2胆碱酯酶间接竞争ELISA
2.2.1最适抗原抗体浓度。由表2可知,当抗体稀释倍数是8 000倍时,随着抗原浓度的减小,OD450 nm值也随之降低,当抗原浓度为5.277 μg/mL时,OD450 nm值约为1.0。以抗原浓度为5.277 μg/mL作为包被原,测定抗体稀释倍数对OD450 nm值的影响,随着抗体稀释倍数的增加,OD450 nm值随之减小,抗体稀释倍数为8 000时OD450 nm值约为1.0,抗体的最适工作浓度为1∶8 000。即当抗体稀释倍数为8 000、抗原浓度为5 277 μg/mL时达到了抗原抗体用量最少,OD450 nm值约为1.0。
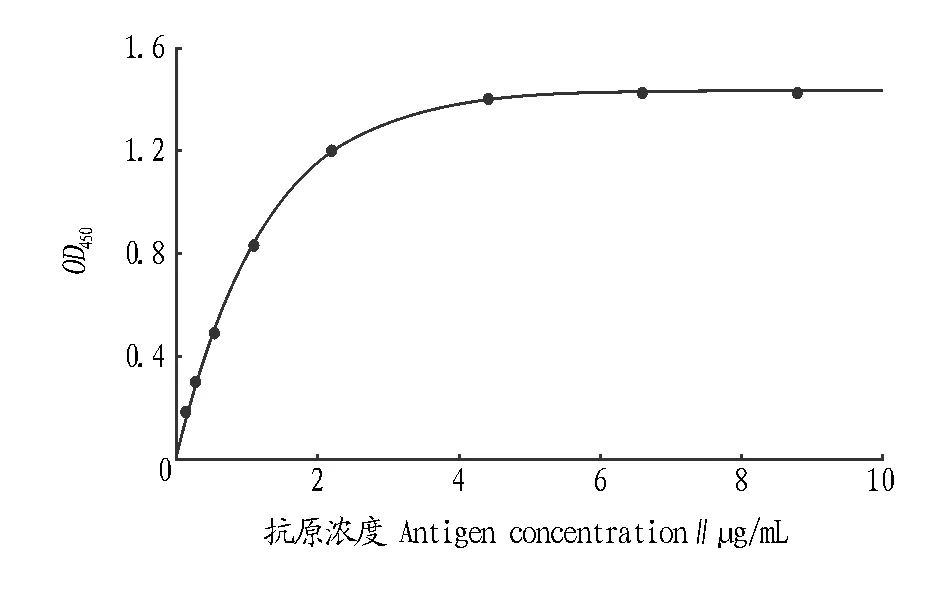
图1 ChE间接非竞争ELISA的标准曲线Fig.1 Standard curve of indirect and non-competitive ELISA for ChE
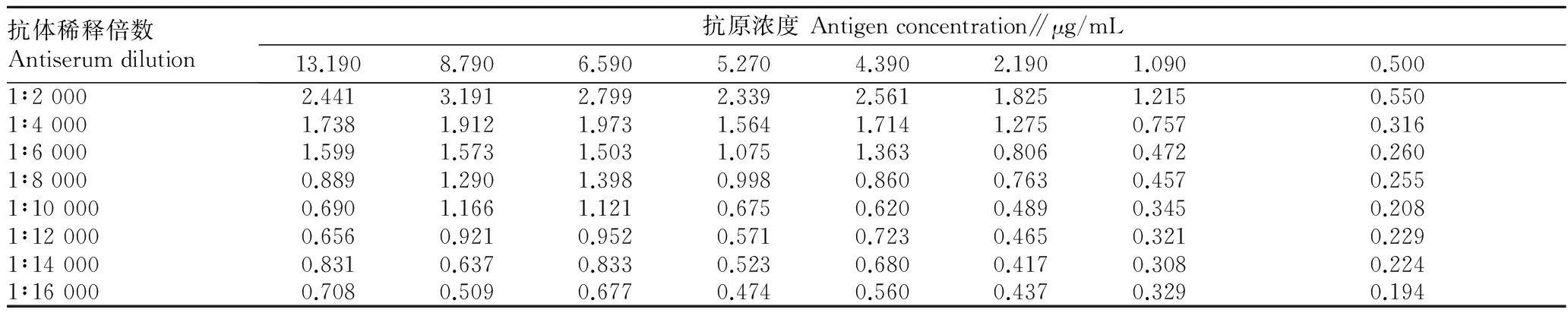
抗体稀释倍数Antiserumdilution抗原浓度Antigenconcentration∥μg/mL13.1908.7906.5905.2704.3902.1901.0900.5001∶20002.4413.1912.7992.3392.5611.8251.2150.5501∶40001.7381.9121.9731.5641.7141.2750.7570.3161∶60001.5991.5731.5031.0751.3630.8060.4720.2601∶80000.8891.2901.3980.9980.8600.7630.4570.2551∶100000.6901.1661.1210.6750.6200.4890.3450.2081∶120000.6560.9210.9520.5710.7230.4650.3210.2291∶140000.8310.6370.8330.5230.6800.4170.3080.2241∶160000.7080.5090.6770.4740.5600.4370.3290.194
2.2.2标准曲线。将标准品稀释成系列浓度(0~2.5 μg/mL),抗体1∶8 000稀释,得到的标准曲线如图2所示。标准曲线方程为:Y=94.261 9-28.717 8X,相关系数r=0.995 9,标准误差S=2.260 0。
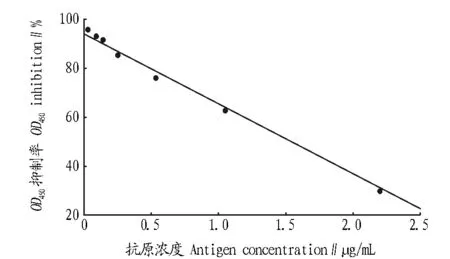
图2 ChE间接竞争ELISA的标准曲线Fig.2 Standard curve of indirect and competitive ELISA for ChE
2.2.3灵敏度。由“2.2.2”标准曲线和公式可得出ChE间接竞争ELISA的灵敏度为0.163 4 ng/mL (X=1.008 1,2SD=0.060 7)。
2.3NAGase间接非竞争ELISA
2.3.1最适抗原抗体浓度。由表3可知,当抗体稀释倍数是6 000倍时,随着抗原浓度的减小,OD450 nm值也随之降低,当抗原浓度为8.961 μg/mL时,OD450 nm值约为1.0。以抗原浓度为8.961 μg/mL作为包被原,测定抗体稀释倍数对OD450 nm值的影响,随着抗体稀释倍数的增加,OD450 nm值随之减小,抗体稀释倍数为6 000时OD450 nm值约为1.0,抗体的最适工作浓度为1∶6 000。即当抗体稀释倍数为6 000、抗原浓度为8 961 μg/mL时达到了抗原抗体用量最少,OD450 nm值约为1.0。
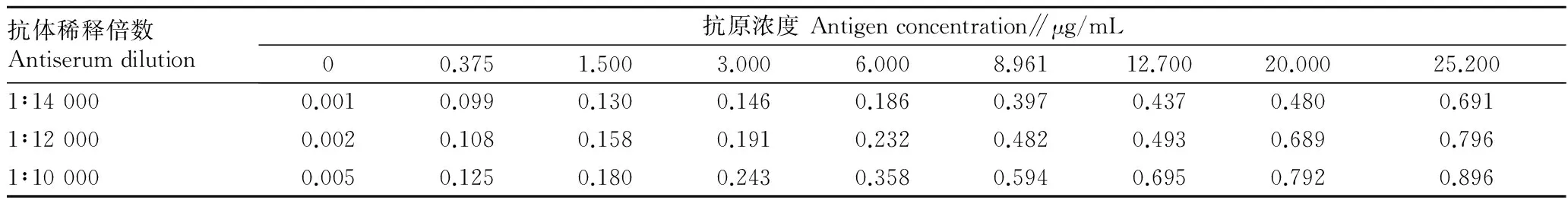
表3 NAGase间接非竞争ELISA法最适抗原抗体浓度测定结果(OD450 nm值)
接下表
2.3.2标准曲线。将标准品稀释成系列浓度(0~36 μg/mL),抗体1∶6 000稀释,得到的标准曲线如图3所示。曲线方程为:Y=1.286 4×(1-e-2.119 1x),相关系数r=0.995 7,标准误差S=0.048 4。
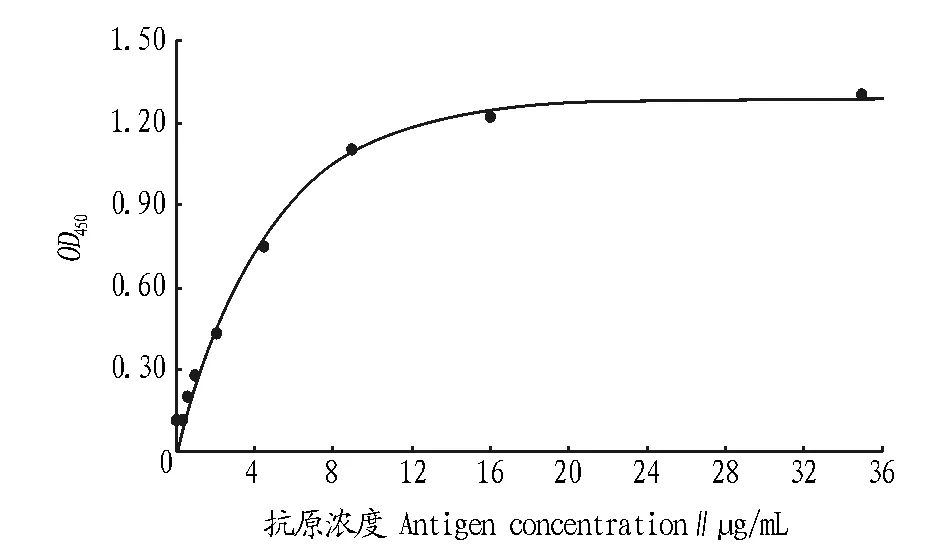
图3 NAGase间接非竞争ELISA的标准曲线(大型溞)Fig.3 Standard curve of indirect and non-competitive ELISA for NAGase
2.3.3灵敏度。由“2.3.2”标准曲线和公式可得出NAGase间接非竞争ELISA的灵敏度为4.199 9 ng/mL (X=0.009,2SD=0.002 4)。
2.4NAGase间接竞争ELISA
2.4.1最适抗原抗体浓度。由表4可知,当抗体稀释倍数是4 000倍时,随着抗原浓度的减小,OD450 nm值也随之降低,当抗原浓度为6.450 μg/mL时,OD450 nm值约为1.0。以抗原浓度为6.450 μg/mL作为包被原,测定抗体稀释倍数对OD450 nm值的影响,随着抗体稀释倍数的增加,OD450 nm值随之减小,抗体稀释倍数为4 000时OD450 nm值约为1.0,抗体的最适工作浓度为1∶4 000。即当抗体稀释倍数为4 000、抗原浓度为6.450 μg/mL时达到了抗原抗体用量最少,OD450 nm值约为1.0。

表4 NAGase间接竞争ELISA法最适抗原抗体浓度测定结果(OD450 nm值)
2.4.2标准曲线。将标准品稀释成系列浓度(0~8 μg/mL),抗体1∶4 000稀释,得到的标准曲线如图4所示。标准曲线方程为:Y=90.752 6-12.066 4X,相关系数r=0.991 8,标准误差S=4.871。
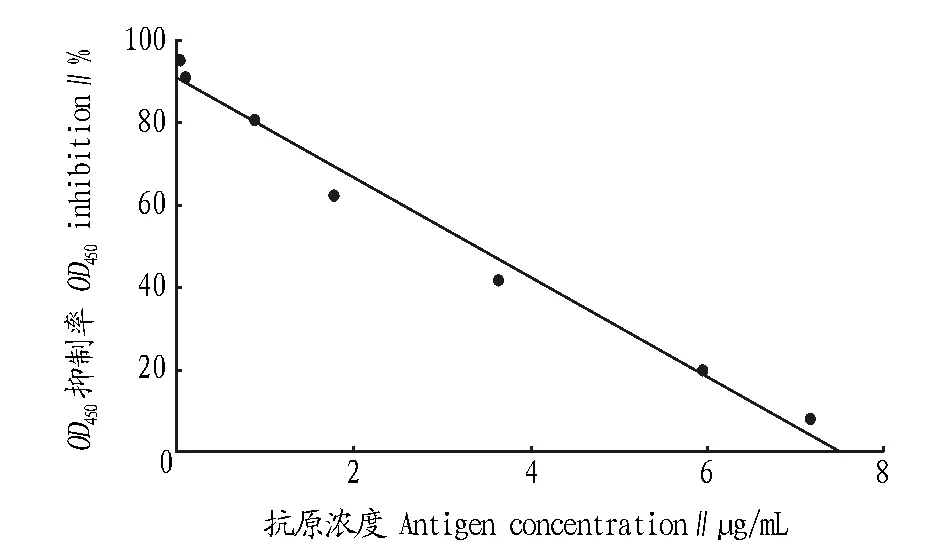
图4 NAGase间接竞争ELISA的标准曲线Fig.4 Standard curve of indirect and competitive ELISA for NAGase
2.4.3灵敏度。由“2.4.2”标准曲线和公式可得出NAGase间接竞争ELISA的灵敏度为0.250 8 ng/mL (X=1.011 3,2SD=0.106 8)。
3 讨论
该研究建立了大型溞ChE和NAGase的间接竞争ELISA方法,其灵敏度分别为0.163 4和0.250 8 ng/mL,刘洪翠等[3]曾报道大型溞ChE间接非竞争ELISA方法的灵敏度为24.000 0 ng/mL。曾晨杰[4]曾报道大型溞NAGase间接非竞争ELISA方法的灵敏度为2.120 0 ng/mL。该研究比较了ChE和NAGase 的竞争法和非竞争法,结果表明在灵敏度方面间接竞争法占有相当的优势。
间接竞争ELISA方法是先在固相载体上加入已知抗原,然后加入限量抗体,同时加入待检样品,样品中待检抗原与固相载体上包被的已知抗原竞争性结合抗体,洗涤后,固相载体上只剩下固相已知抗原与抗体结合物,经显色检测OD值,计算待检抗原的竞争抑制率,通过抑制率反映样品中待检抗原的浓度水平。间接竞争ELISA方法的理论基础是反应体系中加入限量抗体,只有在限量抗体基础上,2种抗原才能形成竞争关系[15]。
由于ELISA方法灵敏度高,很多因素会对结果产生影响。对竞争反应体系而言,加样顺序是影响ELISA结果的重要因素。目前,常用竞争反应体系的加样方式有2种:一种是加待检样品(抗原)后加特异性抗体(顺序加样方式),另一种是先将待检样品(抗原)与特异性抗体混合然后加入反应板孔(混合加样方式)。江湖[16]在建立黄曲霉毒素B1 (AFB1) 间接竞争ELISA检测方法时比较了2种加样方式的灵敏度,当抑制率为50%时,顺序加样方式和混合加样方式检测AFB1的最低浓度分别为2.5和1.5 ng/mL,即混合加样方式的灵敏度更高。梁明燕[15]检测金黄色葡萄球菌肠毒素的间接竞争ELISA的结果显示顺序加样和混合加样方式检测到的抗原最低浓度分别为5.068和8.905 ng/mL,即顺序加样方式的灵敏度较高。这与江湖[16]的报道并不一致。这些结果表明不同的检测样品对试验条件要求不同。同一样品在不同的试验条件下结果也会不同。在该试验中,并未很好地摸索竞争ELISA的最适条件,也未比较2种加样顺序是否会影响灵敏度,或者哪种加样顺序灵敏度高,而是主要比较了间接竞争ELISA和间接非竞争ELISA,2种方法基于相同的包被液、洗涤液和温育时间,后续试验中可以进一步摸索间接竞争ELISA的最适试验条件,比较不同条件下ELISA的灵敏度。
4 结论
ChE间接非竞争ELISA的最适抗原浓度和抗体稀释倍数分别为1.466 μg/mL和1∶10 000,灵敏度为7.426 7 ng/mL;ChE间接竞争ELISA的最适抗原浓度和抗体稀释倍数分别为5.277 μg/mL和1∶8 000,灵敏度为0.163 4 ng/mL;NAGase间接非竞争ELISA的最适抗原浓度和抗体稀释倍数分别为8.961 μg/mL和1∶6 000,灵敏度为4.199 9 ng/mL;NAGase间接竞争ELISA的最适抗原浓度和抗体稀释倍数分别为6.45 ng/mL和1∶4 000,灵敏度为0.250 8 ng/mL;对于大型溞ChE和NAGase,间接竞争ELISA法的灵敏度明显高于间接非竞争ELISA法。
[1] HANSON M L,LAGADIC L.Chitobiase activity as an indicator of aquatic ecosystem health[J].Aquatic ecosystem health & management,2005,8(4):441-450.
[2] DIAMANTINO T C,ALMEIDA E,SOARES M V M,et al.Characterization of cholinesterases fromDaphniamagnastraus and their inhibition by zinc[J].Environmental contamination and toxicology,2003,71(2):219-225.
[3] 刘洪翠,杨艳霞,李少南.大型溞胆碱酯酶间接非竞争酶联免疫吸附定量分析法的建立[J].浙江大学学报(农业与生命科学版),2012,38(3):347-354.
[4] 曾晨杰.大型溞NAGase多克隆抗体检测水生节肢动物丰度的适用性研究[D].杭州:浙江大学,2012.
[5] 王硕,张鸿雁,王俊平.酶联免疫吸附分析方法:基本原理及其在食品化学污染物检测中的应用[M].北京:科学出版社,2011:25-41.
[6] LU S Y,ZHOU Y,LI Y S,et al.Production of monoclonal antibody and application in indirect competitive ELISA for detecting okadaic acid and dinophytoxin-1 in seafood[J].Environmental science and pollution research,2012,19(7):2619-2626.
[7] 李媛媛,刘宾,曹凤波,等.测定三种乳蛋白抗原性间接竞争ELISA法的建立[J].食品工业,2015,36(3):290-294.
[8] 布冠好,朱婷伟,陈复生,等.大豆球蛋白间接竞争ELISA检测方法的建立[J].河南工业大学学报(自然科学版),2014(4):1-5,11.
[9] WANG S F,ZHANG S W,LAI X T,et al.Detection of adulteration of bovine milk into goat milk by a high specific indirect competitive enzyme linked immunosorbent assay[J].China dairy industry,2015,43(10):41-43,46.
[10] XIE H,ZHANG X,WANG X,et al.Preparation of anti-aflatoxin B1 monoclonal antibodies and its use in an indirect competitive ELISA for aflatoxin B1[J].Microbiology China,2015,42(10):2033-2040.
[11] 杨艳霞.大型溞胆碱酯酶免疫测定:有机磷污染的生物指示[D].杭州:浙江大学,2010.
[12] 杨利国,胡少昶,魏平华.酶免疫测定技术[M].南京:南京大学出版社,1998:385-481.
[13] KHATTAB A D,ALI L S.Immunoassays for avian butyrylcholinesterase:Implications for ecotoxicological testing and clinical biomonitoring[J].Environmental toxicology and pharmacology,2007,24(3):275-285.
[14] KITTELBERGER R,MCFADDEN A M J,HANNAH M J,et al.Comparative evaluation of four competitive/blocking ELISAs for the detection of influenza A antibodies in horses[J].Veterinary microbiology,2011,148:377-383.
[15] 梁明燕.金葡菌肠毒素表位的串联表达与间接竞争ELISA方法的建立[D].合肥:安徽农业大学,2013.
[16] 江湖.黄曲霉毒素B1间接竞争ELISA检测方法的建立与单克隆抗体免疫亲和柱的初步研究[D].南昌:南昌大学,2005.
Comparison of Competitive and Non-competitive ELISA for Determination of ChE and NAGase fromDaphniamagna
LANG Qian-ping,LI Shao-nan*,ZHENG Jia-hao et al
(Institute of Pesticide and Environmental Toxicology,Zhejiang University,Hangzhou,Zhejiang 310029)
[Objective] To explore the test condition and method sensitivity of Cholinestersae (ChE) and β-N-Acetyl-D-glucosaminidase (NAGase) fromDaphniamagnaby the methods of competitive and non-competitive ELISA.[Method] ChE and NAGase ofDaphniamagnawere detected by the methods of indirect competitive and non-competitive ELISA,respectively.[Result] As for ChE,the optimal dilutions for the antigen and the antibody were 1.466 μg/mL and 1∶10 000,respectively, and the sensitivity was measured to be 7.426 7 ng/mL if the enzyme was tested by indirect non-competitive ELISA.In case that the enzyme was tested by indirect and competitive ELISA,the optimal dilutions for the antigen and the antibody were 5.277 ug/mL and 1∶8 000,respectively,and the sensitivity was 0.163 4 ng/mL. As for the NAGase,the optimal dilutions for the antigen and the antibody were 8.961 μg/mL and 1∶6 000,respectively,and the sensitivity was 4.199 9 ng/mL if the enzyme was tested by the indirect and non-competitive ELISA.In case that the enzyme was test by indirect and competitive ELISA,the optimal dilutions for the antigen and the antibody were 6.450 μg/mL and 1∶4 000,respectively,and the sensitivity was 0.250 8 ng/mL.[Conclusion] Indirect and competitive ELISA is more sensitive than the non-competitive ELISA under the optimal concentration antigen for both ChE and NAGase.Moreover,it is simple in operation.Thus,indirect and competitive ELISA is worth to be promoted in determining NAGase and ChE content in biological and environmental samples.
ChE; NAGase; Indirect and competitive ELISA; Indirect and non-competitive ELISA;Daphniamagna
浙江省自然科学基金项目(LY12B07008)。
郎倩萍(1990- ),女,浙江湖州人,硕士研究生,研究方向:水生生态毒理学。*通讯作者,副教授,博士,硕士生导师,从事农药生态毒理研究。
2016-06-06
S 917.4
A
0517-6611(2016)24-001-05
