质子治疗中点扫描照射技术的仿真模拟
2016-10-10贾亚军李永江马晓颖蒲越虎1
贾亚军 李永江 张 潇 马晓颖 吴 超 吕 明 蒲越虎1,
1(中国科学院上海应用物理研究所 嘉定园区 上海 201800)2(中国科学院大学 北京 100049)3(上海艾普强粒子设备有限公司 上海 201800)
质子治疗中点扫描照射技术的仿真模拟
贾亚军1,2李永江3张 潇3马晓颖3吴 超1,2吕 明3蒲越虎1,3
1(中国科学院上海应用物理研究所 嘉定园区上海 201800)
2(中国科学院大学北京 100049)
3(上海艾普强粒子设备有限公司上海 201800)
粒子治疗是癌症治疗的有效手段之一,受到越来越多的关注。简述了质子治疗中的治疗系统和点扫描照射技术。利用开发的扫描照射的仿真程序,参照中国科学院上海应用物理研究所正在研制的国产首台质子治疗装置的技术指标,模拟点扫描对固定靶区和运动靶区的照射,以及加速器关断延迟对剂量分布的影响,得到在给定体积靶区照射时的总照射时间和剂量率等信息。固定靶区照射时,得到适形的剂量分布;考虑加速器关断延迟时,剂量分布与计划剂量差异较大。门控技术显著改善受呼吸运动影响的靶区的照射效果。模拟结果为正在研制的装置和将来的临床应用提供必要的参考。
质子治疗,点扫描,呼吸门控,剂量分布,关断延迟,模拟
放射治疗作为癌症治疗中的主要手段,其目标是在保证杀死癌细胞的同时,最大限度保护周围正常组织。相对光子放疗,带电粒子具有更加明显的优势,在穿过介质过程中,带电粒子最大能量损失于有限射程末端,即布拉格峰处,峰位深度后端几乎没有剂量。1955年美国加州大学Lawrence Berkeley实验室开展了世界上第一例质子治疗乳腺癌的病例[1]。随后的几十年,德国、俄罗斯、瑞士、瑞典、日本等国家相继开展粒子治疗的研究。最新的研究表明,粒子治疗具有替代外科手术的潜力[2],只是现阶段还缺少大量的随机临床数据对比。我国的山东万杰医院于2004年治疗首例病人,上海的质子重离子医院、台湾长庚医院也分别于2015年5月和11月正式收治患者;上海交通大学附属瑞金医院的国产首台质子治疗装置正于中国科学院上海应用物理研究所研发,预计2018年开展临床试验。据PTCOG数据,截止2016年3月,全世界正在运行的质子中心有53家,正在建设31家,计划建设16家[3],已有超过十万人接受质子治疗。近期国内涿州、天津、广州、武汉、合肥、长沙、郑州等地区内数家单位均有建设质子中心意向。
为充分利用质子治疗的物理特性优势和实现精准放疗,研究人员开发了三维的铅笔束(Pencil Beam)扫描照射方法,这一技术已经成功运用在瑞士PSI(Paul Scherrer Institute)[4]、德国GSI (Gesellschaft für Schwerionenforschung)[5]、日本NIRS (National Institute of Radiological Sciences)[6]、美国MD安德森(MD Anderson Cancer Center)[7]。相比被动散射体照射方法[8],扫描照射在不需要准直器和补偿器情况下可以实现更加适形的靶区剂量分布。
本文采用自主开发的仿真程序对点扫描照射进行仿真模拟,分别考虑靶区静止和受呼吸运动影响两种情况,为正在研制的装置和将来的临床应用提供必要的参考。
1 质子治疗装置系统组成
质子治疗装置主要包括:加速器、束流输运系统、治疗头、治疗控制系统、摆位系统、治疗计划系统、剂量验证系统、质子放疗信息系统等组成。用于质子治疗的加速器目前主要有同步加速器和回旋加速器两种。基于同步加速器的质子治疗系统的基本构成如图1所示。质子在离子源中引出后,经过射频加速器RFQ (Radio Frequency Quadrupole),DTL (Drift Tube Linac)加速至一定能量,进入主加速器,然后经输运线被引出到不同治疗室,通过照射系统对患者实施治疗。
通常情况下,从加速器直接引出的质子束不能直接用于患者治疗,因为其能量单一,束斑尺寸小。此时需要利用治疗头把引出的束流分别实施横向扩展和纵向扩展,形成所需的照射野。在使用扫描照射方法的质子治疗系统中,纵向扩展通过加速器主动改变能量使束流停在不同深度,最终使靶区体积内形成均匀的剂量分布。

图1 质子治疗装置系统示意图Fig.1 Schematic of proton treatment system.
治疗控制系统是基于计算机网络的分布式实时控制系统,采用大量的软硬件实施治疗控制。控制系统的主要目标[9]是:治疗过程中,确保患者和工作人员的安全;将满足治疗性能的质子束按治疗计划精确传输到肿瘤区。
摆位系统是用来保证和验证照射野位置。摆位的准确性依赖多模式图像采集,患者摆位、固定,摆位验证等步骤。利用摆位系统将照射系统的等中心点调整到治疗计划指出的等中心点位置,并且保证病人的姿态与治疗计划中一致。
治疗计划系统(Treatment Planning System, TPS)是协助医生设计和制定患者治疗计划与方案的应用软件,包括完成特定功能的应用程序。目前的TPS主要包括图像导入、图像处理(多种影像融合、靶区勾画等)、摆位用的数字重建影像(Digitally Reconstructed Radiography, DRR)的生成,计划设计、剂量计算和计划优化、评估以及精度验证用计划的生成QA-plan (Quality Assurance)等功能。
剂量验证系统是照射质量控制的重要工具,利用其实施计划和照射系统的QA。质子放疗信息系统(Radiation Information System, RIS)主要包括病人排程、诊疗和日常管理信息系统,放疗记录验证系统,患者影像存档与通讯系统,还能够传输治疗计划和其他治疗信息。此系统对实现安全高效的质子治疗具有重要作用。
2 点扫描技术
2.1基本原理
从同步加速器引出的质子束的尺寸一般只有几个毫米,为能够满足不同大小肿瘤的治疗,必须使束流横向扩展到整个照射野,并且使能量覆盖肿瘤的纵向深度范围。束流横向扩展有多种不同方法,主要分为两类:被动散射体法、动态扫描法[10]。被动散射体法是束流经散射体和射程调制器的作用扩展为均匀覆盖整个治疗体积的扩展布拉格峰(Spread-out Bragg Peak, SOBP)的方法;动态扫描中束流每次只照射靶体积的一小部分,然后改变束流的位置直至照射所有的靶体积。相比动态扫描,被动散射技术简单易行,仍在多数质子中心得到应用。但是动态扫描无需病人专用的射野挡块和射程调制器,粒子利用率高,同时产生次级碎片和中子也少,被新的质子治疗中心广泛采用。动态扫描可以形成三维适形的剂量分布,还能够实现调强质子束治疗(Intensity Modulated Proton Therapy, IMPT),对复杂形状的肿瘤更加有效。现在及未来的趋势是更多的利用动态扫描束流输运法。
动态扫描法分为两类:点扫描(Spot Scanning)[11]和光栅扫描(Raster Scanning)[12]。在使用这两种技术时,沿深度方向把肿瘤分成不同的等能量层,每一层用相同能量的质子照射,每层有一定数量的照射点,一般从最深的那一层开始照射,待该层所有照射点达到预设剂量,再改变质子束流能量,照射下一层,依次逐层扫描照射,直至全部的等能量层及照射点得到照射。

图2 点扫描照射示意图Fig.2 Schematic of spot scanning irradiation.
点扫描时如图2所示,当一个照射点照完之后,关断束流,改变扫描铁电流,移动束流至下一个照射点的位置,继续照射直至照完计划给出的所有照射点;在光栅扫描中,在点与点间移动时,不关断束流,而是快速移动束流位置,以缩短扫描照射所需的时间。
2.2照射点权重计算
为实现目标的剂量分布,点扫描中每个照射点的粒子数必须预先计算,束流能量和质子数决定了每个照射点的三维剂量分布,束流能量确定后,需要计算每个照射点的粒子数,即权重w。靶体积被分为众多的计算网格(voxels),每个voxel处剂量Di由所有照射点对它剂量贡献之和得到,如式(1):

式中:dj、wj代表第j个照射点的剂量分布、粒子数。
考虑所有计算网格后,通过逆向优化目标函数式(2),计算每个照射点的粒子数。
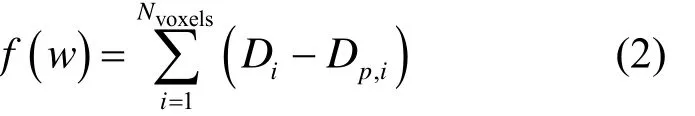
式中:Dp,i表示靶区体积V中第i个网格点处的计划剂量(考虑物理剂量优化或生物剂量优化时对应的剂量),计算时一般使用拟牛顿算法迭代,当目标函数迭代至预设条件时,得到了各个照射点的权重因子wj。
本文中计算权重因子时采取如下简化处理:1)不考虑目标函数式(2)中靶区周围危机器官(Organs at risk, OAR)的贡献;2) 靶内各等能量层中的照射点均匀排布,且同一层中所有照射点采用相同的权重,因模拟所用的靶为长方体水靶,密度处处相等,虽然靶区边缘的半影非最优,但不影响本文结论;3) 利用特定能量的质子在水中的深度剂量分布,通过移动此曲线在靶内深度方向上的位置来替代加速器主动换能,这样三维的权重优化问题就简化为只在深度方向上优化该曲线的权重的一维优化问题。
2.3考虑呼吸运动
扫描束缺点是对有位置变动的器官很敏感[13],因此照射运动靶区时需要谨慎应对。器官运动的种类有多种[14],包括位置依赖的运动、压力导致的运动(如膀胱充盈度)、血液搏动引起位置变化(主要是心脏周围)、呼吸运动(肺癌、肝癌等)。呼吸运动被认为是胸腔和腹腔内器官运动的重要因素,常运用三角函数来描述器官受呼吸影响的运动状态:

式中:A、T、φ0、r0、r(t)分别表示呼吸运动的幅度、周期、初始相位、初始位置、t时刻位置。
器官运动时,照射点位置误差会带来较大的剂量误差,本文采用门控技术[15]解决呼吸运动对剂量分布的影响。门控技术基本思想如图3所示:1) 为呼吸运动设置一个幅度阈值,小于此值所对应时间段才有可能照射,找到满足要求的呼吸门时间;2)加速器束流的周期内可供束流的时间和呼吸门时间的交集作为真正照射时间。

图3 门控技术示意图(a) 患者呼吸信号,(b) 呼吸阈值,(c) 满足阈值的呼吸信号,(d) 加速器束流时间结构,(e) 实际照射时间Fig.3 Schematic of gated technique.(a) Patients’ respiration waveform, (b) Threshold level for gatedirradiation, (c) Gated respiration signal, (d) Periodic spill structure extracted from synchrotron, (e) Real irradiation time
3 仿真模拟
点扫描模拟计算采用自主开发的仿真程序,设计思想如下:首先设置靶区(确定计算网格尺寸,分配照射点位置);设定照射点的权重,权重对应各点将要照射的绝对粒子数;绝对粒子数和束流信息确定照射点的照射时间;当在对应的照射时间内完成对束流流强的积分,移动至下一个点照射;每个计算网格内的剂量是通过所有照射点的粒子数和其剂量分布在此处的贡献的卷积运算得到,最终按要求输出剂量分布和相关结果。
3.1主要输入参数
1) 靶区和计算范围:目标靶区选择长方体,材料为水靶,尺寸为100 mm×100 mm×60 mm,靶中心距水模表面70 mm,相对位置以及照射方向如图4所示。
2) 扫描参数:X、Y、Z方向上照射点扫描间隔均为3 mm,照射点共有33×33×20=21780个。束斑形状为X、Y方向标准偏差都是为5 mm的高斯分布。X、Y方向的扫描速度分别为20 mm·ms-1和5mm·ms-1。在靶区内总计给予2 Gy的处方剂量。
3) 质子束深度剂量分布:选用动能为190 MeV的质子在水中的深度剂量分布的数据,将对应权重的该剂量分布移动至所有等能量层,如图5所示。以此方式近似替代加速器主动改变能量,形成宽度为6 cm的SOBP,各等能量层的厚度为3 mm,每层对应的该深度剂量分布曲线的相对权重见表1。
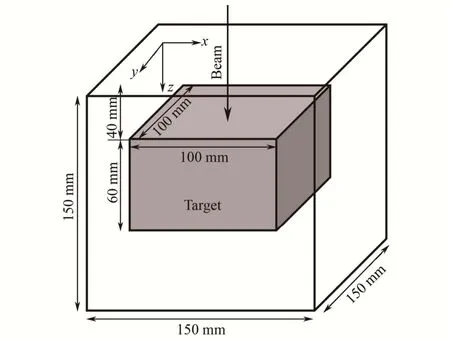
图4 靶区示意图Fig.4 Location and size of target.
4) 加速器束流参数:参照国产首台质子治疗装置的主要设计指标,单次引出质子数目(4-8)×1010,重复频率0.5-0.1 Hz;模拟时选取加速器运行周期为3.5 s,可供引出的flattop时间为1.5 s,假设1.5 s内引出4×1010个质子,理想情况下,引出束流没有波动,流强为(4×1010/1.5)/6.241×109≈4.3 nA(1 nA流强时,每秒6.241×109个质子通过)。做保守的处理,模拟时采用3.0 nA的流强。
5) 加速器关断响应延迟:关断延迟为200 μs。

图5 不同权重的深度剂量分布平移后形成的6 cm的SOBP Fig.5 The SOBP of 6-cm overlapped by a series of depth dose curves with the optimized weight.

表1 剂量深度分布在20个等能量层中的相对权重Table 1 Relative weights of the depth dose curve in 20 iso-energy layers.
3.2模拟结果
3.2.1靶区静止时的剂量分布
靶区静止时,不考虑§3.1中加速器关断响应延迟的剂量分布,见图6。本文所显示剂量均以相对靶区中心点(X=75 mm、Y=75 mm、Z=70 mm)的剂量百分比给出,图6(a)显示深度Z方向上靶区前端路径上剂量逐渐变大,在靶区内形成60 mm的SOBP,靶区尾部剂量迅速跌落;图6(b)为垂直于靶中心Z=70 mm的横向XY平面内剂量分布,可以看出剂量分布平坦;图6(c,d)分别为上述平面内X、Y方向的剂量分布,图6(c)中W为照射野的宽度(以射束中心轴剂量为100%,相对两边50%等剂量线间距离),0.8 W内剂量均匀度均小于2%,与照射野内均匀的剂量相比,边缘剂量迅速跌落,形成约6 mm半影区(80%-20%等剂量线之间的宽度)。
照射所用质子总数约为1.5×1011个,束流周期数21个,总照射时间约74 s。最深的等能量层用时两个束流周期,每个点照射时间1970 μs;最浅的等能量层用时一个束流周期,每个点照射时间148μs;剂量率为1.6 Gy·min-1(靶0.6 L时)。
考虑200 μs加速器关断延迟后,剂量分布明显变差。靶区中心沿深度Z(X=75 mm、Y=75 mm时)方向的剂量分布如图7所示,在深度40-100 mm范围内,越靠近水模表面,模拟所得到的剂量与计划剂量相差越大。造成剂量分布变差原因是:照射点达到计划剂量后,关断束流移至下一个照射点,在加速器关断响应延迟时间内,仍有额外的质子照射在该点上。而权重随靶等能量层深度Z变浅呈下降趋势,所以额外剂量与计划剂量的比值随深度变浅逐渐变大。当流强降低后,此比值变小。
实际照射过程中,束流流强是有波动的,且在关束延迟这段时间内,流强呈逐渐下降趋势,额外剂量可能比上述模拟值小。当流强为1 nA时,以更短的100 μs的关断延迟来近似等效关断束流时的流强下降,可以看到中心深度剂量与计划值的差均小于2%。消除额外剂量影响的办法是:选择合适的引出流强大小,或者把额外剂量的影响反馈到照射点的权重计算中。前者可能会加长照射时间,降低剂量率,后者实施过程会比较复杂,是值得进一步研究的课题。

图6 靶区剂量分布(a) 靶中心X=75 mm、Y=75 mm处纵向深度剂量分布,(b) Z=70 mm处横截面内剂量分布,(c) Z=70 mm、Y=75 mm处X方向剂量分布,(d) Z=70 mm、X=75 mm处Y方向剂量分布Fig.6 Dose distribution in target.(a) Depth dose at the target center of X=75 mm, Y=75 mm, (b) Dose distribution at the cross section of Z=70 mm, (c) Dose distribution in the X direction at Z=70 mm, Y=75 mm, (d) Dose distribution in the Y direction at Z=70 mm, X=75 mm

图7 靶中心纵向深度方向剂量比较Fig.7 Comparison of depth doses at target center.
3.2.2有呼吸运动时的剂量分布
对于平躺的患者,放松安静的呼吸时,肺等器官受呼吸运动影响最大的是从头到脚S-I(superior-inferior)方向,参照图5中X方向,该方向运动幅度最大可达30 mm (peak-to-peak),而左右(left-right, L-R)方向和平行于束流深度 (anteriorposterior, A-P)方向峰值幅度最大仅为8-10 mm[15],分别对应图5中Y和Z方向。X方向对应扫描速度较快的方向,Y方向对应扫描速度较慢的方向。为验证门控技术的效果,本文模拟X方向运动对剂量分布的影响,以式(2)随时间变化的周期函数近似替代,其中运动幅度、周期、初始相位、初始位置分别为20 mm、4 s、0 rad、0 mm,呼吸门控阈值为5mm。小于该阈值的适合照射时间为1s。呼吸运动时,是否采用呼吸门控的剂量分布结果对比如图8所示,在靶区中心(Z=70 mm)横截面内,剂量分布在X方向随呼吸运动平移,靶区内靠近边界一侧的照射点剂量低于计划值,差值最大可达近80%,而另一侧额外部分体积却受到照射。在所选的运动参数下,照射该层时靶区正向图8(a)中剂量不足一侧运动。模拟结果显示,当呼吸运动初始相位、运动幅度、周期变化时,剂量分布结果随之变化。直接照射运动靶时,靶区内没有得到足量照射,而附近正常组织和危机器官却得到超出计划的照射剂量。当采取呼吸门控后,靶内X方向剂量分布明显改善,边缘很快下降,满足计划要求。
模拟结果显示总照射时间为90 s,剂量率为1.3Gy·min-1(靶0.6 L时)。采用呼吸门控,靶区只有满足呼吸阈值时才可能得到照射,因此相比照射静止靶区,耗时更长,剂量率变低。

图8 呼吸和采取门控时剂量分布对比(a) 有呼吸运动靶中心Z=70 mm处横截面XY内剂量分布,(b) 采取呼吸门控后Z=70 mm处横截面XY内剂量分布,(c) Z=70 mm、Y=75 mm处X方向剂量分布,(d) X=75 mm、Y=75 mm处沿深度剂量分布Fig.8 Results of dose distribution on the moving target.(a) Dose distribution of moving target at the cross section of Z=70 mm, (b) Dose distribution utilizing gated irradiation at the cross section of Z=70 mm, (c) Dose distribution in the X direction at Z=70 mm, Y=75 mm,(d) Depth dose at the target center of X=75 mm, Y=75 mm
4 结语
本文利用仿真程序模拟质子治疗中点扫描照射技术。不考虑加速器关断响应延迟情况下,照射静止靶得到均匀的剂量分布;照射受呼吸影响的运动靶区时,采用门控技术显著改善剂量分布,达到计划要求。考虑关断束流响应延迟条件下,纵向剂量分布随深度变浅逐渐变差。照射剂量率信息对正在研制的装置提供重要参考。目前仿真程序网格剂量叠加耗时较长,下一步考虑使用GPU并行加速这一过程。
1 Tobias C A, Lawrence J H, Born J L, et al. Pituitary irradiation with high-energy proton beams a preliminary report[J]. Cancer Research, 1958, 18(2): 121-134
2 Loeffler J S, Durante M. Charged particle therapyoptimization, challenges and future directions[J]. Nature reviews Clinical oncology, 2013, 10(7): 411-424
3 Particle Therapy Co-Operative Group[EB/OL]. 2016-3-2. http://www.ptcog.ch/index.php/facilities-in-planning-stage
4 Pedroni E, Bacher R, Blattmann H, et al. The 200-MeV proton therapy project at the Paul Scherrer Institute: conceptual design and practical realization[J]. Medical Physics, 1995, 22(1): 37-53
5 Krämer M, Jäkel O, Haberer T, et al. Treatment planning for heavy-ion radiotherapy: physical beam model and dose optimization[J]. Physics in Medicine and Biology, 2000, 45(11): 3299-3317
6 Furukawa T, Inaniwa T, Sato S, et al. Performance of the NIRS fast scanning system for heavy-ion radiotherapy[J]. Medical Physics, 2010, 37(11): 5672-5682
7 Gillin M T, Sahoo N, Bues M, et al. Commissioning of the discrete spot scanning proton beam delivery system at the university of Texas MD Anderson cancer center, proton therapy center, Houston[J]. Medical Physics, 2010, 37(1): 154-163
8 Koehler A M, Schneider R J, Sisterson J M. Range modulators for protons and heavy ions[J]. Nuclear Instruments and Methods, 1975, 131(3): 437-440
9 刘世耀. 质子和重离子治疗及其装置[M]. 北京: 科学出版社, 2012: 274-276
LIU Shiyao. The proton and heavy ions therapy and its facilities[M]. Beijing: Science Press, 2012: 274-276
10 Chu W T, Ludewigt B A, Renner T R. Instrumentation for treatment of cancer using proton and light-ion beams[J]. Review of Scientific Instruments, 1993, 64(8): 2055-2122
11 Pedroni E, Bacher R, Blattmann H, et al. The 200 MeV proton therapy project at PSI: a status report[C]. Proceedings of the International Heavy Particle Therapy Workshop, Paul Scherrer Institute, 1989: 1-8
12 Chu W T, Renner T R, Ludewigt B A. Dynamic beam delivery for three-dimensional conformal therapy[C]. Proceedings of the EULIMA Workshop on the Potential Value of Light Ion Beam Therapy, Nice, France, 1988: 295-328
13 Li Q, Groezinger S O, Haberer T, et al. Online compensation for target motion with scanned particle beams: simulation environment[J]. Physics in Medicine and Biology, 2004, 49(14): 3029-3046
14 Grözinger S O. Volume conformal irradiation of moving target volumes with scanned ion beams[D]. TU Darmstadt, 2004
15 Minohara S, Kanai T, Endo M, et al. Respiratory gated irradiation system for heavy-ion radiotherapy[J]. International Journal of Radiation Oncology Biology Physics, 2000, 47(4): 1097-1103
Simulation of spot scanning in proton therapy
JIA Yajun1,2LI Yongjiang3ZHANG Xiao3MA Xiaoying3WU Chao1,2LYU Ming3PU Yuehu1,3
1(Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Jiading Campus, Shanghai 201800, China)
2(University of Chinese Academy of Sciences, Beijing 100049, China)
3(Shanghai APTRON Particle Equipment Corporation, Shanghai 201800, China)
Background: Particle beam therapy has been proved to be an effective and important method for treating cancer patients. There are more than 60 particle beam treatment centers in the world according to recent statistics. At Shanghai Institute of Applied Physics (SINAP), the first domestic prototype of a proton treatment system based on synchrotron accelerator is being developed. In order to optimize the system design for future development and estimate the performances of the prototype therapy machine using advanced active beam scanning techniques, a sophisticated simulation tool is needed. Purpose: The primary goal is to develop a computer code which can simulate the irradiation process for treating typical static and moving targets by using beam scanning technique. Using the developed code, detailed case studies will be performed to gain insights of the impacts of various machine parameters on the final dose distributions. Methods: The simulation code is composed of three major parts, namely the data preparation, irradiation action simulation, and weighted superposition of the dose contributions from all tens of thousands of scanned beam spots. The data preparation includes reading accelerator beam and scanning parameters, generating 3-dimensional (3D) energy-normalized Bragg curve, allocating scanning beam spots inside the target volume, preparing relative beam weights of each scanning beam spot and computing the absolute particle number to be irradiated to each beam spot. Then scanning irradiation is simulated by a spot-wise time integration of the beam——spills mocking the function of a beam dose monitor taking the respiratory gating and all the time delays encountered in the scanning system into account. Multi-threading parallel computing is used to speed up the simulation process. Results: Using the developed simulation code, irradiation processes with discrete spot scanning technique of a static and another moving rectangular target inside a water phantom are successfully simulated. With assumed parameters including scanning speeds, beam current time structure, beam shutoff time delay, scanning spot pitches, prescribed dose, homogeneous 3D dose distributions conformal to the target volume can be obtained. The simulation also shows that beam shutoff time on the order of 200 μs can significantly spoil the dose distribution due to larger delivered number of particles to each beam spot as compared with the planned values unless the beam current from the accelerator is kept sufficiently low. The code shows that in irradiation of a moving target, both the beam gating method and careful selection of faster scanning direction are very effective methods to reduce the interplay effects caused by the motions of the scanning beam and the target. Dose rate and total irradiation time of treating a given target under realistic beam and scanning parameters are easily obtained. Using an 8 core Intel i7-4790 CPU PC, the simulation takes typically 1.5 h for the studied cases. Conclusions: A useful simulation code is successfully developed and used to study scanning irradiation of static as well as moving targets. Impact of beam switching-off response time and beam intensity on the 3D dose distribution is quantitatively clarified. These results will be considered in works aiming at optimizing the design parameters of new proton therapy systems. It is also shown that respiratory gating technique can effectively mitigate the influence of target motion and distinctly improves the dose distribution. Future research will focus on refining the simulation models and introducing GPU based parallel computing to shorten the time needed for carrying out the simulations.
Proton therapy, Spot scanning, Bragg curve respiration gating, Dose distribution, Beam shutoff delay, Simulation
JIA Yajun, male, born in 1990, graduated from Sichuan University in 2014, master student, focusing on scanning irradiation in proton therapy
PU Yuehu, E-mail: puyuehu@sinap.ac.cn
TL99
10.11889/j.0253-3219.2016.hjs.39.090202
上海市自主创新和高新技术产业发展重大项目《首台国产质子治疗示范装置研制项目》(No.Y439022061)资助
贾亚军,男,1990年出生,2014年毕业于四川大学,现为硕士研究生,现从事质子治疗扫描照射的研究
蒲越虎,E-mail: puyuehu@sinap.ac.cn
Supported by Independent Innovation and Development of High-tech Industry Project of Shanghai (No.Y439022061)
2016-06-13,
2016-07-26
