肺炎支原体快速检测方法的建立及应用评价
2016-10-10张杰,胡军,刘杨,李元
张 杰,胡 军,刘 杨,李 元
(1.西安交通大学医学院 710049;2.陕西省安康市中心医院输血科 725000;3.陕西省人民医院中心实验室,西安 710068)
·论著·
肺炎支原体快速检测方法的建立及应用评价
张杰1,2,胡军1,3△,刘杨1,3,李元1,3
(1.西安交通大学医学院710049;2.陕西省安康市中心医院输血科725000;3.陕西省人民医院中心实验室,西安 710068)
目的制备抗肺炎支原体(MP)的特异性单克隆抗体,利用单克隆抗体建立MP胶体金快速检测方法。方法采集急性呼吸道感染患儿咽拭子标本,分离培养并鉴定MP,纯化MP抗原,制备抗MP单抗,利用单抗建立MP胶体金检测试纸条。取疑似MP感染患者的咽拭子标本,分别使用荧光定量PCR法和胶体金快速检测法对其进行检测,观察并统计检查结果。结果成功分离培养出MP菌株,灭活并纯化出MP抗原,利用该抗原免疫小鼠,通过杂交瘤技术制备出抗MP单克隆抗体19株,从中选出效价高、特异性较好的两株单克隆抗体(MP-5和MP-19)作为原材料制备MP胶体金快速检测试纸条。胶体金试纸条最低检测限为20 ng。分别采用胶体金试纸条和荧光定量PCR法对临床标本进行检测,结果显示,本研究制备的MP胶体金快速检测法的灵敏度为88.2%,特异度为82.6%。结论制备出抗MP的特异性单克隆抗体,已初步建立MP胶体金快速检测法,并为临床MP感染患者的快速诊断提供帮助。
肺炎支原体;单克隆抗体;胶体金免疫层析法
肺炎支原体(MP)是引起儿童、成人支气管炎的重要病原体之一[1],学龄期儿童是主要的易感人群,可引起儿童大叶性肺炎[2]。由于MP感染的治疗方案与其他细菌感染和病毒感染不同,区分是否为支原体感染对临床治疗有指导作用。支原体肺炎并无典型的临床体征[3],确诊是否为MP感染主要依赖于实验室检测。目前MP检测方法主要有分离培养、血清学和核酸聚合酶链反应(PCR)等[4],这些检测手段所需时间一般在数小时,甚至超过1周,对于诊断和治疗策略选择的指导价值均被严重降低。本研究主要利用单克隆抗体技术和胶体金技术建立快速检测MP的方法,并对该方法进行评价,现报道如下。
1 材料与方法
1.1标本来源采集陕西省人民医院儿科门诊40例疑似MP感染患者的咽拭子标本,其中男24例,女16例。标记标本,立即送实验室进行核酸检测和分离培养。
1.2方法
1.2.1MP分离培养和荧光定量PCR鉴定对采集的临床咽拭子标本进行核酸提取和荧光定量PCR检测,具体步骤按照试剂盒说明书操作(MP核酸检测试剂盒购于江苏硕士生物科技有限公司)。室温取出所需要数量的MP增殖鉴定培养管,做好标记,取核酸检测阳性标本0.2 mL加入培养管中接种、培养,置37 ℃恒温培养24~48 h,培养瓶内颜色由原来的红色变成黄色为阳性,培养基颜色保持不变或者变浑浊为阴性。提取阳性分离培养液中MP核酸,荧光定量PCR鉴定分离培养产物。将鉴定准确的阳性培养液用MP分离培养基划线纯菌,纯菌用20%甘油-20 ℃保存。
1.2.2MP抗原纯化和杂交瘤细胞株的建立MP分离培养阳性菌株PCR鉴定后,接种MP液体培养基进行培养,37 ℃培养48 h后,培养基颜色由原来的红色变为黄色后收获培养产物。18 000 r/min离心1 h,收获沉淀,用20 mmol/L pH7.2的磷酸盐缓冲液(PBS)重悬沉淀,离心洗涤3次。MP纯化产物灭火后常规方法免疫6~8周龄雌性Balb/c小鼠,每次0.2 mL,免疫3次,每次间隔2周。末次免疫后3 d进行杂交瘤细胞融合,无菌取小鼠脾脏,无菌研磨制备细胞悬液,与骨髓瘤细胞SP2/0按5︰1混合,缓慢加入PEG4000融合细胞,用无血清RPMI-1640培养液(Hyclone公司)1 000 r/min离心洗涤1次,用含HAT的1640培养基(含20%胎牛血清)重悬后,加入铺有饲养细胞的96孔板中,置37 ℃、5%CO2培养箱中。用间接酶联免疫吸附试验(ELISA)筛选阳性杂交瘤细胞株。
1.2.3腹水制备和单克隆抗体纯化取稳定分泌抗MP特异性单克隆抗体杂交瘤细胞株,调整细胞浓度为1×106/mL,注射入至小鼠腹腔(每只注入0.5 mL)制备腹水。无菌条件下收获腹水,饱和硫酸法纯化单抗,进一步采用蛋白G亲和层析法(KTAprime plus系统),纯化单抗。
1.2.4抗MP单抗鉴定(1)抗体效价:pH9.6的缓冲液稀释MP抗原进行包被,倍比系列稀释腹水单抗,间接ELISA测定腹水效价。(2)单抗亚类鉴定:利用SBA Clonotpying System-HRP 试剂盒(Southern Biotech公司)测定单克隆抗体亚类,按照试剂盒说明书操作。(3)单抗特异性鉴定:pH9.6的缓冲液分别稀释腺病毒抗原、MP抗原、出血热病毒抗原、呼吸道合胞病毒抗原、甲型流感病毒抗原和肺炎衣原体抗原并进行包被,间接ELISA鉴定单克隆抗体交叉反应性。(4)Western Blot分析:分别将分离株纯化产物与标准菌株蛋白(购于Microbix Biosystems 公司)进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后电转移至硝酸纤维素膜上,5%脱脂奶粉孵育1 h,加入1∶1 000稀释的单抗在4 ℃下与膜结合过夜,PBS洗膜6次,加入辣根过氧化物酶(HRP)标记的羊抗鼠IgG或羊抗兔IgG二抗,室温结合1 h,PBS洗膜6次,加入DAB显色,其中以分离菌株作为抗原,ab53600(抗MP兔多抗,购于Abcam公司)作为一抗,HRP标记的羊抗兔IgG为二抗对分离菌株进行鉴定。
1.2.5金标抗体液的制备取预先制备的胶体金颗粒溶液10 mL,磁力搅拌下,加30%的H2O232 μL;磁力搅拌混合10 min,加0.2 mmol/L的碳酸钾300 μL,磁力搅拌混匀10 min,加入纯化冻干的单克隆抗体0.2 mg;搅拌混匀60 min,加入牛血清清蛋白0.1 g;搅拌混匀10 min,加入聚乙二醇(相对分子质量为6×103)0.01 g;搅拌混匀30 min。8 000 r/min离心10 min浓缩金标抗体。酒红色单抗标记胶体金沉淀用胶体金稀释液溶解(胶体金稀释液的组成如下,牛血清清蛋白1%,蔗糖2.5%;吐温-20 0.05%;PBS 0.01 mol/L,pH7.4;叠氮钠0.1%)。
1.2.6胶体金试纸条组装利用喷金仪在金标垫上均匀铺上抗MP单抗标记的胶体金,烘干。用点膜仪将纯化的抗MP单抗(2 mg/mL)喷入反应膜上(检测线),将羊抗鼠IgG(0.8 mg/mL)进行点膜(对照线),室温晾干,即制备出反应膜。将样品垫、金垫、反应膜、吸收垫、背衬等部分进行组装,最后即得出MP胶体金检测试纸条。
1.2.7胶体金试纸条稳定性和灵敏性分别将试纸条密封保存于室温和4 ℃条件下,1个月后取出,分别取标准菌株样品和阴性样品进行试纸条检测,根据检测结果评价其稳定性。倍比系列稀释MP标准菌株样品滴加到试纸条样品垫上,以出现明显T线时的最低标准菌株样品浓度为试纸条的最低检测限值。
1.2.8标本检测将收集到的急性呼吸道感染患儿鼻/咽拭子40份,分别用MP胶体金试纸条和荧光定量PCR试剂盒进行检测,计算MP胶体金试纸条检测法的灵敏度和特异度。
1.3统计学处理采用SPSS19.0统计软件进行统计分析,计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1MP分离培养及鉴定结果共收集40例患者的咽拭子标本,MP荧光定量PCR检测阳性17例,从荧光定量PCR检测阳性标本中分离培养出1株菌株,该菌株能够特异地在MP培养基中生长,培养基颜色在接种24 h后有明显变化,提取菌株培养产物的核酸,经过荧光定量PCR鉴定后,48、72 h培养周期中均有增殖。
2.2杂交瘤细胞株建立和单克隆抗体特性分析利用MP分离株进行大量培养,灭活后纯化抗原免疫小鼠,取脾脏研磨与Sp2/0细胞融合,融合细胞筛选及克隆化获得19株能稳定分泌抗MP的单抗杂交瘤细胞株,其中2株效价最高达106,分别为MP-5和MP-19,均为IgG1型,并与腺病毒、出血热病毒、呼吸道合胞病毒、甲型流感病毒、肺炎衣原体不发生交叉反应。单抗Western Blot结果显示,MP-5和MP-19均与分离株纯化产物和标准菌体蛋白结合,2株单抗与分离株纯化产物和标准菌体蛋白结合条带一致。见图1。

注:M为蛋白标志物;1表示抗原为MP标准品,一抗为MP-5,二抗为HRP标记的羊抗鼠IgG;2表示抗原为MP标准品,一抗为MP-19,二抗为HRP标记的羊抗鼠IgG;3表示抗原为MP标准品,一抗为ab53600,二抗为HRP标记的羊抗兔IgG。
图1抗MP单克隆抗体Western Blot分析
2.3胶体金试纸条稳定性和灵敏性利用MP-5单克隆抗体标记胶体金颗粒,并均匀铺到金垫上。用MP-19单克隆抗体喷入反应膜上,以MP-5和MP-19为原料建立MP胶体金检测试纸条。在不同温度保存的试纸条上分别滴加标准菌株样品和阴性样品,检测线和质控线在加样5 min后条带颜色深浅相同。当标准菌株抗原在20 ng时,检测线肉眼可见;10 ng时,无法观察到检测线。因此,胶体金试纸条的最低检测限为20 ng。
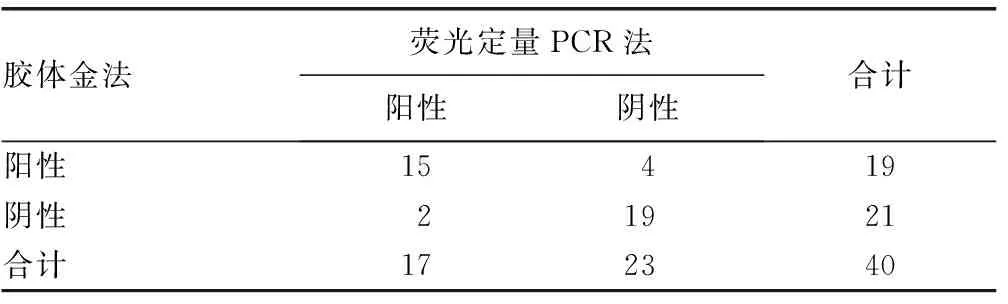
表1 荧光定量PCR法和胶体金法检测结果
2.4荧光定量PCR法和胶体金法检测结果比较分别利用胶体金法和荧光定量PCR法对40份临床标本进行检测,胶体金试纸条检测的特异度和灵敏度分别为88.2%和82.6%,荧光定量PCR法的灵敏度和特异度分别为78.9%和90.5%。见表1。
3 讨 论
目前用于MP检测的方法较多,主要包括支原体分离培养[5]、血清学检测[6]和PCR法等[7]。传统的培养法检测MP是病原诊断的金标准。但由于MP营养要求高、生长缓慢、阳性分离率低、耗时长,限制了其临床应用。多数实验室诊断都采用血清学方法,例如补体结合试验、颗粒凝集试验、间接血凝试验和不同的ELISA,以及PCR法。但是,由于MP细胞膜上的糖脂抗原与其他微生物及机体组织存在非特异交叉反应,这些血清学方法的检测质量受到一定限制。此外,由于抗体出现的时机不宜掌握,儿童、青少年与成人之间又存在MP特异抗体的差异,因此,血清学检测对标本采集时间和试验技术、试剂盒的质量要求较高。常用的PCR法灵敏度高,却无法避免由此引发假阳性结果的可能,且操作技术要求相对较高。有研究根据猪肺炎支原体(Mhp)的细胞溶质蛋白P36设计了1对特异性引物,利用PCR法快速、成功地检测出Mhp,灵敏度较高,可以检测出0.735 ng的Mhp DNA[8],并验证该方法具有很高的特异性,但由于试剂污染、扩增产物污染等原因,避免不了出现假阳性的现象[9]。而免疫荧光法检测抗原相对简便易行,但受到荧光标记物的本身光化学特点的限制,而出现不能反复观察,荧光猝灭等问题,限制了其使用[10]。有研究报道,同步盲法试验结果显示,MP ELISA检测试剂盒批内、批间产品阳性结果的一致率均为100%,具有较好的准确性及特异性[11],但其缺点是干扰因素太多,从加样、预温、洗板、显色到比色步骤繁多,每一步控制不好都可能影响检测结果[12]。赵岩等[13]利用核酸检测与抗体检测联合方法分析MP感染情况,并提出肺泡灌洗液是MP DNA检测最佳标本类型。
本研究分离出MP菌株,特异性荧光定量PCR法鉴定分离株有明显增殖,Western Blot结果也表明抗MP兔多抗可与分离株反应,从而说明分离株为MP。利用MP分离株纯化后免疫小鼠,制备出19株特异性抗MP单克隆抗体,选取其中两株(分别为MP-5和MP-19,均为IgG1型)效价最高的单抗作为胶体金试纸条的原材料。采用MP单抗成功研制出MP快速检测胶体金试纸条。该试纸条在室温保存或在4 ℃保存均可,稳定性较好。对标准品的最低检测限为20 ng。同时,分别利用胶体金试纸条和荧光定量PCR法对40份疑似MP感染患儿的咽拭子标本进行检测,胶体金试纸条检测的特异度和灵敏度分别为88.2%和82.6%,表明研制的胶体金试纸条具有一定的检测能力,而且与其他检测方法相比,检测快速、操作简便、结果判断肉眼可见、保存运输方便,能够对疑似MP患者进行初筛。Li等[14]利用MPP1抗原为识别抗原建立了免疫层析胶体金法,也获得了较好的收益。
此外,本研究组装的胶体金试纸条在临床标本检测时,漏诊2例,可能是咽拭子标本中MP抗原低于试纸条的检测限。同时,也出现4例假阳性,可能原因是试纸条存在交叉现象。由于呼吸道感染病原体抗原种类有限,单抗交叉性鉴定不能够包括所有呼吸道病原体,因此,还需进一步优化工艺,提高检测灵敏度,为临床早期诊断提供依据。
[1]Hsu CL,Lee YS,Chen CJ,et al.A population-based analysis of children with pneumonia among intensive care units in Taiwan[J].J Microbiol Immunol Infect,2015,48(2):153-159.
[2]Gao J,Yue B,Li H,et al.Epidemiology and clinical features of segmental/lobar pattern Mycoplasma pneumoniae pneumonia:A ten-year retrospective clinical study[J].Exp Ther Med,2015,10(6):2337-2344.
[3]Chiu CY,Chen CJ,Wong KS,et al.Impact of bacterial and viral coinfection on mycoplasmal pneumonia in childhood community-acquired pneumonia[J].J Microbiol Immunol Infect,2015,48(1):51-56.
[4]Katsushima Y,Katsushima F,Suzuki Y,et al.Characteristics of mycoplasma pneumoniae infection identified on culture in a pediatric clinic[J].Pediatr Int,2015,57(2):247-252.
[5]张善弟,张弛.肺炎支原体快速鉴定培养的临床应用及结果分析[J].现代检验医学杂志,2010,25(4):97-98.
[6]Pancer KW.Problem of immunoglobulin M co-detection in serological response to bacterial and viral respiratory pathogens among children suspected of legionellosis[J].Central Eur J Immunol,2015,40(2):174-179.
[7]Nummi M,Mannonen L,Puolakkainen M.Development of a multiplex real-time PCR assay for detection of Mycoplasma pneumoniae,Chlamydia pneumoniae and mutations associated with macrolide resistance in Mycoplasma pneumoniae from respiratory clinical specimens[J].Springerplus,2015,4(1):684.
[8]张红云,梁晶晶,李回,等.猪肺炎支原体PCR检测方法的建立及初步临床应用[J].广西农业科学,2010,41(3):256-258.
[9]郑甲兰.PCR检测中的假阳性和假阴性问题分析[J].中国医药指南,2012,10(22):390-391.
[10]孟凡亮,何利华,顾一心,等.实时荧光定量-聚合酶链反应方法检测肺炎支原体[J].疾病监测,2013,28(3):209-212.
[11]蔡翠云,黄新喜,吕葆真.肺炎支原体ELISA检测试剂盒的临床应用[J].微生物学免疫学进展,2014,42(4):46-49.
[12]Jin CM,Liu GQ,Zhang HY,et al.Application of ELISA method in detection of Mycoplasma pneumonia infections[J].Chin J Nosoconil,2012,22(14):3191-3192.
[13]赵岩,谢珊辉,卢丽萍.儿童肺炎支原体感染IgM 抗体和 DNA 检测结果的应用分析[J].现代检验医学杂志,2015,29(3):80-82.
[14]Li W,Liu Y,Zhao Y,et al.Rapid diagnosis of Mycoplasma pneumonia in children with pneumonia by an immune-chromatographic antigen assay[J].Sci Rep,2015,5(1):15539.
Establishment and application evaluation of rapid detection method of Mycoplasma pneuomoniae
ZHANGJie1,2,HUJun1,3△,LIUYang1,3,LIYuan1,3
(1.MedicalCollege,Xi′anJiaotongUniversity,Xi′an,Shaanxi710049,China;2.DepartmentofBloodTransfusion,AnkangMunicipalCentralHospital,Ankang,Shaanxi725000,China;3.CentralLaboratory,ShaanxiProvincialPeople′sHospital,Xi′an,Shaanxi710068,China)
ObjectiveTo prepare the specific monoclonal antibodies(mAb) of Mycoplasma pneumonia(MP) and to establish a colloidal gold rapid detection method of MP by using mAb.MethodsThe nasopharyngeal swab samples were collected from children patients with acute respiratory tract infection,separated and cultured and performed the MP identification,MP antigen was purified,mAb of MP was prepared,then the MP colloidal gold test strip was established by using MP mAb.The throat swab sample was collected from the patients with suspected MP infection and detected by using the fluorescent quantitative PCR and colloidal gold test strip.The detection results were observed and statistically analyzed.ResultsMP strain was successfully isolated and inactivated,the MP antigen was purified.The mouse was immunized by using this antigen,19 strians of mAb against MP were prepared by using the hybridoma technique.Among them,2 strains of mAb with high titer and good specificity(MP-5 and MP-19) were selected as the raw materials for preparing the MP colloidal gold rapid test strip.The lowest detection limit was 20 ng.The clinical samples were detected by using the MP colloidal gold rapid test strip and fluorescent quantitative PCR.The results showed that the sensitivity of MP colloidal gold rapid test strip by using this established method was 88.2% and its specificity was 82.6%.Conclusionspecific mAbs against MP is prepared and the colloidal gold rapid detection method is preliminarily established which provides the help for rapid diagnosis in the patients with MP infection.
Mycoplasma pneumonia;monoclonal antibody;colloidal gold immunochromatographic assay
张杰,男,副主任技师,主要从事临床输血工作及肺炎支原体血清学和病原学检测技术研究。△
,E-mail:hjj6562@163.com。
10.3969/j.issn.1673-4130.2016.17.008
A
1673-4130(2016)17-2379-03
2016-04-14
2016-06-28)
