土荆芥挥发性化感物质对蚕豆叶表皮保卫细胞的影响
2016-09-27马丹炜陈永甜袁立娜黄雪婷瞿欢欢
周 健, 马丹炜, 陈永甜, 袁立娜, 黄雪婷, 瞿欢欢
( 四川师范大学 生命科学学院, 成都 610101 )
土荆芥挥发性化感物质对蚕豆叶表皮保卫细胞的影响
周健, 马丹炜*, 陈永甜, 袁立娜, 黄雪婷, 瞿欢欢
( 四川师范大学 生命科学学院, 成都 610101 )
化感作用是外来植物土荆芥(Chenopodiumambrosioides)成功入侵的机制之一。为了探讨土荆芥挥发油的化感作用机制,该文以蚕豆(Viciafaba)叶的下表皮为材料,将表皮条孵育在分别含土荆芥挥发油、α-萜品烯和对伞花素的MES [2-(N-morpholino)ethanesulfonic acid]缓冲液中,25 ℃下光照培养30 min,采用吖啶橙/溴乙锭(AO/EB)双荧光染色法和Feulgen染色法,研究土荆芥挥发油、α-萜品烯和对伞花素对保卫细胞活性和细胞核形态的影响。结果表明:在土荆芥挥发油、α-萜品烯和对伞花素的作用下,蚕豆气孔保卫细胞活性降低,细胞核出现固缩、畸形或降解等细胞凋亡特征。随着处理剂量增加,保卫细胞活性显著下降,核异常率显著增加,表明土荆芥挥发油、α-萜品烯和对伞花素均对蚕豆保卫细胞具有细胞毒性,其中,挥发油毒性最大,α-萜品烯的毒性次之,对伞花素的毒性最小;Caspase抑制剂Z-VAD-FMK可缓解挥发油、α-萜品烯和对伞花素对保卫细胞的毒性,提高细胞活性,这种缓解效应随着抑制剂浓度的增加而增大。由此可见,土荆芥挥发油、α-萜品烯和对伞花素诱导蚕豆保卫细胞发生了Caspase依赖性的细胞凋亡。
土荆芥, 化感胁迫, 挥发油, 保卫细胞, 细胞凋亡
气孔对光合作用CO2的吸收和蒸腾作用水分的丧失具有调节功能,因此,任何改变气孔功能的因素均会影响光合作用和水分之间的关系,进而影响植物的产量(McAinsh et al,1996)。气孔保卫细胞也是植物对外界刺激作出响应的最直接门户,可对多种刺激做出反应(魏爱丽等,2014),如SO2(魏爱丽等,2014;Wei et al,2013)、铝(王毅等,2013)、砷(薛美昭等,2014)等外界环境胁迫均会诱导气孔保卫细胞发生死亡,气体甲醛胁迫增加了蚕豆(Viciafaba)保卫细胞中H2O2的积累,显著降低蚕豆的气孔导度和开度(孙慧群等,2015)。这些研究表明,气孔保卫细胞对环境变化反应灵敏是研究环境胁迫机制的良好材料。
土荆芥(Chenopodiumambrosioides)为藜科藜属一年或多年生芳香性草本植物,原产热带美洲,是我国危害极严重的外来入侵植物之一(徐海根等,2004)。外来植物在入侵过程中,向外界释放化感物质抑制周围植物生长,是其成功入侵的机制之一(Cipollini et al,2012),而细胞毒性是许多化感物质的一个重要特性(Cipollini et al,2012)。土荆芥具有较强的化感作用(Jimenez et al,1996),在其化感胁迫下,受体植物的根边缘细胞数量减少,存活率下降(李安奇等,2012);根尖分生区细胞有丝分裂指数下降,微核率和畸变率增加(胡琬君等,2011),膜脂过氧化程度加剧,抗氧化酶活性受到抑制,细胞出现氧化损伤和细胞凋亡现象(胡琬君等,2012)。这些研究结果表明,土荆芥通过挥发途径释放的化感物质对周围植物的影响很大。植物释放的挥发性化感物质除了一部分通过淋溶进入土壤影响受体植物根系外(王朋等,2008),大部分会释放到空气中作用于受体植物的地上器官,尤其是叶片。大气中的物质主要通过叶片上的气孔进入植物体,而目前有关土荆芥对气孔的影响报道较少。本研究以在土荆芥入侵地广泛种植,并且用于观察保卫细胞气孔活动的模式植物蚕豆(Viciafaba)(孙慧群等,2015)为材料,采用表皮分析法研究土荆芥挥发油及其两种主要成分α-萜品烯和对伞花素对保卫细胞的影响,为揭示土荆芥挥发性物质化感作用机制提供理论依据。
1 材料与方法
1.1 材料
供体植物土荆芥于2014年9月下旬采于四川省成都市锦江区包江桥附近的荒地。采用改进后的水蒸气蒸馏法(Singh et al,2009)提取土荆芥挥发油,用无水Na2SO4除去水分,得到淡黄色具有强烈芳香味的挥发油,测得密度为843 mg·mL-1。4 ℃保存备用。
根据文献(魏辉等,2010;熊秀芳等,1999)报道,α-萜品烯和对伞花素为土荆芥挥发油的主要成分。经四川大学测试中心分析鉴定,供试土荆芥挥发油中,α-萜品烯和对伞花素的含量分别为151和156 mg·mL-1。α-萜品烯和对伞花素的标准品及Caspase抑制剂Z-VAD-FMK均购自成都市锐可思生化试剂公司。
受体植物蚕豆种子(成胡14#)购于成都市五块石种子市场。
1.2 方法
1.2.1 材料培养挑选大小均一、饱满的蚕豆种子,用0.5% KMnO4浸泡15 min,蒸馏水浸种24 h,无光照25 ℃催芽2~3 d,待露白后播种于盛有石英砂的小花盆(直径10 cm,高度6 cm)中。置于25 ℃、光暗周期14 h/10 h的条件下培养。幼苗生长期花盆内Hoagland营养液(CaNO3·4H2O 945 mg·mL-1,KNO3506 mg·mL-1,NH4NO380 mg·mL-1,KH2PO4136 mg·mL-1,MgSO4·7H2O 493 mg·mL-1,铁盐溶液 2.5 mL,微量元素液5 mL,pH 6.0)保持在0.2%。

图 1 土荆芥挥发油、α-萜品烯和对伞花素处理后蚕豆保卫细胞活性变化 a. 对照组; b. 气孔单保卫细胞活性丧失; c. 双保卫细胞活性丧失; d. 核裂解。Fig. 1 Viability changes in the guard cells of Vicia faba exposed to volatile oil from Chenopodium ambrosioides, α-terpinene and cymene a. Control group; b. Lossing of the stoma single guard cell viability; c. Lossing of the stoma double guard cell viability; d. Nuclear degradation.

图 2 土荆芥挥发油、α-萜品烯和对伞花素对蚕豆保卫细胞活性的影响 Fig. 2 Effects of volatile oil from Chenopodium ambrosioides, cymene and α- terpinene on guard cell viabilities in Vicia faba
待蚕豆长至4周左右时取顶端完全展开的叶片,用镊子撕取1 cm × 0.5 cm的下表皮用于胁迫处理试验。
1.2.2 胁迫处理用二甲基亚砜(DMSO)配制挥发油、α-萜品烯和对伞花素处理母液。将10 μL挥发油用DMSO稀释至100 μL得到0.1 μL·μL-1的挥发油处理母液。根据10 μL挥发油中α-萜品烯和对伞花素的含量,配制二者的处理母液,其终浓度分别为0.016 9和0.018 6 μL·μL-1。
取10 mL的EP管若干,分别加入5 mL表皮缓冲液[50 mmol·L-1KCl,0.1 mmol·L-1CaCl2,0.1 mol·L-1Tris,10 mmol·L-12-(N-morpholino)ethanesulfonic acid (MES),pH7.0]。试验共设置三个处理组,即挥发油处理组、α-萜品烯处理组和对伞花素处理组,每组再分为甲、乙两组:甲组为处理组。取配置好的处理母液2,4,6,8,10 μL(分别记为梯度1、梯度2、梯度3、梯度4、梯度5),用DMSO补充处理液至10 μL后,再分别加入盛有MES缓冲液的EP管中。每个EP管放入6个表皮条,盖上盖子;乙组为缓解组。分别取10 μmol·L-1和40 μmol·L-1的10 μL Caspase抑制剂Z-VAD-FMK加入盛有MES缓冲液的EP管中,每个EP管放入6个表皮条。5 min后分别加入8 μL处理液;甲、乙均设置2个对照,甲组以缓冲液和DMSO溶剂为对照,乙组以缓冲液和8 μL处理母液为对照,甲、乙两组的EP管均置于25 ℃下光照培养30 min。每处理重复3次。
1.2.3 指标检测细胞活性检测:胁迫处理结束后,采用马丹炜等(2011)的方法略有改进。将表皮条用MES缓冲液清洗3次后,取出表皮条平铺在载玻片上,吸干缓冲液后滴加少许AO/EB染液,避光染色5 min,用LEICA DM300荧光显微镜观察保卫细胞并拍照。具有绿色荧光的为活细胞,具有橘红色荧光的为死细胞。每个处理观察1 000 个细胞,统计保卫细胞的存活率。
细胞核异常率检测:胁迫处理结束后,采用Feulgen染色法染色(王金发等,2004)。MES缓冲液清洗1次后,用卡诺氏固定液(冰醋酸∶无水乙醇 = 1∶3)固定2 h,然后放入稀盐酸中60 ℃下解离8 min,蒸馏水清洗 3 次,每次10 min。吸干水分,Schiff试剂避光染色30 min,洗掉染液,LEICA DFC450C光学显微镜观察并拍照。每个处理组观察1 000 个细胞,统计保卫细胞的核异常率。
1.3 数据统计与分析
采用SPSS17.0对数据进行处理,Duncan法对各处理组细胞存活率和细胞核形态异常率进行比较分析,Microsoft Excel 2007 作图。
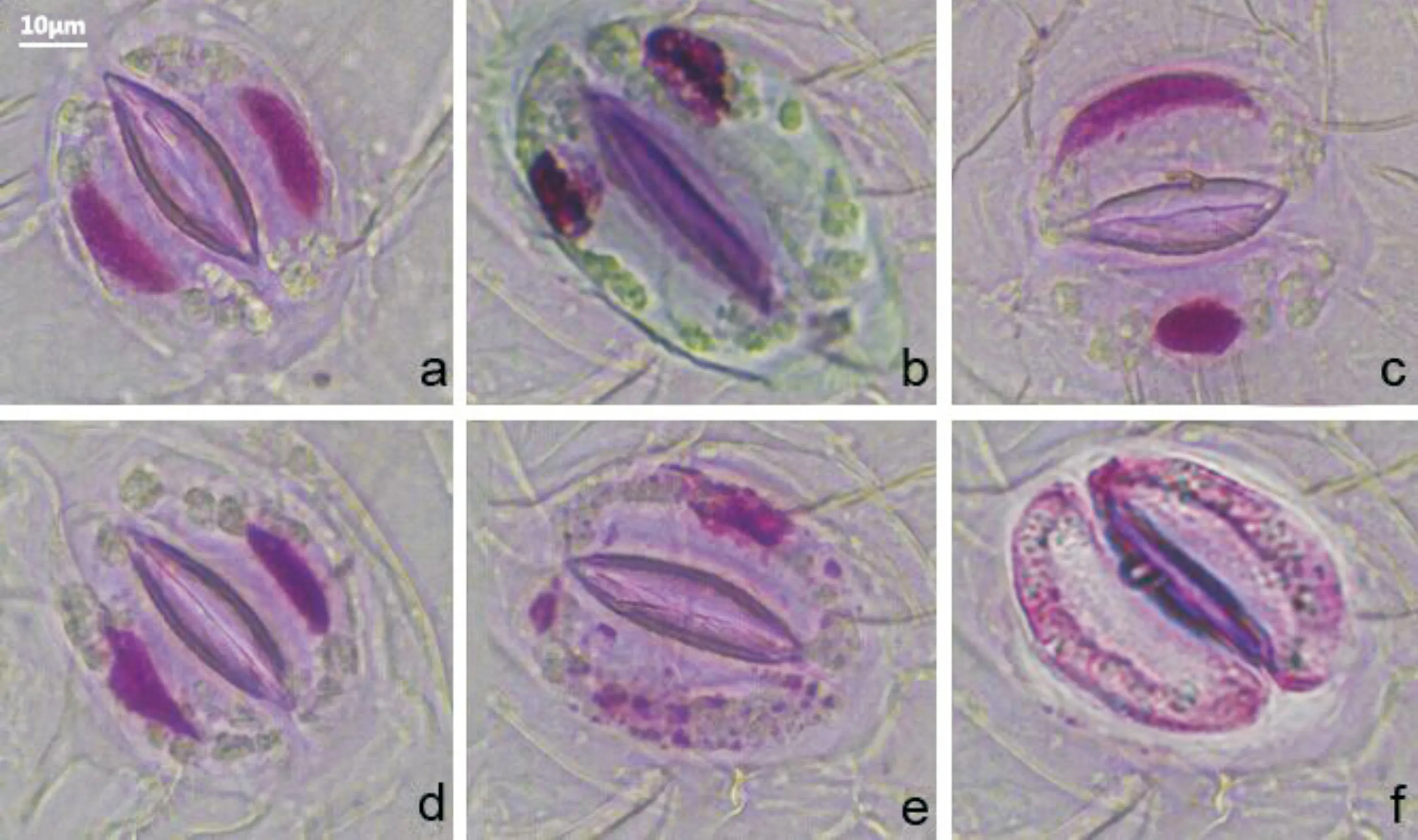
图 3 土荆芥挥发油、α-萜品烯和对伞花素作用下蚕豆保卫细胞核形态的变化a. 对照组; b. 核固缩和错位; c. 核拉长和固缩; d. 核畸形; e. 核降解; f. 核消失。Fig. 3 Changes in the nucleus morphology of guard cells in Vicia faba exposed to volatile oil from Chenopodium ambrosioides, cymene and α-terpinene a. Control group; b. Nuclear pyknosis and malposition; c. Nuclear elongation and pyknosis; d. Nuclear malformation; f. Nuclear disappearance.
2 结果与分析
2.1 土荆芥挥发油及其两种主要成分对保卫细胞活性的影响
经AO/EB染色后在荧光显微镜下观察表皮条发现,对照组中大部分保卫细胞的细胞核发亮绿色荧光(图1:a),具有较高的活性,而处理组则随着处理剂量增加,发出橘红色荧光(图1:b-c)细胞核的数目随之增加,即丧失活性的细胞数目在增加,并且出现细胞核降解红色荧光消失(图1:d)的情况,说明土荆芥挥发油、α-萜品烯和对伞花素均可以诱导保卫细胞死亡。
从图2 可以看出,与对照相比,溶剂DMSO对保卫细胞活性没有显著影响。土荆芥挥发油、α-萜品烯和对伞花素均导致保卫细胞活性降低。在挥发油处理组中,细胞活性随着挥发油处理剂量增加而显著下降(P<0.05);α-萜品烯处理组中,处理梯度1~3,随处理剂量的增加保卫细胞活性显著下降趋势(P<0.05),但随着处理剂量进一步增加细胞,存活率趋于稳定;对伞花素处理组中,除了处理梯度1的细胞存活率与对照组无显著差异,其余处理均随着处理剂量增加细胞活性逐渐下降(P<0.05);比较3个处理组发现,处理梯度5的细胞存活率为挥发油(5.0%)<α-萜品烯(18.0%)<对伞花素(34.8%),由此可见,土荆芥挥发油对蚕豆保卫细胞的毒性最大,α-萜品烯次之,对伞花素的毒性最小。
2.2 土荆芥挥发油及其两种主要成分对保卫细胞核形态的影响
土荆芥挥发油及其两种主要成分α-萜品烯和对伞花素对保卫细胞核形态具有显著的影响。经Schiff试剂染色后,光学显微镜镜检发现,对照组保卫细胞的核位于细胞中间,形态规则(图3:a);而经挥发油、α-萜品烯和对伞花素处理后,保卫细胞的核形态不规则,并出现明显的细胞程序性死亡特征如核错位、固缩、拉长或降解(图3:b-f)。
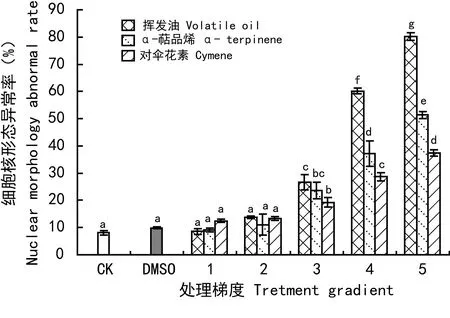
图 4 土荆芥挥发油、α-萜品烯和对伞花素对蚕豆保卫细胞核形态的影响Fig. 4 Effects of volatile oil from Chenopodium ambrosioides, cymene and α-terpinene on nucleus morphology of Vicia faba guard cells

图 5 Caspase抑制剂对土荆芥挥发油、α-萜品烯和对伞花素细胞毒性的缓解效应Fig. 5 Alleviated effects of Caspase inhibitor on the cytotoxicity of volatile oil from Chenopodium ambrosioides, α-terpinene and cymene
在土荆芥挥发油及其主要成分作用下,保卫细胞核异常率的变化如图4所示。从图4可见,较低处理剂量(梯度1和梯度2),各处理组细胞核的形态异常率与对照组、溶剂对照组均没有显著差异。但随着处理剂量进一步增加(>梯度3),细胞核异常率随之增加,并与对照呈现显著性差异(P<0.05)。比较三个处理组的保卫细胞异常率可见,挥发油处理过的保卫细胞异常率最大,α-萜品烯次之,对伞花素最小。
综上所述,土荆芥及其主要成分均诱导了保卫细胞核出现异常现象,可能导致了保卫细胞发生程序性细胞死亡。
2.3 Caspase抑制剂对土荆芥化感胁迫的缓解效应
图5显示,当处理液中加入Caspase抑制剂后,保卫细胞存活率增加,且抑制剂浓度越大,细胞活性越高。Caspase是与程序性细胞死亡密切相关的蛋白水解酶,加入Caspase抑制剂后,由土荆芥挥发油、α-萜品烯和对伞花素诱导的保卫细胞死亡现象明显减弱,由此可以证明,土荆芥及其主要成分诱导的保卫细胞死亡属于细胞凋亡。
3 讨论
3.1 土荆芥挥发性化感物质诱导保卫细胞凋亡
细胞毒性是某些化感物质的重要特性(Babula et al,2010),如许多入侵植物会释放胡桃醌、白花丹素等萘醌类化感物质,这些物质导致烟草(Nicotianatabacum)BY-2 细胞发生结构、功能以及酶的变化,细胞出现类凋亡特征(Babula et al,2009)。土荆芥挥发油导致蚕豆根尖细胞DNA发生特异性降解,形成DNA-Ladder,随着挥发油剂量增大和作用时间延长,细胞凋亡过程加剧(胡琬君等,2011)。此外,化感物质还具有明显的遗传毒性,导致受体细胞发生DNA损伤、基因突变、染色体畸变、有丝分裂受阻等(马丹炜等,2015)。本研究结果表明,土荆芥挥发油及其两种主要成分α-萜品烯和对伞花素对均具有明显的细胞毒性,随着三者处理剂量增加,蚕豆叶下表皮保卫细胞活性下降甚至死亡,细胞核均出现了核畸形、固缩和降解等细胞凋亡的典型特征(Van Doorn et al,2011), 保卫细胞的核异常率随着处理剂量增加而增大。Caspase对底物的切割使细胞呈现出凋亡的一系列形态学和分子生物学特征(翟中和等,2011),而Z-VAD-FMK是一种可以穿透细胞膜的泛Caspase抑制剂,能明显抑制Caspase活性而减少细胞凋亡。本研究结果表明,当在处理液中加入10和40 μmol·L-1的Z-VAD-FMK溶液后,细胞存活率显著提高,由此可见,土荆芥挥发油、α-萜品烯和对伞花素诱导蚕豆保卫细胞发生了Caspase依赖性的细胞凋亡。
3.2 土荆芥挥发油及其两种主要成分的化感胁迫
土荆芥释放到周围环境中的挥发性化感物质除了少部分随淋溶或土壤吸附进入土壤外,大部分会挥发到大气中,作用于植物体的地上部分,尤其是叶片。根据上述分析可知,在土荆芥挥发油及其主要成分α-萜品烯和对伞花素作用下,蚕豆叶保卫细胞发生了凋亡。从进化角度来看,细胞凋亡是植物在长期的逆境中获得的一种适应性机制。受胁迫组织通过局部细胞死亡而主动形成一道死亡细胞屏障,避免对其他组织的进一步侵害,此外,死细胞的DNA可主动降解为核苷酸,以便植物重新利用或者用来修复逆境胁迫所带来的伤害(肖军等,2008)。气孔保卫细胞也是植物对外界刺激做出响应的最直接的门户(魏爱丽等,2014),当受到土荆芥挥发性化感物质胁迫时,保卫细胞通过凋亡以阻止这些化感物质进一步伤害叶肉组织。最大处理剂量作用下,挥发油处理组、α-萜品烯处理组和对伞花素处理组的细胞存活率分别为5.0%、18.0%和34.8%,而核异常率分别为80.2%、51.4%和37.4%,三者的化感效应强度依次为挥发油>α-萜品烯>对伞花素。植物释放的化感物质不是单一的,化感物质之间也存在着协同、拮抗或简单的加合作用(孔垂华等,1998)。土荆芥挥发油是由多种物质组成的混合物,本研究结果表明,与土荆芥挥发油主要成分α-萜品烯和对伞花素相比,挥发油的化感效应强度明显较大,表明土荆芥通过挥发途径释放的包括α-萜品烯、对伞花素在内的多种化感物质之间可能存在着协同或加合作用。
BABULA P, ADAM V, KIZEK R, et al, 2009. Naphthoquinones as allelochemical triggers of programmed cell death [J]. Environ Exp Bot, 65(2): 330-337.
BABULA P, VANCO J, KOHOUTKOVA V,et al, 2010. Cell signals as markers of cytotoxicity of new complexes of naphthoquinones [J]. Anal Biomed Sign Images, 20: 259-263.
CHEN S, XIAO S, CALLAWAY RM, 2012. Light intensity alters the allelopathic effects of an exotic invader [J]. Plant Ecol Divers, 5(4): 521-526.
CIPOLLINI K, TITUS K, WAGNER C, 2012. Allelopathic effects of invasive species (Alliariapetiolata,Loniceramaackii,Ranunculusficaria) in the Midwestern United States [J]. Allelopathy J, 29 (1): 63-76.
HU WJ,MA DW,WANG YN, et al, 2011. Allelopathic potential of volatile oil fromChenopodiumambrosioidesL. on root tipcells ofViciafaba[J]. Acta Ecol Sin,31(13): 368-369. [胡琬君,马丹炜,王亚男, 等, 2011. 土荆芥挥发油对蚕豆根尖细胞的化感潜力 [J]. 生态学报,31(13): 368-369.]
HU WJ,MA DW,WANG YN, et al, 2012. Oxidative damage of volatile oil fromChenopodiumambrosioidesonViciafabaroot tip cells [J]. Chin J Appl Environ Biol, 23(4): 1 077-1 082. [胡琬君,马丹炜,王亚男,等, 2012. 土荆芥挥发油对蚕豆根尖细胞的氧化损伤 [J]. 应用生态学报, 23(4): 1 077-1 082.]
JIMENEZ-OSORNIO J, KUMAMOTO J, WASSER C, 1996. Allelopathic activity ofChenopodiumambrosioidesL. [J]. Biochem Syst Ecol, 24(3): 195-205.
KONG CH, XU T, HU F, 1998. Study on interactions among allelochemicals ofAgeratumconyzoides[J]. J Plant Ecol, 22(5): 403-408. [孔垂华, 徐涛, 胡飞, 1998. 胜红蓟化感物质之间相互作用的研究 [J]. 植物生态学报, 22(5): 403-408.]
LI AQ, WANG YN, ZHANG H, et al, 2012. Response of root border cells of soybean to culturedChenopodiumambrosioidesroot exudates [J]. Ecol Environ Sci, 21(1): 84-87. [李安奇, 王亚男, 张红, 等, 2012. 大豆根边缘细胞对土荆芥组培根分泌物的响应 [J]. 生态环境学报, 21(1): 84-87.]
MA DW,WANG YN,WANG Y, et al, 2015. Advance in allelochemical stress induced damage to plant cells [J]. Acta Ecol Sin, 35(5):1 640-1 645. [马丹炜,王亚男,王煜, 等, 2015. 化感胁迫诱导植物细胞损伤研究进展 [J]. 生态学报, 35(5):1 640-1 645.]
MA DW,WANG WJ,WANG YN, 2011. Cell biology experiment tutorial [M]. Beijing:Science Press:103. [马丹炜,王万军,王亚男, 2011. 细胞生物学实验教程 [M]. 北京:科学出版社:103.]
MCAINSH MR, CLAYTON H, MANSFIELD TA, et al, 1996. Changes in stomatal behavior and guard cell cytosolic free calcium in response to oxidative stress [J]. Plant Physiol, 111(4): 1 031-1 042.
SINGH H P, KAUR S, MITTAL S, et al, 2009. Essential oil ofArtemisiascopariainhibit plant growth by generating reactive oxygen species and causing oxidative damage [J]. J Chem Ecol, 2009, 35(2): 154-162.
SUN HQ, ZHOU SE, WU HS, et al, 2015. Effects of gaseous formaldehyde stress on the accumulation of hydrogen peroxide in guard cells and the stomata conductance and aperture ofViciafaba[J]. Plant Physiol J, 51(2): 246-252. [孙慧群,周升恩, 吴怀胜, 等, 2015. 气体甲醛胁迫对蚕豆保卫细胞中过氧化氢的积累和气孔导度及开度的影响 [J]. 植物生理学报, 51(2): 246-252.]
VAN DOORN WG, BEERS EP, DANGL JL, et al, 2011. Morphological classification of plant cell deaths [J]. Cell Death Differ, 18(8): 1 241-1 246.
WANG JF,HE YM,LIU B, 2011. Cell biology experiment tutorial [M]. Beijing:Science Press:53-54. [王金发,何炎明,刘兵, 2011. 细胞生物学实验教程 [M]. 北京:科学出版社:53-54.]
WANG P, WANG Y, KONG CH, 2008. Allelopathy of plant volatile monoterpenes mediated by soil: a case study ofAmbrosiatrifidaL. [J]. Acta Ecol Sin, 28(1): 62-68. [王朋, 王莹, 孔垂华, 2008. 植物挥发性单萜经土壤载体的化感作用——以三裂叶豚草(AmbrosiatrifidaL.)为例 [J]. 生态学报, 28(1): 62-68.]
WANG Y, YI HL, 2013. Involvement of NO in aluminum-induced guard cell death in detached epidermisofViciafabaleaves [J]. J Environ Sci, 33(6): 1 803-1 808. [王毅, 仪慧兰, 2013. NO参与铝诱导蚕豆保卫细胞死亡的调控 [J]. 环境科学学报, 33(6): 1 803-1 808.]
WEI AL, XIN XJ, WANG YS, et al, 2013. Signal regulation involved in sulfur dioxide-induced guard cell apoptosis inHemerocallisfulva[J]. Ecotox Environ Safe, 98: 41-45.
WEI AL,XIN XJ,WANG YS,et al, 2014. SO2-induced guard cells apoptosis and its sig-nal regulation inHemerocallisfulva [J]. J Environ Sci, 34(3):801-806. [魏爱丽,辛晓静,王云山,等,
(Continueonpage992)(Continuefrompage968)
2014. SO2诱导的萱草保卫细胞凋亡及其信号调节 [J]. 环境科学学报, 34(3):801-806.]
WEI H, LI B, TIAN HJ, et al, 2010. Comparison of chemical constituents of essential oil fromChenopodiumambrosioidesin different locations of Fujian Province or at different growth stages [J]. J Plant Res Environ, 19(3): 62-67. [魏辉, 李兵, 田厚军, 等, 2010. 福建省不同产地及不同生育期土荆芥精油化学成分的比较 [J]. 植物资源与环境学报, 19(3): 62-67.]
XEU MZ, YI HL, 2014. Arsenic induces guard cell death in leaf epidermis ofViciafaba[J]. Acta Ecol Sin, 34(5): 1 134-1 139. [薛美昭, 仪慧兰, 2014. 砷诱导蚕豆气孔保卫细胞死亡的毒性效应 [J]. 生态学报, 34(5): 1 134-1 139.]
XIAO J,GAO J, 2008. The inducement of apoptosis in higher plants and its biological significance [J]. J Shandong Agric Univ: Nat Sci Ed, 39(1): 125-128. [肖军,高洁, 2008. 高等植物细胞凋亡的诱因及生物学意义 [J]. 山东农业大学学报·自然科学版, 39(1): 125-128.]XIONG XF,ZHANG YH, GONG FJ, et al, 1999. Studies on the chemical constituents of the volatile oil fromChenopodiumambrosioideL. grown in Hubei [J]. J Wuhan Bot Res, 17(3): 244-248. [熊秀芳,张银华,龚复俊, 等, 1999. 湖北土荆芥挥发油化学成分研究 [J]. 武汉植物学研究, 17(3): 244-248.]
XU HG, QIANG S, 2004. Inventory invasive alien species in China [M]. Beijing: China Environmental Science Press:91-92. [徐海根, 强胜, 2004. 中国外来入侵物种编目 [M]. 北京:中国环境科学出版社:91-92.]
ZHAI ZH,WANG XZ,DING MX, 2011. Cell biology [M]. Beijing:Higher Education Press:346. [翟中和,王喜忠,丁明孝, 2011. 细胞生物学 [M]. 北京:高等教育出版社:346. ]
Effects of volatile allelochemicals fromChenopodiumambrosioideson the stoma guard cells in leaf epidermis ofViciafaba
ZHOU Jian, MA Dan-Wei*, CHEN Yong-Tian, YUAN Li-Na,HUANG Xue-Ting, QU Huan-Huan
(CollegeofLifeSciences,SichuanNormalUniversity, Chengdu 610101, China )
Chenopodiumambrosioides, an aromatic herbnative to tropical Central and South America, has become a major invasive plant in China. Allelopathy plays a crictical role in the successful invasion ofC.ambrosioides, and has an allelopathic stress on neighbor plants. To explore the allelopathy mechanism, the effects of volatile oil fromC.ambrosioides, α-terpinene and cymene on guard cell viabilities and nucleus morphology inViciafabaleaves were investigated using epidermal strips bioassay, AO/EB fluorescent staining and conventional Feulgen staining. Epidermal strips of leaves were incubated in 2-(N-morpholino) ethanesulfonic acid (MES) buffer containing volatile oil, α-terpinene and cymene for 30 min at 25 ℃ in illumination incubator. The results showed that volatile oil, α-terpinene and cymene resulted in the decrease of viabilities and increase of abnormal nuclei rates in guard cell ofV.fabaleaves. The cytotoxicity on guard cells decreased successively from volatile oil to α- terpinene to cymene. The apoptosis features including nuclear pyknotic, malposition, stretch and degradation were observed in guard cell under the treatments of volatile oil, α-terpinene and cymene. However, the guard cell survival rates increased when strips were exposed to volatile oil, α-terpinene and cymene combined with different concentrations of a caspase inhibitor Z-VAD-FMK. These results suggested that the volatile allelochemicals fromChenopodiumambrosioidesinduced guard cell caspase-dependent apoptosis inViciafabaleaves.
Chenopodiumambrosioides, allelochemical stress, volatile oil, guard cells, apoptosis
10.11931/guihaia.gxzw201504040周健, 马丹炜, 陈永甜, 等. 土荆芥挥发性化感物质对蚕豆叶表皮保卫细胞的影响 [J]. 广西植物, 2016, 36(8):963-968
ZHOU J, MA DW, CHEN YT, et al. Effects of volatile allelochemicals fromChenopodiumambrosioideson the stoma guard cells in leaf epidermis ofViciafaba[J]. Guihaia, 2016, 36(8):963-968
2015-04-27
2015-09-01
国家自然科学基金(31370549); 四川省教育厅项目(16ZA0056, 16ZB0058) [Supported by the National Natural Science Foundation of China (31370549); Deducation Office of Sichuan Province, China (16ZA0056, 16ZB0058)]。
周健(1990-),男,甘肃陇南人,硕士,主要从事细胞生物学的研究,(E-mail)1076387029@qq.com。
马丹炜,博士,教授,主要从事植物化感作用等研究,(E-mail)danwei10ma@163.com。
Q946
A
1000-3142(2016)08-0963-06
