猪流行性腹泻病毒SC-2014株的分离鉴定及繁殖条件的优化
2016-09-23陈小芬焦臣鹏苏丹萍宋亚兵陈瑞爱贺东生
王 飞,陈小芬,焦臣鹏,苏丹萍,宋亚兵,陈瑞爱,2,贺东生,2
(1.华南农业大学兽医学院 ,广东 广州 510642;2.广东温氏大华农生物科技有限公司,广东 新兴 527400)
猪流行性腹泻病毒SC-2014株的分离鉴定及繁殖条件的优化
王 飞1,陈小芬1,焦臣鹏1,苏丹萍1,宋亚兵1,陈瑞爱1,2,贺东生1,2
(1.华南农业大学兽医学院 ,广东广州510642;2.广东温氏大华农生物科技有限公司,广东新兴527400)
从四川省某猪场疑似病毒性腹泻的发病猪采集部分小肠内容物样品,应用RT-PCR检测得到该病料呈PEDV阳性,命名为SC-2014株,将其在Vero细胞上进行连续盲传,传至第8代观察到CPE,传至30代基本能够在Vero细胞上稳定增殖。并通过分别不同胰酶浓度、不同吸附时间、不同PAPN浓度到培养体系中,将分离的病毒继续繁殖8代,然后分别测定不同条件下病毒的TCID50,结果表明:在胰酶浓度为15 μg/mL,吸附时间为1.5 h,添加的PAPN浓度为5 μg/mL时,PEDV SC-2014株的病毒滴度为10-5.22,达到最大值,使PEDV SC-2014株的繁殖条件得到一定程度的优化。
猪流行性腹泻;病毒分离;繁殖条件
流行性腹泻(Porcine epidemic diarrhea,PED)由猪流行性腹泻病毒引起的高度接触性肠道传染病,临床上以腹泻,脱水,呕吐和对哺乳仔猪高死亡率为特征[1]。它对哺乳仔猪危害严重,感染后死亡率高达95%~100%,自2010年至今,在我国各省猪场发病率高居不下,给养猪业造成了巨大的经济损失。
国内外关于PEDV的致病机理、适应细胞的分子基础等方面研究相对落后,主要是由于PEDV细胞培养比较困难,直到1988年,Hofmann等首次通过在Vero细胞中添加适量胰酶,成功分离培养了PEDV[2];随后,日本Kweon CH等[3]、韩国Song DS等[4]也同样通过在Vero细胞中添加胰酶分离得到细胞适应株,并制成疫苗,近年来也相继有一些成功分离PEDV的报道,但是PEDV适应细胞难度大,繁殖滴度低仍然是现阶段研究中的两大难题。
本实验从四川某疑似病毒性腹泻猪场的发病仔猪小肠内容物中获取病料,通过在Vero细胞上连续盲传,成功分离一株猪流行性腹泻病毒,命名为SC-2014株,并不断摸索最佳繁殖条件,以便更深入地掌握该株病毒的培养特性,为疫苗生产提供指导。
1 材料与方法
1.1病料及细胞系
病料来源于四川某病毒性腹泻猪场哺乳仔猪小肠内容物,Vero E6传代细胞系由华南农业大学兽医学院传染病教研室保存。
1.2试剂与仪器
胰蛋白酶、DMEM营养液、胎牛血清购自Gibco公司;One step RTPCR试剂盒、DNA Marker-2000购自Takara公司;胰蛋白䏡磷酸肉汤、APAN购自BI公司;5%CO2细胞培养箱,细胞培养箱购自赛默飞公司,倒置显微镜(尼康)。
1.3引物的设计及合成
根据Genbank中登录的PEDV参考毒株N基因序列,利用Primer5.0软件涉及合成1对特异性引物,上下游引物分别为P1、P2,扩增产物大小为:引物序列如下P1:5’—TAAGTTGCTAGTGCGTAAT—3’,P2:5’—TTTACAACGAGAGTTACC ATTA—3’。引物由北京睿博生物技术有限公司合成。
1.4病毒RNA的提取和cDNA的合成
将小肠内容物与PBS以1∶4的比例稀释,充分震荡后反复冻融3次,6 000 r/min离心10 min,提取上清液中总RNA,按试剂盒说明书合成cDNA,将反转录产物置于-20 ℃保存备用。
1.5病毒的PCR检测
以cDNA为模板进行PCR扩增, 反 应 体 系 为:One-step RTPCR buffer 12.5μL,上下游引物各1.0μL,RNA模板3μL,灭菌的DEPC水7.5μL。PCR扩增程序为:50 ℃ 30 min;95 ℃预变性1 min;94 ℃变性5 min; 55 ℃复性30 S;72 ℃延伸70 S,30个循环;72 ℃延伸10 min;4 ℃保存。取5μL PCR扩增产物经琼脂糖凝胶电泳检测,用黑马成像仪拍照观察。
1.6病毒的分离
取PCR呈阳性的样品,在8 000 g下离心10 min,取上清液用0.22μm无菌过滤器过滤除菌。将过滤的病毒液加入终浓度为15μg/mL的胰酶,置于37℃温箱作用30 min;取24 h生长良好的Vero单层细胞的6孔细胞培养板,弃去培养液,用PBS清洗3遍,将处理好的病毒液以400μL /孔接种5孔,另1孔作对照,置于37 ℃培养箱孵育2 h后取培养板,弃去液体,每孔中加入2 mL含终浓度为25μg/mL的胰酶,0.3%胰蛋白䏡磷酸肉汤,0.02%酵母提取物的DMEM培养基,然后将培养板置于培养箱中继续培养3 d,收获病毒培养物,于-20 ℃反复冻融3次,继续进行下一代盲传,直至出现稳定的CPE。
1.7SC-2014株繁殖条件的优化
1.7.1不同胰酶浓度条件
取生长良好的Vero单层细胞,消化后分装到12孔板中,待细胞长满时弃去培养液,用PBS清洗细胞2次,加入病毒液200μL,同时加入胰酶终浓度分别为2.5μg/mL,5μg/mL,10μg/ mL,15μg/mL,20μg/mL,25μg/ mL,50μg/mL,并设置对照组,在37 ℃温箱中共同吸附1.5 h后弃去毒液,加入含胰酶各终浓度的DMEM营养液1 mL,37 ℃培养,72 h收毒,分别繁殖8代后均进行TCID50测定。
1.7.2不同吸附时间
取生长良好的Vero单层细胞,消化后分装到12孔板中,待细胞长满时弃去培养液,用PBS清洗细胞2次,加入含胰酶浓度为15μg/mL的病毒液200μL,在37 ℃温箱中分别吸附30 min、1h、1.5h、2 h后弃去毒液,每孔加入1 mL含终浓度15μg/mL胰酶的DMEM营养液,37 ℃培养,72 h收毒,分别繁殖8代后均进行TCID50测定。
1.7.3不同可溶性APAN浓度
取生长良好的Vero单层细胞,消化后分装到12孔板中,待细胞长满时弃去培养液,用PBS清洗细胞2次,先分别每孔加入终浓度为 10μg/mL,5μg/mL,2.5μg/ mL,1μg/mL,0.5μg/mL的可溶性APAN200μL,37℃吸附1 h,后每孔加入含胰酶浓度为15μg/mL的病毒液200μL,在37 ℃温箱中吸附1.5 h弃去毒液,每孔加入1 mL含终浓度15μg/mL胰酶的DMEM营养液,37 ℃培养,72 h收毒,分别繁殖8代后均进行TCID50测定。
2 结果
2.1病料RT-PCR检测结果
将病料和已知阳性PEDV、TGEV、RV提取病毒RNA后,用P1,P2引物进行RT-PCR扩增,结果如图1,病料和阳性PEDV均扩增出747 bp的目的片段,TGEV、RV均未扩增出目的条带,说明该病料为PEDV阳性,并未混合感染其他腹泻类病毒。

图1 采集粪便样品RT-PCR鉴定结果
2.2PEDV SC-2014株的分离与鉴定结果
病毒在Vero细胞上传代前几代几乎无病变,盲传至第8代出现细胞皱缩,变圆,折光性变强,部分细胞脱落等典型病变。随着传代代数的增加,细胞病变的时间逐渐变短,传至30代时基本能在Vero细胞上稳定增殖,48 h即出现轻微病变,60 h出现大面积典型病变。每隔5代做PCR检测均为阳性,由此确定PEDV SC-2014株在Vero细胞上成功分离。
2.3PEDV SC-2014株繁殖条件优化结果
2.3.1不同胰酶浓度对病毒滴度的影响
对不同胰酶浓度培养下病毒滴度测定结果如图3,当胰酶浓度在10μg/ mL以下时,病毒滴度增长幅度较小,当胰酶浓度为15μg/mL时,病毒滴度达到最高值,后随着胰酶浓度逐渐增大,病毒滴度也在缓慢降低,当胰酶浓度超过50 μg/mL时,细胞会出现脱落情况,表明SC-2014株在Vero细胞中增殖的最佳胰酶浓度为15μg/mL。
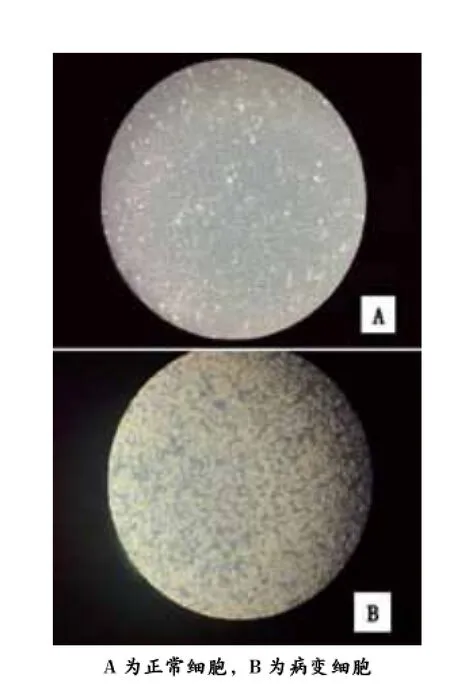
图2 正常Vero细胞和接毒病变细胞的对比
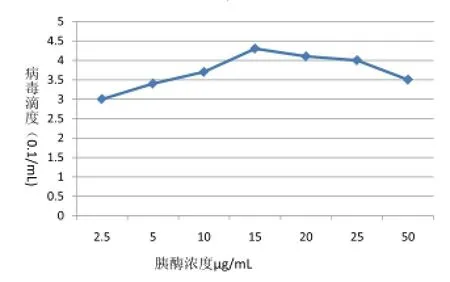
图3 不同胰酶浓度对病毒滴度的影响
2.3.2不同吸附时间对病毒滴度的影响
不同吸附时间下对病毒滴度测定结果如图4,当吸附时间为0.5 h时,病毒滴度较低,随着吸附时间的不断延长,病毒呈直线增长,当吸附时间为1.5 h时,病毒滴度达到最高值,当吸附时间为2 h时,相比1.5 h病毒滴度也在缓慢降低,表明SC-2014株在Vero细胞中增殖的最佳吸附时间是1.5 h。
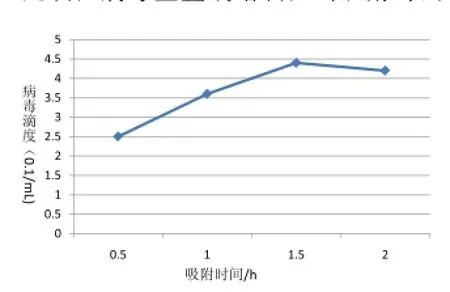
图4 不同吸附时间对病毒滴度的影响
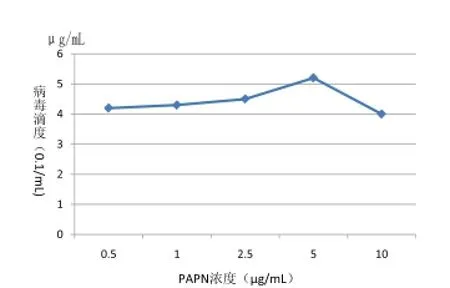
图5 不同PAPN浓度对病毒滴度的影响
2.3.3不同PAPN浓度对病毒滴度影响不同PAPN浓度作用下对病毒滴度测定结果如图5,与不加PAPN相比,
明显发现病毒滴度稍微有所提升,当PAPN浓度低于2.5μg/mL时,病毒滴度增长很小,随后随PAPN浓度逐渐增大,滴度开始有所提升,当浓度达到5μg/mL时,病毒滴度达到最高值,当PAPN浓度超过5μg/mL时,病毒又会快速下降,表明病毒对PAPN浓度比较敏感,且SC-2014株在Vero细胞中增殖时需要的最佳PAPN浓度为5μg/mL。
3 讨论
目前,国内外关于PEDV的分离鉴定和培养特性的相关报道越来越丰富。1988年,Hofmann等首次通过在Vero细胞中添加适量胰酶,成功分离培养了PEDV;2000年Shibata等用已适应Vero细胞的PEDV可转入PK和ST细胞中增殖,并产生病变[5];2002年,Kadoi K等在猪细胞系KSE6和IBRS2上不添加胰酶成功培养传代[6]。本实验通过采用Vero细胞,添加终浓度为10μg/mL的胰酶盲传至第6代产生细胞病变并能稳定传代,而且传至40代发现不添加胰酶也可在Vero细胞上继续稳定增殖,这可能是胰酶前期已对PEDV纤突蛋白有效切割,使病毒在不断传代中已适应细胞,不再需要胰酶的作用。
不同学者在PEDV培养时对于胰酶终浓度选择也是不同的,李树根等在维持液中加入60μg/mL胰酶,最终获得成功[7];田野等用胰酶终浓度为8μg/mL的维持液也成功培养PEDV[8]。本研究在PEDV SC-2014株进行培养时最终确定胰酶浓度为10μg/mL,病毒滴度达到最高,说明不同的细胞系、不同的毒株、不同的培养条件下对胰酶浓度的敏感性也是有所差异的,需要我们在实验中不断探索。
病毒培养中吸附过程是病毒感染的第一步,也是病毒能否成功大量繁殖的关键一步。朱文革等研究表明PRRSV NVDC-JXA1吸附30 min病毒增殖效果最佳[9];Iwata,K等报道PRV在Vero细胞上1 h完成吸附[10]。本实验PEDV在细胞上吸附达最大量需要1.5 h,表明不同病毒,不同毒株吸附过程所用的时间也是不同的,基本都在25~120 min之间。
Li等证实PAPN为PEDV细胞感染的一种功能性受体[11],实验中通过在Vero细胞中添加可溶性的猪氨基肽酶发现明显提高了病毒的滴度。2003年,Oh,J S等曾推测外源性受体的加入会增加病毒与细胞结合的机会,为病毒吸附细胞提供良好条件,增加病毒产量[12],本实验中也得到较好的印证。
本实验将分离的PEDV SC-2014株设置不同胰酶浓度,不同吸附时间、不同的培养时间和是否加APAN等条件,探索病毒最佳的繁殖条件,为提高病毒滴度提供途径,为大量繁殖病毒,生产高效疫苗提供重要参考。
(本实验是在华南农业大学兽医学院、人兽共患病防控制剂国家地方联合工程实验室、农业部兽用疫苗创制重点实验室、广东省动物源性人兽共患病预防与控制重点实验室完成)
[1] PENSAERT M B,DE BOUCK P,A new coronavirus-like particle associated with diarrhea in swine[J]. Arch Virol, 1978,58(3): 243-247.
[2] H O F M A N N M,W Y L E R R.Propagation of the virus of porcine epidemic diarrhea in cell culture[J]. J Clin Microbiol, 1988, 26(11): 2235-2239.
[3] KWEON C H, KWON B J,Lee J G,et al. Derivation of attenuated porcine epidemic diarrhea virus (PEDV)as vaccine candidate[J]. Vaccine,1999,17(20-21):2546-2553.
[4] SONG D S,YANG J S,OH J S,et al.Differentiation of a Vero cell adapted porcine epidemic diarrhea virus from Korean field strains by restriction fragment length polymorphism analysis of ORF 3[J]. Vaccine, 2003,21(17-18):1833-1842.
[5] SHIBATA I,TSUDAT, MORI M,et al.Isolation of porcine epidemic diarrhea virus in porcine cell cultures and experimental infection of pigs of different ages[J]. Vet Microbiol,2000,72(3-4): 173-182.
[7] 李树根,李力复,李力施,等.猪流行性腹泻病毒的分离及适应传代细胞培养病毒株的建立[J]. 中国畜禽传染病,1993(6): 1-5.
[8] 张海明,田野,王艳丽,等, 猪流行性腹泻病毒CH/GDGZ/2012株免疫原性和动物攻毒实验[J]. 猪业科学,2014,31(1): 98-99.
[9] 朱文革,贺云霞,周振成,等. PRRSV NVDC-JXA1株在Marc-145细胞上增殖条件的优化[J]. 动物医学进展,2010,31(6): 66-69.
[10] IWATA K,NAITO E,YAMASHITA K,et al. Anti pseudorabies virus activity of kumazasa extract[J]. Biocontrol Sci,2010,15(4): 123-128.
[11] LI B X, GE J W, LI Y J. Porcine aminopeptidase N is a functional receptor for the PEDV coronavirus[J]. Virology, 2007,365(1): 166-172.
[12] OH J S, SONG D S, PARK B K.Identification of a putative cellular receptor 150 kDa polypeptide for porcine epidemic diarrhea virus in porcine enterocytes[J]. J Vet Sci,2003,4(3): 269-275.
[6] KAK,SUGIOKA H, SATOH T,et al. The propagation of a porcine epidemic diarrhea virus in swine cell lines[J]. New Microbiol, 2002,25(3):285-290.
2016-03-12)
国家自然科学基金项目
王飞(1991-),男,硕士生,研究方向为动物传染病,E-mail:1137852078@qq.com
贺东生,博士、教授,兽医传染病研究方向。E-mail:dhe@scau.edu.cn
