牵张应力下骨碎补总黄酮对成骨细胞增殖及相关蛋白含量的影响
2016-09-21罗伟东姜自伟李悦黄枫蔡群斌唐宏宇吴鉴涛广州中医药大学第一附属医院广东广州510405
罗伟东,姜自伟,李悦,黄枫,蔡群斌,唐宏宇,吴鉴涛广州中医药大学第一附属医院,广东广州510405
牵张应力下骨碎补总黄酮对成骨细胞增殖及相关蛋白含量的影响
罗伟东,姜自伟,李悦,黄枫,蔡群斌,唐宏宇,吴鉴涛
广州中医药大学第一附属医院,广东广州510405
目的:观察骨碎补总黄酮对牵张应力下成骨细胞增殖及相关蛋白含量的影响。方法:对大鼠成骨样细胞系ROS1728作体外培养,取3代对数生长期成骨细胞,采用Flexcell细胞牵张系统构建成骨细胞牵张体系,使用骨碎补总黄酮含药血清进行干预24 h。应用MTT法绘制成骨细胞生长曲线;碱性磷酸酶染色法观察成骨细胞内碱性磷酸酶(ALP)含量及分布情况;采用碱性磷酸酶定量检测方法测定各组成骨细胞内ALP含量;采用ELISA法测定骨形态发生蛋白-2(BMP-2)、转化生长因子-β1(TGF β-1)的表达。结果:12 h及24 h骨碎补总黄酮各剂量组中成骨细胞数量及ALP、BMP-2、TGF β-1含量均明显增加,与空白组比较,差异均有统计学意义(P<0.05);同时,与骨碎补总黄酮低剂量组比较,骨碎补总黄酮中、高剂量组成骨细胞数目及ALP 和BMP-2的含量增高,差异均有统计学意义(P<0.05);骨碎补总黄酮各剂量组中TGF β-1的含量比较,差异无统计学意义(P>0.05)。结论:在牵张应力下,骨碎补总黄酮可明显促进成骨细胞增殖及相关蛋白的合成。
牵张应力;骨碎补总黄酮;成骨细胞;动物实验;大鼠
机械应力是骨组织正常生理状态及修复重建过程中重要的刺激因素,其中,成骨细胞是主要的效应细胞之一[1]。研究表明,12%的牵张应力对成骨细胞增殖分化具有更好的促进作用[2~3]。在成骨细胞增殖分化及其调控基质矿化的过程中碱性磷酸酶(alkaline phosphatase,ALP)、骨形态发生蛋白-2 (bone morphogenetic protein-2,BMP-2)、转化生长因子β-1(transforming growth factor β-1,TGFβ-1)发挥着重要作用[4~6]。因此,研究力学刺激下,成骨细胞增殖分化及其成骨效能的改变有利于深入了解骨组织重建机制,通过检测牵张应力下ALP、BMP-2及TGFβ-1的表达,可有效评价成骨细胞增殖分化能力。
目前已有研究表明,骨碎补总黄酮能促进牵张成骨动物模型中牵张区的骨痂形成,提高局部ALP和BMP-2的含量,加快骨痂的矿化和增强生物力学性能[7]。因此,本实验拟建立成骨细胞牵张体系,给予骨碎补总黄酮含药血清进行干预,观察成骨细胞分化和增殖的改变,同时检测成骨细胞合成及分泌的ALP、BMP-2、TGFβ-1的含量,进一步探讨牵张应力下骨碎补总黄酮对成骨细胞的作用机制,为补肾中药在骨愈合领域的应用提供实验基础。
1 实验材料和方法
1.1 药物及主要试剂强骨胶囊(其成分为骨碎补总黄酮,北京岐黄制药有限公司,国药准字220030007),每粒胶囊含骨碎补总黄酮180 mg,以蒸馏水溶解配制成一定浓度(0.46 g/L)的骨碎补总黄酮混悬液。动物等效服药量按体表面积计算,为0.22 g/(kg·d)。采用灌胃干预,干预浓度分别为:高浓度0.44 g/(kg·d)、中浓度0.22 g/(kg·d)、低浓度0.11 g/(kg·d)。10%水合氯醛(广州中医药第一附属医院制备),RPMI 1640培养基(美国Gibco公司),胎牛血清(美国Gibco公司),0.25%胰蛋白酶(美国Gibco公司),MTT试剂盒(武汉博士德生物工程有限公司),ALP活性测定试剂盒(南京建成生物公司),大鼠BMP-2、TGFβ-1 ELISA试剂盒(上海西唐生物科技有限公司),PBS缓释液(美国Gibco公司)。
1.2 实验动物分组及含药血清的制备SD大鼠20只,雄性,SPF级,体重(180±20)g,由南方医科大学动物实验中心提供,用于制备含药血清。饲养环境:广州中医药大学三元里校区实验动物中心SPF级动物房。将12~14周龄SD雄性大鼠20只随机分成4组:生理盐水组、骨碎补总黄酮高、中、低各剂量组,每组5只。每天灌胃2次,间隔5 h,连续灌胃5天,最后1次灌胃2 h后,乙醚麻醉后采用腹主动脉取血,4℃,3000 r/min,离心15 min获取血清,37℃水浴30 min,抽滤除菌,-20℃冰箱保存。
1.3 成骨细胞的培养传代、鉴定、分组及干预大鼠成骨样细胞系ROS1728由上海拜力生物技术有限公司提供。①成骨细胞体外培养及传代:所用培养液为含1%谷氨酰胺、链霉素100 U/mL、青霉素100 U/mL、和10%胎牛血清的α-MEM培养液(Gibco,USA)。将购买的细胞加入消化液1 mL,37℃培养箱0.5 min,镜下见细胞收缩变圆或少数脱落后,振荡器低频振荡,移液器打入2.5 mL培养基,吹打3次,分装于培养瓶,加入培养基,于37℃、5%CO2孵箱中培养,每隔24 h进行换液,光镜下观察至细胞群融合后进行传代。②成骨细胞形态学鉴定:细胞贴壁培养24 h后,随机取2组细胞进行形态学观察,将培养瓶置于荧光倒置显微镜下放大100倍后进行观察。③成骨细胞分组:采用第三代对数生长期细胞,加入0.25%胰蛋白酶,细胞计数器计数,调整细胞浓度为2×105/mL,取2 mL接种于6孔专用培养板,加入完全培养基,37℃、5%CO2条件下培养24 h。然后将各培养孔内细胞随机分为:空白血清组(空白组),骨碎补总黄酮低剂量组(低剂量组)、骨碎补总黄酮中剂量组(中剂量组)和骨碎补总黄酮高剂量组(高剂量组)。④干预措施:将6孔专用培养板置于Flexcell-5000T系统,对成骨细胞加载牵张应力,形变率设定为12%,牵张频率为6 r/min,共牵张24 h。光镜下观察细胞贴壁后,根据分组情况在生理盐水组中加入等量15%的空白血清培养基,在骨碎补总黄酮高、中、低剂量组中分别加入等量的不同浓度的骨碎补总黄酮含药血清培养基。置于37℃、5%CO2培养箱中培养24 h,同时以12%牵张形变率、0.5 Hz牵张频率继续加载牵张应力。
1.4 统计学方法实验数据采用SPSS17.0软件包进行统计分析,实验结果采用(±s)表示,组间差异的比较采用单因素方差分析,使用LSD法进行组间两两比较。
2 检测指标
2.1 MTT法观察成骨细胞增殖能力将5 mg MTT溶于1 mL 的PBS(PH 7.4)中,滤膜过滤,于4℃棕色瓶中保存。ROS1728细胞以每孔104个接种至弹性基底膜,加入培养液培养24 h,用PBS洗1次,每孔加10 μL MTT,继续培养2 h。吸弃孔内培养上清,每孔加入1∶1的DMSO2和乙醇溶液共100 μL,震荡,使结晶物充分溶解,在酶标仪上选择490 nm波长测定每孔的光密度值(OD值),绘制细胞增殖曲线。
2.2 碱性磷酸酶染色成骨细胞涂片4%多聚甲醛固定5 min,自然晾干,蒸馏水润洗30 s,滴加基质液数滴覆盖标本,37℃孵育15 min,甩掉多余染液,立即滴加显色液A 5 min,水洗30 s,保持样本湿润,滴加显色液B 30 s,水洗30 s,滴加复染剂复染30 s,水洗30 s,甩干,镜检。细胞质中阳性反应呈现灰黑色颗粒或块状、条状沉淀。
2.3 碱性磷酸酶定量测定于血清干预后12 h、24 h进行检测,在酶标板上设定测定孔、空白孔和标准孔,各设三个复孔,取各组培养孔内上清液,分别加入各孔内,每孔30 μL;其中,于空白孔中加入双蒸水30 μL,于标准孔内加入0.02 mg/mL标准应用液30μL;各孔再以此加入50 μL基质液以及50 μL缓冲液,移液枪吹打混匀,于37℃水浴15 min,然后加入显色剂150 μL,摇床充分振荡混匀。采用酶标仪于520 nm波长下检测各孔吸光度值,根据说明书中的公式计算ALP含量。
2.4 BMP-2和TGF β-1含量测定胰蛋白酶消化获取成骨细胞悬液,PBS稀释,细胞浓度达到100万/mL左右。-20℃反复冻融5次,3000 r/min,离心20 min,收集上清,-20℃保存备用。采用ELISA试剂盒,按照说明书上的操作步骤分别测量BMP-2、TGFβ-1的含量。
3 结果
3.1 成骨细胞鉴定结果见图1。细胞形态学鉴别培养24 h后,细胞多呈梭形、三角形或有2~3个突起,胞质透亮、饱满,符合成骨细胞形态学特征。
3.2 各组成骨细胞增殖分化能力的比较见表1和图2。12 h及24 h ALP定量测定结果与MTT检测结果显示:与空白组比较,骨碎补总黄酮高、中、低剂量组ALP含量及成骨细胞数量明显增多,差异均有统计学意义(P<0.05);与低剂量组比较,骨碎补总黄酮中、高剂量组ALP含量和成骨细胞数量增加更明显,差异均有统计学意义(P<0.05);骨碎补总黄酮中剂量组与骨碎补总黄酮高剂量组间ALP含量和成骨细胞数量的差异无统计学意义(P>0.05)。
12 h及24 h ALP染色结果示:骨碎补总黄酮各剂量组中成骨细胞数量较空白组明显增多;各组内成骨细胞的细胞质中均可见棕黄色ALP阳性颗粒,跟空白组比较,骨碎补总黄酮各剂量组中,ALP阳性颗粒颜色较深,同时ALP阳性颗粒分布密度均有显著增多,说明骨碎补总黄酮各剂量组中ALP含量增多;在中药各剂量组的比较中,中、高剂量组内成骨细胞数量及ALP含量均明显增多,而中、高剂量组无明显差异。

图1 第一代成骨细胞(100×)

图2 各组ALP染色结果比较(100×)
表112 h、24 h各组成骨细胞ALP活性及MTT检测结果比较(±s)
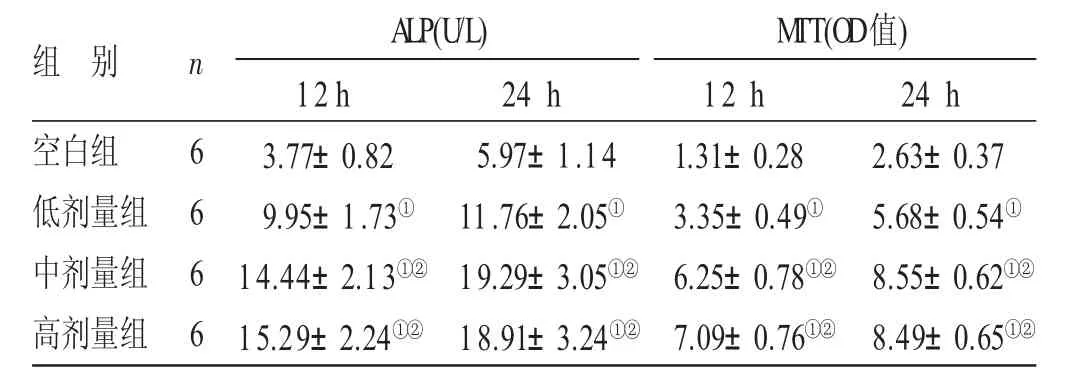
表112 h、24 h各组成骨细胞ALP活性及MTT检测结果比较(±s)
与空白组比较,①P<0.05;与低剂量组比较,②P<0.05
组别空白组低剂量组中剂量组高剂量组n 6 6 6 6 ALP(U/L)M TT(OD值)12 h 3.77±0.82 9.95±1.73①14.44±2.13①②15.29±2.24①②24 h 5.97±1.14 11.76±2.05①19.29±3.05①②18.91±3.24①②12 h 1.31±0.28 3.35±0.49①6.25±0.78①②7.09±0.76①②24 h 2.63±0.37 5.68±0.54①8.55±0.62①②8.49±0.65①②
3.3 各组成骨细胞BMP-2、TGF β-1含量的比较见表2。牵张12 h及24 h,与空白组比较,骨碎补总黄酮高、中、低剂量组中BMP-2及TGFβ-1的含量明显增多,差异均有统计学意义(P<0.05);与低剂量组比较,骨髓补总黄酮高、中剂量组中BMP-2的含量明显高于骨碎补总黄酮低剂量组,差异均有统计学意义(P<0.05);骨碎补总黄酮各剂量组中TGFβ-1的含量差异无统计学意义(P>0.05)。
表212 h、24 h各组BMP-2和TGFβ-1含量比较(±s)
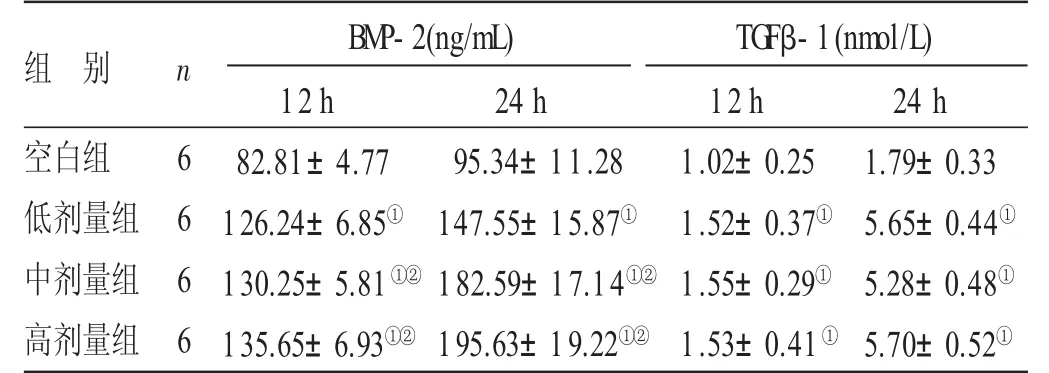
表212 h、24 h各组BMP-2和TGFβ-1含量比较(±s)
与空白组比较,①P<0.05;与低剂量组比较,②P<0.05
组别空白组低剂量组中剂量组高剂量组n 6 6 6 6 BM P-2(ng/mL)TGFβ-1(nmol/L)12 h 82.81±4.77 126.24±6.85①130.25±5.81①②135.65±6.93①②24 h 95.34±11.28 147.55±15.87①182.59±17.14①②195.63±19.22①②12 h 1.02±0.25 1.52±0.37①1.55±0.29①1.53±0.41①24 h 1.79±0.33 5.65±0.44①5.28±0.48①5.70±0.52①
4 讨论
在正常生理活动过程中,随着机械应力的作用,骨组织以骨单位中的骨吸收、骨形成为基础进行骨重建[8]。在临床中,应力的缺失或持续应力的作用可导致骨流失或骨组织的塑形改造,引起骨骼病理改变或促进骨组织修复愈合。研究发现,合理的机械力学刺激可以促进成骨细胞增殖分化,增加骨量[9]。在牵张应力下,骨组织发生形变,牵张应力在骨组织内部传导可引起骨基质内的成骨细胞发生牵张形变。离体细胞牵张力学实验是目前国内外研究的热点,Flexcell细胞应力加载系统是目前公认的离体培养细胞的力学实验方法[10~11]。李菲菲等[12]证实,利用Flexcell细胞牵张系统,12%的拉伸应变率是比较合适的牵张刺激,可促进成骨细胞增殖,同时增强成骨细胞矿化结节的形成。在体外建立成骨细胞牵张模型,能够模拟牵张成骨中微观的细胞生物学环境,对于研究牵张成骨的细胞生物应答具有重要意义。
骨碎补是补肾的代表药物,在临床常用于骨折筋伤、肾虚腰痛、跌扑闪挫的治疗。已有实验证实其在促进骨折愈合、调节骨代谢、提高骨量、改善损伤局部微循环方面,具有较强的药理作用。在本研究中,构建了成骨细胞牵张体系,并采用骨碎补总黄酮含药血清进行干预。经过MTT检测法发现牵拉12 h及24 h,骨碎补总黄酮可明显促进细胞增殖,而骨碎补总黄酮中、高剂量可进一步促进成骨细胞增殖;同时,骨碎补总黄酮于牵拉12 h及24 h后可明显提高ALP、BMP-2和TGFβ-1的含量。研究结果证实,在牵张应力下,骨碎补总黄酮可明显促进成骨细胞合成及分泌ALP、BMP-2和TGFβ-1,促进成骨细胞分化、增殖,并可促进骨基质的合成。但本研究仍有诸多不足之处:①本实验采用离体成骨细胞构建成骨细胞牵张体系,不能完全反应体内环境牵张应力下成骨细胞的变化;②针对骨碎补总黄酮在成骨细胞牵张体系的研究,关于骨髓补总黄酮的干预浓度、干预方式以及干预时间尚未有统一的标准。因此,在后续的相关研究中,需深入探索应力刺激与药物作用的干预条件,有利于更好的结合两者,并促进补肾法在骨愈合与骨代谢领域的应用。
[1]Wu XT,Sun LW,Qi HY,et al.The bio-response of osteocytesand itsregulation on osteoblastsunder vibration[J].CellBiolInt,2016,40(4):397-406.
[2]Klein-Nulend J,van Oers RF,Bakker AD,et al.Bone cell mechanosensitivity,estrogen deficiency,and osteoporosis[J].J Biomech,2015,48(5):855-865.
[3]Ito R,Matsumiya T,Kon T,et al.Periosteum-derived cells respond to mechanical stretch and activate Wnt and BMP signaling pathways[J].Biomed Res,2014,35(1):69-79.
[4]Zhang L,Gan X,Zhu Z,et al.Reactive oxygen species regulatory mechanisms associated with rapid response of MC3T3-E1 cells for vibration stress[J]. Biochem Biophys Res Commun,2016,470(3):510-515.
[5]Zeng Z,Yin X,Zhang X,et al.Cyclic stretch enhancesbonemorphogenetic protein-2-induced osteoblastic differentiation through the inhibition of Hey1[J]. Int J MolMed,2015,36(5):1273-1281.
[6]HamzehMT,SridharaR,AlexanderLD.Cyclic stretch-induced TGF-β1 and fibronectin expression is mediated byβ1-integrin through c-Src-and STAT3-dependent pathways in renal epithelial cells[J].Am J PhysiolRenalPhysiol,2015,308(5):F425-F436.
[7]孙丙银.骨碎补总黄酮促进股骨缺损牵张成骨新骨形成的实验研究[D].广州:广州中医药大学,2013.
[8]KobayashiY,Uehara S,Udagawa N,et al.Regulation of bone metabolism by Wnt signals[J].J Biochem,2016,159(4):387-392.
[9]朱斌,郭华,郝喜娟,等.失重性骨质疏松的发生机制及中药对其防治作用的研究进展[J].中国骨伤,2012,25(7):611-616.
[10]Damaraju S,Matyas JR,Rancourt DE,et al.The effect of mechanical stimulation on mineralization in differentiating osteoblasts in collagen-I scaffolds[J]. Tissue Eng Part A,2014,20(23-24):3142-3153.
[11]Michael DR,Javaheri B,Helen EJ,et al.Preclinical models for in vitro mechanical loading of bone-derived cells[J].Bonekey Rep,2015(4):728.
[12]李菲菲,丁寅,陈富林,等.机械牵张应力对成骨细胞增殖和分化影响的初步研究[J].口腔医学研究,2012,28(6):507-512.
(责任编辑:冯天保,郑锋玲)
Effect of Total Flavonoids in Rhizoma Drynariae under Tensile Stress on Osteoblast Proliferation and Correlative Protein Content
LUO Weidong,JIANG Ziwei,LI Yue,HUANG Feng,CAI Qunbin,TANG Hongyu,WU Jiantao
Objective:To observe effect of total flavonoids in rhizoma drynariae under tensile stress on osteoblast proliferation and correlative protein content.Methods:Cultured rats'osteoblast-like cells lines ROS1728 in vitro.Get 3rd osteoblasts in the logarithmic phase and establish osteoblasts tensile system using Flexcell,intervene with total flavonoids in rhizoma drynariae drug serum for 24 h.Drew osteoblasts growth curve by method of MTT,and observed contents and distribution of alkaline phosphatase(ALP)in osteoblasts by alkaline phosphatase staining method,detected ALP contents of osteoblasts in every group by alkaline phosphatase quantitative test method,detected expression of bone morphogenetic protein-2(BMP-2)and transforming growth factor(TGFβ-1)by ELISA method.Results:The number of osteoblasts and content of ALP,BMP-2 and TGFβ-1in all dose groups of 12h and 24h total flavonoids in rhizoma drynariae were all increased,comparing with those in blank group,differences being significant(P<0.05).At the same time,comparing with low dose group of total flavonoids in rhizoma drynariae,the number of osteoblasts and content of ALP and BMP-2 in mid and high dose group of total flavonoids in rhizoma drynariae were increased,differences being significant(P<0.05).Comparing content of TGFβ-1 in all dose group of total flavonoids in rhizoma,difference was not significant(P>0.05).Conclusion:Total flavonoids in rhizoma drynariae can promote osteoblast proliferation and synthesis of involved protein obviously.
Tensile stress;Total flavonoids in rhizoma drynariae;Osteoblast;Animal experiment;Rats
R285.5
A
0256-7415(2016)08-0299-04
10.13457/j.cnki.jncm.2016.08.132
2016-03-06
国家自然科学基金青年项目(81403413);广东省中医药局建设中医药强省项目(20142046)
罗伟东(1981-),男,主治医师,研究方向:四肢骨折成骨愈合。
姜自伟,E-mail:ainemylyy@163.com。
