青稞种子带菌检测及杀菌剂消毒处理效果
2016-09-14况卫刚思红兵罗来鑫张治萍李迎宾李健强
况卫刚, 思红兵, 罗来鑫, 张治萍, 李迎宾, 李健强*
(1. 中国农业大学植物病理系,种苗健康北京市工程研究中心, 北京 100193;2. 云南省迪庆藏族自治州植保植检站, 云南 674400)
技术与应用
青稞种子带菌检测及杀菌剂消毒处理效果
况卫刚1,思红兵2,罗来鑫1,张治萍1,李迎宾1,李健强1*
(1. 中国农业大学植物病理系,种苗健康北京市工程研究中心, 北京100193;2. 云南省迪庆藏族自治州植保植检站, 云南674400)
为了研究青稞种子外部和内部携带真菌情况,比较不同杀菌剂对青稞种子的带菌消毒效果和对幼苗生长的影响,为青稞种子播前包衣处理和种传真菌病害防控提供依据,采用离体平皿法对云南迪庆‘云青1号’、‘云青2号’和‘短白青稞’3个主栽品种进行带菌检测,并对种子进行拌种或浸种处理测定6种杀菌剂对种子消毒效果,分析杀菌剂对种子发芽和幼苗生长的影响。结果表明:供试青稞种子表面携带的优势菌群为青霉(Penicilliumspp.)、镰刀菌(Fusariumspp.);种子内部寄藏的真菌主要为镰刀菌、核腔菌(Pyrenophoraspp.)、附球菌(Epicoccumspp.)、丝核菌(Rhizoctoniaspp.)、链格孢(Alternariaspp.)和木霉(Trichodermaspp.)。青稞不同品种的种子表面及内部携带的真菌种类差异较大。致病性测定表明,镰刀菌对种子萌发和幼苗生长影响最大,后期出现幼苗坏死现象。45%咪鲜胺EW、75%百菌清WP、50%福美双WP对青稞种子携带真菌均有显著抑制作用和消毒效果,50%福美双WP消毒效果最优,达100%;45%咪鲜胺EW、75%百菌清WP、50%福美双WP处理对青稞种子发芽和幼苗生长均无显著影响。
青稞;种带真菌;带菌检测;杀菌剂;消毒效果
青稞(HordeumvulgareLinn.var.nudumHook.f.)是禾本科大麦属的一种禾谷类作物,籽粒裸露,又称裸大麦、元麦[1],生长的海拔高度可达4 700 m以上[2-3],主要分布在我国西藏、青海、四川甘孜和阿坝、云南迪庆、甘肃甘南等青藏高原高寒地区。裸大麦作为我国藏族人民的主要粮食作物具有重要的经济价值,但国外相关资源材料匮乏,国内由于研究手段及技术设备等多方面限制,也未能对其进行深入的研究[4]。青稞是云南迪庆高原藏区不可替代的粮食作物,是以青稞为依托的系列产品的重要原料,具有广阔的开发利用前景,但由于病虫害等的影响,其产量、品质不容乐观。青稞上发生的病害种类多、分布广、危害大,常见的种传病害有黑穗病﹑云纹病﹑网斑病、条纹病等[5-6]。这些病害对青稞种质资源的生产及利用造成了重大的影响。目前生产中尚无产前种子处理预防青稞病害的技术措施,造成青稞出苗前烂种烂芽、出苗后发生病害,防治难度大,防治效果差,以致减产、减收。种子处理是建立在种子带菌检测和种传、土传病害发生发展规律基础之上的一项综合技术[7]。播种前对种子进行健康检测和消毒处理,可以提高播种质量,有效降低种传病害的发生[8],是防治青稞种传病害最简单有效的措施之一。国内外对种子带菌检测和种子消毒处理做了很多研究[9-11],但目前关于青稞种子健康检测和种子药剂消毒处理鲜有文献报道。
本研究参考国际种子检验规程和农作物种子健康检测方法[12],通过对云南迪庆高原藏区目前主栽的3个青稞品种进行种子寄藏真菌检测,依据青稞种子携带优势菌种类及不同杀菌剂的作用特点,筛选出适合种子消毒处理的药剂,为青稞种子产区间安全调运和实施种子预防保健处理,预防种传病害提供参考和理论依据。
1 材料与方法
1.1研究材料
供试种子:‘云青1号’,‘云青2号’和‘短白青稞’为云南迪庆主栽青稞品种,其籽粒由云南迪庆州植保站提供,2012年采收。
供试杀菌剂:45%咪鲜胺水乳剂,50%多菌灵可湿性粉剂,50%福美双可湿性粉剂,75%百菌清可湿性粉剂,15%三唑醇可湿性粉剂,25 g/L灭菌唑悬浮种衣剂,均由中国农业大学种子病理与杀菌剂药理学研究室提供。
1.2种子内外部带菌检测
1)种子外部带菌检测:从每份样品中随机选取400粒种子放入300 mL锥形瓶中,加入50 mL无菌水充分振荡,吸取悬浮液1 mL进行10、100、1 000浓度梯度稀释,吸取100 μL加到直径为9 cm的PDA平板上涂匀,每个浓度3皿。以加入无菌水作为空白对照,25℃温箱中黑暗条件下培养,每隔24 h观察1次,选取合适的稀释浓度统计培养皿上的菌落数,计算种子的孢子负荷量及种子外部携带真菌的分离比例,对各处理中出现的分离物进行转皿纯化保存,备鉴定用[13]。
孢子负荷量(个/粒)=(3皿菌落总数/0.3 mL)×稀释倍数×50 mL/400粒;
分离比例(%)=(携带某种真菌菌落数/菌落总数)×100。
2)种子内部带菌检测:从每个供试品种中随机选取种子400粒,在1%的次氯酸钠溶液中浸泡1~3 min,无菌水冲洗4次,在无菌培养皿底部铺两层灭菌滤纸,将种子倒入其中,用滤纸吸干种子表面的水分;然后将种子均匀摆放在直径为9 cm的PDA平板上,每皿10粒,5皿为1重复,重复3次;25℃恒温箱中黑暗培养,每隔24 h观察记录。统计种子寄藏真菌种类、带菌率和分离比例。对各处理中出现的分离物纯化保存,备鉴定用[14]。
带菌率(%)=(带菌种子总数/检测种子总数)×100。
1.3种子携带真菌种类鉴定
形态学鉴定:将分离到的各种真菌转移到PDA培养基进行纯化,利用单反数码相机拍摄菌落形态。按常规真菌鉴定方法,根据病原菌培养性状和形态特征,参考《真菌鉴定手册》[15]进行鉴定。
分子鉴定:采用CTAB法提取各分离菌株的菌丝DNA[16],利用真菌ITS通用引物ITS1(5′-TCCGTAGGTGAACCTGCGC-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增[17],PCR产物测序由北京博迈德生物技术有限公司完成,将获得的各菌株ITS序列与NCBI核苷酸数据库中已注册的序列进行BLAST比对,其中,镰刀菌ITS序列与镰刀菌鉴定数据库http://isolate.fusariumdb.org/index.php进行比对,进一步确定菌株的属、种地位。
1.4种子携带真菌对种子发芽和幼苗生长的影响
将纯化的真菌转移到PDA平皿上,待菌落即将长满全皿时,将‘短白青稞’种子分为9份,每份约400粒,用1%次氯酸钠表面消毒1~3 min,无菌水漂洗4次后晾干,随后将种子均匀撒播在长有该种子携带真菌的PDA平板上,种子与菌丝及孢子在25℃恒温箱中共培养48 h,以不含真菌的PDA培养基为对照,培养期间将其在水平方向摇动3~5次,使种子均匀接触到真菌[18-20],备用。
滤纸皿床发芽试验,随机选取接种过真菌的种子200 粒,以腹面朝下的方式均匀放入直径为9 cm的培养皿中,培养皿底部放有3层灭菌滤纸,并向皿中加入约3 mL无菌水保持滤纸湿润。每处理5皿,每皿放10粒种子,4个重复,于25℃培养箱中培养。每隔24 h记录发芽种子数,以芽长超过种子长度约1/2为发芽标准,每皿每天加入约1 mL无菌水保持滤纸湿润。第3天调查发芽势,5 d后测定发芽率,并随机取10株幼苗测定苗高、根长和幼苗鲜重。
发芽势(%)=(第3天发芽种子数/检测种子总数)×100;
发芽率(%)=(第5天发芽种子数/检测种子总数)×100。
1.5杀菌剂对青稞带菌种子的消毒效果
青稞种子用以下药剂处理:50%多菌灵WP、50%福美双WP、75%百菌清WP、15%三唑醇WP均按1∶333药种比进行拌种;25g/L灭菌唑FSC按种子与药液100∶1进行拌种,采用手工拌种法,在自封袋内加入称好的药剂和种子,加入适量无菌水振荡均匀后晾干;45%咪鲜胺EW以900倍稀释液进行浸种,浸种在培养皿内进行,加入适量去离子水和药剂混匀,以正好完全浸没种子为宜,风干备用。经过药剂处理的种子均匀摆放在直径为9 cm的PDA平板上,每皿10粒,共5皿,以不做任何处理的种子为空白对照,每个处理4次重复,25℃培养3 d后观察结果,记录种子带菌情况,评价杀菌剂的种子消毒效果。
种子消毒效果(%)=(对照样品的带菌率-杀菌剂处理样品的带菌率)/对照样品的带菌率×100。
1.6杀菌剂对青稞种子发芽及幼苗生长的影响
将药剂处理后的种子均匀摆放在直径为9 cm、内置湿润滤纸的培养皿上,每皿25粒,4次重复。25℃下培养并于第3天和第5天统计种子的发芽势和发芽率。同时随机挑选消毒后的种子播种在塑料育苗盆中,盆中沙子经160℃干热灭菌2 h,每盆50粒,4次重复,7~10 d后观察记录出苗率,第14天,每处理随机选取具有代表性的10株幼苗,记录株高、根生长情况和植株鲜重等指标。
出苗率(%)=(出苗株数/播种量)×100。
1.7数据统计分析方法
采用Microsoft Excel进行数据统计,利用SAS 8.0软件对试验结果进行方差分析和多重比较(Duncan新复极差法)。
2 结果与分析
2.1种子携带病菌种类检测
鉴定结果表明,各菌株ITS序列与NCBI中注册的相应菌株的ITS序列相似度都达99%以上。分离获得的优势真菌主要为燕麦镰刀菌(Fusariumavenaceum)、柔毛镰刀菌(F.flocciferum)、三线镰刀菌(F.tricinctum)、麦类核腔菌(Pyrenophoragraminea)、圆核腔菌(P.teres)、丝核菌(Rhizoctoniaspp.)、链格孢(Alternariaspp.)和木霉(Trichodermaspp.)等,部分真菌菌落形态见图1。
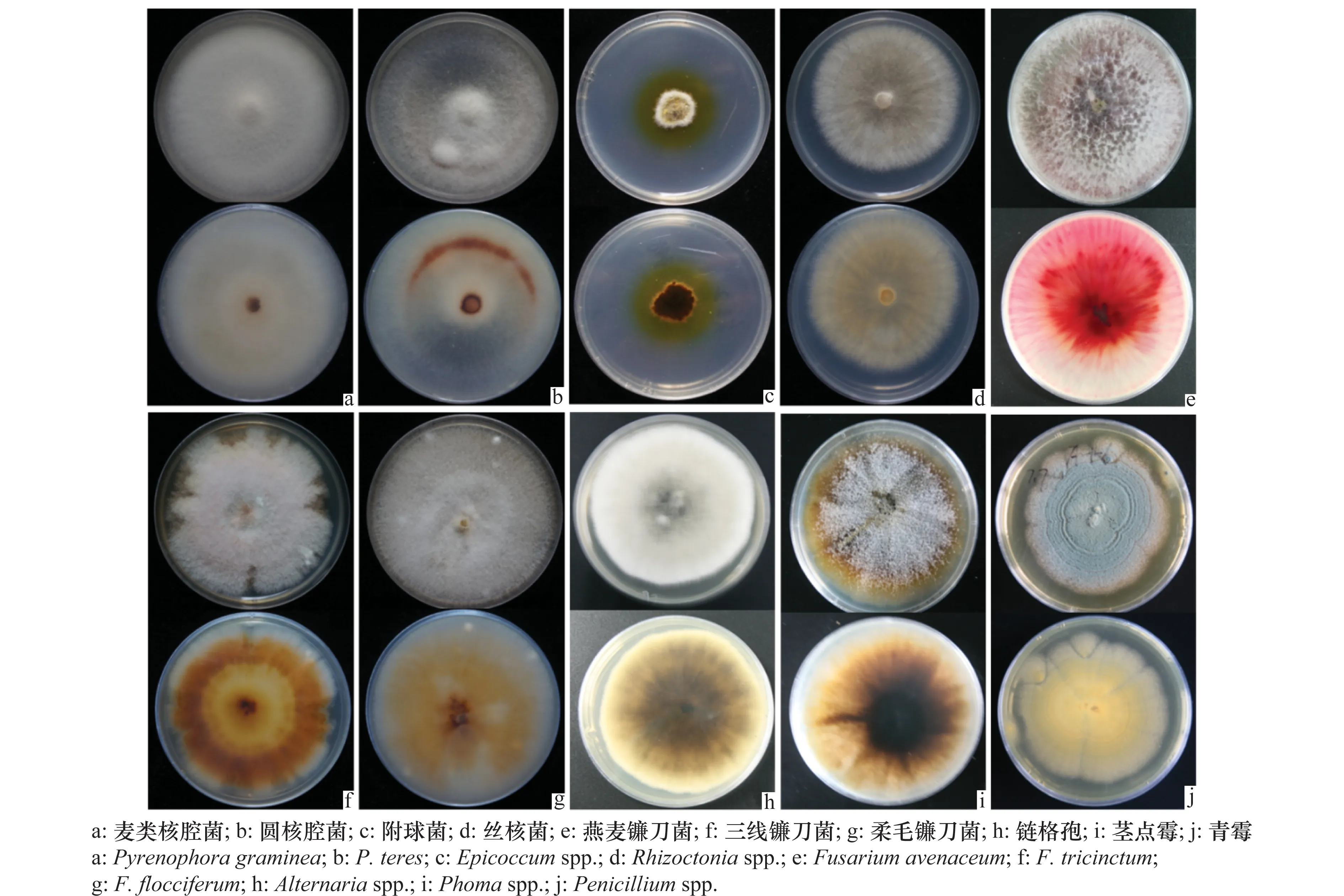
图1 种带真菌在PDA培养基上的菌落形态Fig.1 Colony morphology of fungal species on PDA
不同品种青稞种子内外携带病原情况差异较明显(表1~2),‘云青1号’种子外部未检测到携带真菌;内部只检测到少量真菌。‘短白青稞’种子内外携带的病菌分离比例达到了100%,其种子外部孢子负荷量为1 125个/粒,而种子内部带菌率比其他2个品种高,达到41%。主要菌群为镰刀菌(Fusariumspp.)、核腔菌(Pyrenophoraspp.)、附球菌(Epicoccumspp.)、链格孢(Alternariaspp.)分离比例分别为31.7%、31.7%、17.1%、9.76%。‘云青2号’只在种子外部分离到了青霉,种子内部未分离到真菌。

表1 青稞种子外部携带的真菌种类和分离比例1)
1) 表中“-”表示未分离到真菌。下同。
“-” shows that no fungi was detected. The same as in the following tables.

表2 青稞种子内部携带的真菌种类和分离比例
2.2种带真菌对种子发芽和幼苗生长的影响
由于‘云青1号’和‘云青2号’2个青稞品种种子内外部只分离到少量的真菌,因此本研究主要对‘短白青稞’种子内外部分离到的真菌进行研究。将分离到的真菌接种‘短白青稞’种子,通过检测6项指标分析种带真菌对种子活力的影响。不同真菌对种子萌、发生长均有一定的影响,其中镰刀菌对种子萌发、生长的影响最大(表3)。F.flocciferum、F.tricinctum、F.avenaceum对种子萌发后苗的生长以及根的形成有显著抑制作用;F.tricinctum、F.avenaceum对种子萌发和根的生长有显著抑制作用;F.avenaceum处理的样品根长与对照组有显著差异,同时3种镰刀菌处理过的种子萌发生长一定时间后大部分出现坏死现象,3种镰刀菌处理后苗重、根重与对照相比均有显著差异。核腔菌(Pyrenophoraspp.)、链格孢菌(Alternariasp.)、丝核菌(Rhizoctoniasp.)、木霉(Trichodermasp.)对青稞种子发芽率、发芽势、苗长及根长比均无显著影响。
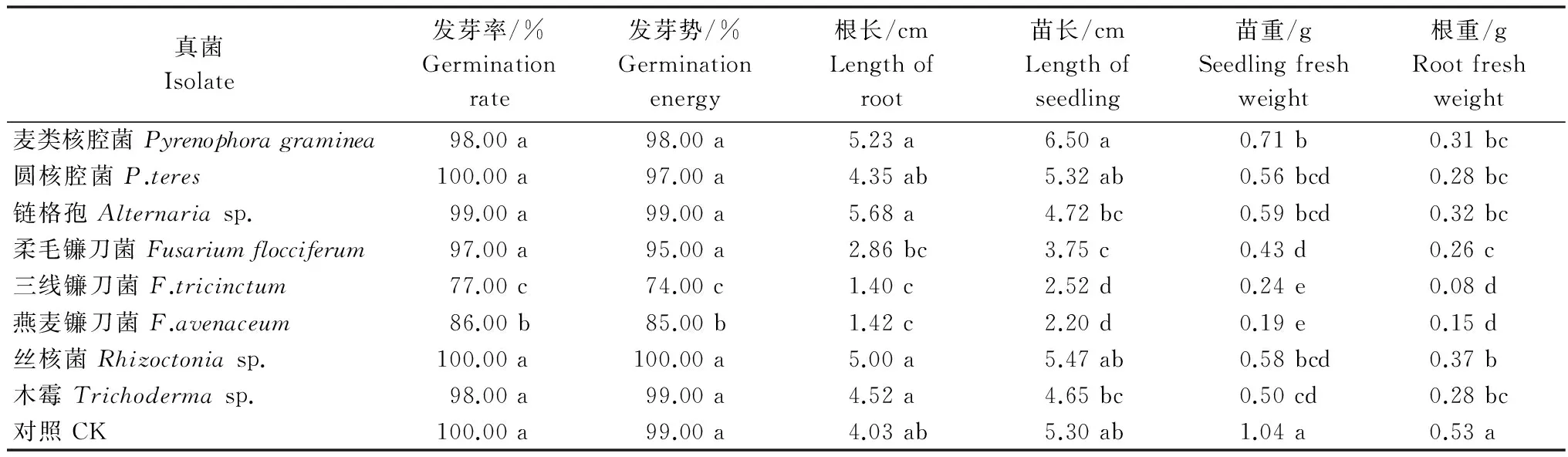
表3 种带真菌对青稞种子发芽和幼苗生长的影响1)
1) 同列数据后相同字母表示在0.05水平无显著差异。下同。
Values followed by the same letters in same column are not significantly different at 0.05 level from each other, The same as follows.
2.3杀菌剂对带菌种子的消毒效果
根据图2可以得出,不同的药剂处理对种子的消毒效果差异较明显,50%福美双WP、75%百菌清WP和45%咪鲜胺EW对青稞种子具有较好的消毒效果,分别达100%、86.67%、76.67%,在0.05水平显著优于25 g/L灭菌唑FSC(53.33%)、15%三唑醇WP(50%)和50%多菌灵WP(20%)。
2.4杀菌剂对青稞种子发芽及幼苗生长的影响
25 g/L灭菌唑FSC和15%三唑醇WP拌种对青稞种子的发芽势、发芽率有显著抑制作用,同时15%三唑醇WP显著抑制青稞种子的出苗以及茎的生长,却对青稞幼苗根的生长有促进作用。45%咪鲜胺EW、75%百菌清WP、50%多菌灵WP、50%福美双WP拌种对青稞种子的发芽及幼苗的生长与对照组相比均没有显著差异(表4)。
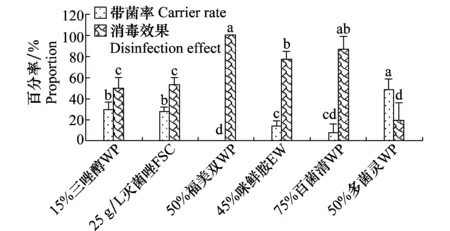
图2 供试杀菌剂对带菌青稞种子的消毒效果Fig.2 Effect of experimental fungicides on hullessbarley seed disinfection
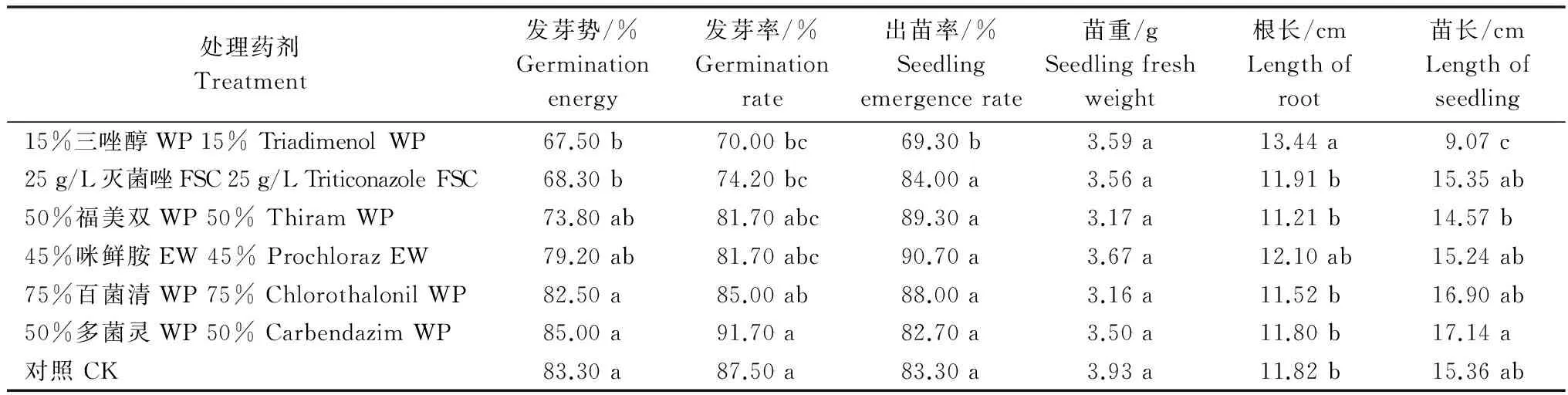
处理药剂Treatment发芽势/%Germinationenergy发芽率/%Germinationrate出苗率/%Seedlingemergencerate苗重/gSeedlingfreshweight根长/cmLengthofroot苗长/cmLengthofseedling15%三唑醇WP15%TriadimenolWP67.50b70.00bc69.30b3.59a13.44a9.07c25g/L灭菌唑FSC25g/LTriticonazoleFSC68.30b74.20bc84.00a3.56a11.91b15.35ab50%福美双WP50%ThiramWP73.80ab81.70abc89.30a3.17a11.21b14.57b45%咪鲜胺EW45%ProchlorazEW79.20ab81.70abc90.70a3.67a12.10ab15.24ab75%百菌清WP75%ChlorothalonilWP82.50a85.00ab88.00a3.16a11.52b16.90ab50%多菌灵WP50%CarbendazimWP85.00a91.70a82.70a3.50a11.80b17.14a对照CK83.30a87.50a83.30a3.93a11.82b15.36ab
3 结论与讨论
3.1结论
(1) 供试青稞种子表面携带的优势菌群为青霉和镰刀菌,种子内部寄藏真菌主要为镰刀菌、核腔菌、附球菌、丝核菌和链格孢;不同品种种子表面携带及内部寄藏的真菌种类差异较大,‘云青1号’和‘云青2号’两个品种携带真菌较少,‘短白青稞’携带真菌较多。
(2) 青稞种子内寄藏的镰刀菌对种子影响最大,显著抑制种子萌发和幼苗生长,造成后期幼苗坏死。
(3) 45%咪鲜胺EW、75%百菌清WP、50%福美双WP对青稞种子消毒效果显著,其中50%福美双WP的消毒效果达100%。试验设计的剂量范围内,三种杀菌剂处理对青稞种子发芽和幼苗生长安全。
3.2讨论
(1) 青稞种子健康状况:各种真菌的寄生或腐生可降低来年种子的发芽和出苗率,易引起种传病害的发生,造成青稞品质下降。本研究对云南迪庆3个主栽青稞品种进行种子带菌检测,结果表明3个品种种子内外部携带真菌种类有较大差异,青稞品种与种子内外部带菌率有明显的关系,‘短白青稞’种子内外部携带大量的真菌,‘云青1号’和 ‘云青2号’种子携带的真菌较少。‘短白青稞’种子表面携带的优势菌群为镰刀菌(Fusariumspp.),内部寄藏真菌种类及数量较多,优势菌群主要为镰刀菌属、核腔菌属、附球菌属真菌。而‘云青1号’和‘云青2号’种子外部除分离到青霉外未分离到其他真菌,同时种子内部分离到的真菌也较少。龚弘强等[21]随机选取拉萨地区尼木县、林周县青稞种子,对其籽粒真菌区系进行分析,表明优势菌群为枝孢霉(Cladosporiumspp.)、链格孢(Alternariaspp.)和茎点霉(Phomaspp.),这与本研究的结果有一定差别,原因可能是受气候环境、耕种方式等因素影响,不同来源的种子抗病性、携带的真菌种类差别较大[22]。
不同的分离方法分离获得的真菌种类有差异。本研究采用PDA平板法和洗涤法检测了云南迪庆3个主栽青稞品种种子内外部带菌情况,未对青稞种子各部位的带菌情况进行研究,还需要结合其他分离方法如滤纸保湿法[23]综合分析种子各个部位的带菌情况[24],同时进行种子消毒处理时应更加合理地有针对性用药[25]。
(2) 杀菌剂对青稞种子的消毒效果及对种子发芽出苗的影响:致病性测定结果表明,镰刀菌对种子的活力影响最大,可显著抑制种子的萌发生长,这与前人对大豆种子寄藏真菌Fusariumspp.显著影响大豆种子发芽和生长的研究结果相似[26]。6种杀菌剂对‘短白青稞’种子均有一定的消毒作用,其中50%福美双WP、75%百菌清WP和45%咪鲜胺EW对种子消毒效果显著优于其他3种杀菌剂,与杀菌剂对水稻种子消毒处理的研究结果一致[7]。福美双和百菌清属于保护性杀菌剂,咪鲜胺为广谱内吸性杀菌剂,对核腔菌及镰刀菌具有较好的抑制作用[27],这3种药剂都广泛用于种子处理,能够有效地预防病害的发生。45%咪鲜胺EW、75%百菌清WP、50%多菌灵WP、50%福美双WP 4种药剂对‘短白青稞’种子进行拌种或浸种对种子发芽率和发芽势以及各项生长活力测定指标无显著影响,其中在供试浓度下,45%咪鲜胺EW、75%百菌清WP、50%福美双WP对种子的出苗率均有一定的促进作用。15%三唑醇WP、25 g/L灭菌唑FSC对青稞出苗及茎的生长具有明显的抑制作用,但能够显著促进根的生长,这与前人关于三唑类药剂对种子发芽和生长具有抑制作用的研究结果一致[28-29]。但由于灭菌唑和三唑醇对麦类种传病害具有良好的防治效果,因此需要进一步改善这两种药剂的拌种或浸种方法和用量。45%咪鲜胺EW、75%百菌清WP、50%福美双WP对青稞种子出苗及生长与对照相比均没有显著差异,同时这3种药剂的消毒效果都达到75%以上,可作为青稞生产上的拌种药剂。
本研究按照6种供试杀菌剂的常规拌种剂量进行了青稞种子带菌消毒效果和安全性初步试验,可为青稞种子的健康保护和生产中种苗病害的防控提供参考依据。杀菌剂的质量浓度及浸种或拌种时间可能显著影响消毒效果及种子发芽生长[30],这方面的工作有待深入研究。
[1]马得泉.中国西藏大麦遗传资源[M].北京: 中国农业出版社, 2000.
[2]何苏琴,王三喜, 赵桂琴, 等. 燕麦和青稞的一种新病害—鞘腐病[J].甘肃农业科技, 2010(10): 3-4.
[3]姚晓华, 吴昆仑. PEG预处理对青稞种子萌发, 幼苗生长和抗旱性的影响[J].中国农业大学学报, 2013,18(6): 80-87.
[4]洛桑旦达, 强小林. 青稞特有营养成分分析与开发利用现状调查研究报告[J].西藏科技, 2001(8): 55-64.
[5]李晓忠, 顿珠次仁,王惠文. 西藏麦作种传病害的组成及其发生特点[J].云南农业大学学报, 1995,10(2):116-119.
[6]栾运芳, 何燕. 西藏青稞品质改良的趋势及对策[J].大麦科学, 2004(2):1-4.
[7]刘西莉, 李健强, 朱春雨, 等. 不同水稻品种种子带菌检测及药剂消毒处理效果[J].中国农业大学学报, 2000,5(5): 42-47.
[8]尼尔高. 种子病理学[M].狄原渤, 等,译. 北京: 农业出版社, 1987.
[9]Niaz I, Dawar S. Detection of seed borne mycoflora in maize (ZeamaysL.)[J].Pakistan Journal of Botany, 2009, 41(1): 443-451.
[10]Sultana N, Ghaffar A. Seed borne fungi associated with bottle gourdLagenariasiceraria(Mol.) Standl.[J].Pakistan Journal of Botany, 2009, 41(1): 435-442.
[11]Butt A R, Yaseen S I, Javaid A. Seed-borne mycoflora of stored rice grains and its chemical control [J].Journal of Animal and Plant Sciences, 2011,21(2):193-196.
[12]国际种子检验协会. 1996国际种子检验规程[M].农业部全国农作物种子质量监督检测中心,浙江大学种子科学中心,译. 北京: 中国农业出版社, 1996.
[13]刘博, 傅俊范, 周如军, 等. 辽宁五味子种子带菌检测及药剂消毒处理研究[J].植物保护, 2008, 34(6):95-98.
[14]陈焘, 南志标. 不同储存年限老芒麦种子种带真菌检测及致病性测定[J].草业学报, 2015, 24(2):96-103.
[15]魏景超. 真菌鉴定手册[M].上海: 上海科学技术出版社, 1979.
[16]Graham G C, Mayers P, Henry R J. A simplified method for the preparation of fungal genomic DNA for PCR and RAPD analysis [J].Biotechniques, 1994, 16(1): 48-50.
[17]Ros-Chumillas M, Egea-Cortines M, Lopez-Gomez A, et al. Evaluation of a rapid DNA extraction method to detect yeast cells by PCR in orange juice [J].Food Control, 2007, 18(1): 33-39.
[18]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[19]Altier N A,Thies J A. Identification of resistance toPhythiumseedling diseases in alfalfa using a culture plate method [J].Plant Disease,1995,79(4):341-346.
[20]龚月娟,李健强.五种牧草及三种草坪草种子寄藏真菌检测初探[J].草业学报,2004,13(5):116-120.
[21]龚弘强,何立新,黄丽丽,等.拉萨地区青稞籽粒真菌区系分析[J].西南农业学报,2007,20(1):63-66.
[22]韩玉竹,赵建军,黄智宁.苦荬菜种子携带真菌与种子活力关系分析[J].中国农学通报,2011,27(14):31-34.
[23]Nasreen Sultana. Seed health testing of cucumber (CucumissativusL.)[J].Pakistan Journal of Scientific and Industrial Research,2000,43(2):127-129.
[24]Dutta B,Vernaiz M A C,Castro-Sparks A C,et al. Location ofAcidovoraxcitrulliin watermelon seeds affects efficiency of pathogen detection by seed health testing [J].Seed Science and Technology,2012,40(3):309-319.
[25]李小林,谷安宇,张馨宇,等.水稻种子寄藏真菌的3种检测方法对比研究[J].中国农业大学学报,2011,16(6):43-51.
[26]Mahmoud S Y M, Hosseny M H, EL-Shaikh K A A, et al. Seed borne fungal pathogens associated with common bean (PhaseolusvulgarisL.) seeds and their impact on germination[J].Journal of Environmental Studies,2013,11:19-26.
[27]姚凤兰.咪鲜胺防治花生褐斑病田间试验[J].农药,1999,38(6):28-29.
[28]邢光耀.三唑酮和苯醚甲环唑拌种对小麦出苗的影响[J].种子科技, 2008,26(1):44-45.
[29]潘以楼,吴汉章.三唑类药剂拌种对小麦种子发芽,出苗的影响及其机制初探[J].农药,1992,31(4):50-51.
[30]谷思辰,李倩,焦培培,等.杀菌剂对胡杨和灰叶胡杨种子的消毒效果及对种子萌发生长的影响[J].西北农林科技大学学报(自然科学版),2013,41(5):99-107.
(责任编辑:杨明丽)
Testing of seed-borne fungi of hullessbarley and disinfection effect of six kinds of fungicides
Kuang Weigang1,Si Hongbing2,Luo Laixin1,Zhang Zhiping1,Li Yingbin1,Li Jianqiang1
(1.Department of Plant Pathology, Beijing Engineering Research Center of Seed and Plant Health, China Agricultural University, Beijing100193, China; 2.Plant Protection Station of Diqing, Yunnan674400, China)
The dominant seed-borne fungi were detected from three major hullessbarley varieties ‘Yunqing 1’, ‘Yunqing 2’ and ‘Short-white barley’ from Diqing Tibetan Autonomous Prefecture by petri-dish testing method, and the disinfection effects of six fungicides and growth of the seeds were also investigated after seeds treatment. The results showed thatFusariumspp. andPenicilliumspp. were the main pathogens on the surface of hullessbarley seeds,Fusariumspp.,Trichodermaspp. andEpicoccumspp.,Rhizoctoniaspp.,Alternariaspp. andTrichodermaspp. represented main pathogens inside. The fungi isolated from the external surface and interior of seeds expressed significantly difference among the tested varieties. Seeds growth were severely affected byFusariumspp.. 45% prochloraz EW, 75% chlorothalonil WP and 50% thiram WP had good control effects on seed-borne fungi. The disinfection effect of 50% thiram WP was up to 100%, much better than that of other fungicides. 45% prochloraz EW, 75% chlorothalonil WP and 50% thiram WP treatment had no significant effect on seed germination and seedling growth of hullessbarley.
hullessbarley;seed-borne fungi;seed testing;fungicides;disinfection effect
2015-06-13
2015-08-03
国家少数民族科技骨干特殊培养专项
E-mail: lijq231@cau.edu.cn
S 435.1
B
10.3969/j.issn.0529-1542.2016.04.037
Technology & Application
