湖南省永州地区柑橘慢衰病与黄龙病病原鉴定及分布调查
2016-09-14宋志强成飞雪程菊娥张德咏何代进
宋志强, 成飞雪, 程菊娥, 张德咏, 何代进, 刘 勇*
(1. 湖南农业大学植物保护学院, 长沙 410128; 2. 湖南省农业科学院植物保护研究所, 园艺作物病虫害综合治理湖南省重点实验室, 长沙 410125; 3. 湖南生物机电职业技术学院, 长沙 410127)
湖南省永州地区柑橘慢衰病与黄龙病病原鉴定及分布调查
宋志强1,2,成飞雪2,程菊娥2,张德咏1,2,何代进3,刘勇1,2*
(1. 湖南农业大学植物保护学院, 长沙410128; 2. 湖南省农业科学院植物保护研究所, 园艺作物病虫害综合治理湖南省重点实验室, 长沙410125; 3. 湖南生物机电职业技术学院, 长沙410127)
为明确湖南省柑橘黄化症状与柑橘慢衰病和柑橘黄龙病的相关性,应用形态学和分子生物学方法对湖南省永州地区表现黄化症状的柑橘进行了两种病原的鉴定及分布调查。结果表明,造成该地区柑橘黄化现象的主要原因为柑橘半穿刺线虫和黄龙病菌对柑橘的侵染。所检样本中,柑橘慢衰病平均发生率为82.1%,土壤中的半穿刺线虫群体密度最高达到3 077条/100 mL。永州地区柑橘黄龙病病菌属于韧皮部杆菌属类细菌亚洲种,平均检出率为64.3%。柑橘半穿刺线虫和黄龙病菌在柑橘园存在混合侵染现象,混合侵染率为53.6%。柑橘半穿刺线虫在永州地区柑橘产区分布广泛,是造成柑橘黄化症状的重要病因,重视并有效防控柑橘半穿刺线虫已迫在眉睫。
柑橘慢衰病;柑橘黄龙病;柑橘半穿刺线虫;病原鉴定;分布调查
柑橘半穿刺线虫(Tylenchulussemipenetrans)引起的柑橘慢衰病(citrus slow decline disease)是柑橘上最重要的病害之一,广泛分布于全世界柑橘产区,造成极大的经济损失[1]。柑橘半穿刺线虫是一种专化性强的定居型半内寄生线虫,能够寄生50多种柑橘品种及其杂交种,也可在葡萄、草莓、荔枝、苹果、柿、杉木等植物上繁殖[2-3]。柑橘被侵染后活力减退,叶片褪绿黄化,长势衰弱似缺肥、缺水、生长不良症状,严重时叶片脱落,果实变小,甚至枯死[4]。此外,柑橘半穿刺线虫侵染柑橘根部造成的伤口有利于真菌、细菌等病原物的入侵,加重对柑橘的危害[5]。柑橘受害后一般减产30%~50%,严重时达100%[6];福建省5个重要柑橘产区柑橘半穿刺线虫果园发病率为74.6%,果园株发病率为5%~100%[7]。
柑橘黄龙病(citrus Huanglongbing,HLB)是世界柑橘生产中的一种极具毁灭性的病害,其病原为韧皮部杆菌属类细菌(CandidatusLiberibacter spp.),根据病原对热的敏感性、传播媒介和地理分布,可分为亚洲种(Ca. L. asiaticus)、非洲种(Ca. L. africanus)和美洲种(Ca. L. americanus)[8-9]。目前在我国仅发现亚洲种,在田间主要通过柑橘木虱(Diaphorinacitri)传播,还可借助嫁接、菟丝子传播。田间典型症状为叶片斑驳型黄化、均匀型黄化及缺素性黄化,果实呈“红鼻果”或“斜肩果”,一般会造成30%~100%的产量损失[10];我国广西柑橘黄龙病年平均发生率超过5%,每年造成的直接经济损失超过8.05亿~9.62亿元[11]。
湖南省是全国柑橘主产区之一,面积、产量、产值均稳居全国第一。近年来,湖南省特别是永州地区柑橘黄化衰退现象日趋严重,极大地威胁了柑橘产业的发展。由于柑橘慢衰病及黄龙病都会引起柑橘出现黄化症状,在多数情况下,柑橘慢衰病所表现的黄化症状常被基层误诊为柑橘黄龙病,造成防控措施不当,防治效果低下,而进行抛荒、砍伐或挖除,给柑橘产业造成了巨大的经济损失。福建省长泰县因将柑橘慢衰病误诊为黄龙病,每年挖除的病树约占果树总数的10%[12]。因此,准确了解造成柑橘黄化现象的病因,对其防控具有极其重要的意义。本研究团队于2014-2015年对湖南省永州地区表现黄化症状的柑橘进行了柑橘半穿刺线虫和黄龙病病原鉴定及分布调查,以期为柑橘慢衰病和黄龙病的有效防控提供科学指导。
1 材料与方法
1.1样品采集
2014年6月-2015年11月对湖南省永州市冷水滩区、零陵区、道县和江永县柑橘园中表现黄化症状的柑橘进行了取样调查。采用五点取样法分别采集柑橘植株的叶片、根系及根际土壤,进行柑橘慢衰病和柑橘黄龙病病原检测。
1.2柑橘半穿刺线虫形态学鉴定
柑橘慢衰病最主要的诊断方法是鉴定柑橘根系及根际土壤中是否存在柑橘半穿刺线虫。柑橘根组织中的雌虫在体视显微镜下用细解剖针直接剥离;土壤中2龄幼虫和雄虫采用浅盘法分离。将雌虫以及分离获得的2龄幼虫和雄虫经缓慢加热杀死后用TAF固定液固定,制成临时玻片,于光学显微镜下进行形态观察、拍照。采用de Man公式进行形态测计,其中:n=样本数;L=体长;Stylet=口针长;Tail=尾长;Spicule=交合刺长度;a=体长/最大体宽;b=体长/头端至食道与肠连接处的距离;c=体长/尾长;c'=尾长/肛门或泄殖腔处体宽;V=阴门至头端的距离/体长×100;DGO=背食道腺开口至口针基部球的距离。
1.3柑橘半穿刺线虫分子生物学鉴定
1.3.1柑橘半穿刺线虫DNA提取
单条线虫DNA的提取参照王江岭等的方法并稍作修改[13]。挑取单条线虫放入含有8 μL ddH2O和1 μL 10×PCR buffer (Mg2+free)的200 μL PCR管中,放入液氮中冷冻1 min,置于95℃下2 min,重复5次;向PCR管中加入1 μL 1 mg/mL蛋白酶K,65℃温育15 min,95℃反应10 min,获得的DNA提取液直接进行PCR扩增。
1.3.2柑橘半穿刺线虫PCR检测
分别以柑橘半穿刺线虫的雌虫、雄虫和2龄幼虫的DNA为模板,采用Liu等报道的特异性引物Ts-SF(5′-TACCAGGTTGAGCAGAGTTCTT-3′)和Ts-SR(5′-TCCTACCCTTCCA CAGCG-3′)进行PCR扩增[14],片段大小为297 bp。PCR反应体系为25 μL:10×EasyTaqbuffer 3 μL,2.5 mmol/L dNTPs 2 μL,10 μmol/L正反向引物各1 μL,5 U/μLEasyTaqDNA polymerase 0.5 μL,模板DNA 5 μL,补足ddH2O至25 μL。反应程序:94℃预变性4 min;94℃变性30 s,59℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸5 min。PCR扩增结束后,取5 μL扩增产物于1.5%琼脂糖凝胶中电泳。
1.4土壤中柑橘半穿刺线虫群体密度调查
将采集的柑橘土壤样品充分混匀后,分别取100 mL,采用浅盘法分离土壤样品中的2龄幼虫,在倒置显微镜下统计柑橘半穿刺线虫2龄幼虫的数量。每样品重复3次,计算每100 mL土壤样品中的柑橘半穿刺线虫群体密度。
1.5柑橘黄龙病分子生物学检测
以黄梢或叶片黄化作为田间诊断柑橘黄龙病依据的同时,采用分子生物学技术对其进行准确诊断。采用CTAB法提取柑橘叶脉总DNA。参照Hocquellet等报道的柑橘黄龙病菌特异性引物A2(5′-TATAAAGGTTGACCTTTCGAGTTT-3′)和J5(5′-ACAAAAGCAGAAATAGCACGAACAA-3′)进行PCR扩增[15],亚洲种和非洲种片段大小分别为703 bp和669 bp。PCR反应体系为25 μL:10×EasyTaq buffer 3 μL,2.5 mmol/L dNTPs 2 μL,10 μmol/L正反向引物各1 μL,5 U/μL EasyTaq DNA polymerase 0.5 μL,DNA模板1 μL,补足ddH2O至25 μL。反应程序:94℃预变性4 min;94℃变性30 s,62℃退火30 s,72℃延伸1 min,共35个循环;72℃延伸10 min。PCR扩增产物于1.0%琼脂糖凝胶中电泳分析,然后将PCR产物回收、转化、克隆并送至生工生物工程(上海)股份有限公司测序。将获得的序列与GenBank核酸数据库中已知序列进行同源性比较。
2 结果与分析
2.1柑橘半穿刺线虫形态鉴定
2.1.1测计值
雌虫:n=20;L=379.2(350.1~410.5)μm;a=4.7(4.0~5.3);b=3.0(2.7~3.4);V=90.1(87.3~93.0);Stylet=12.1(10.5~13.3)μm。
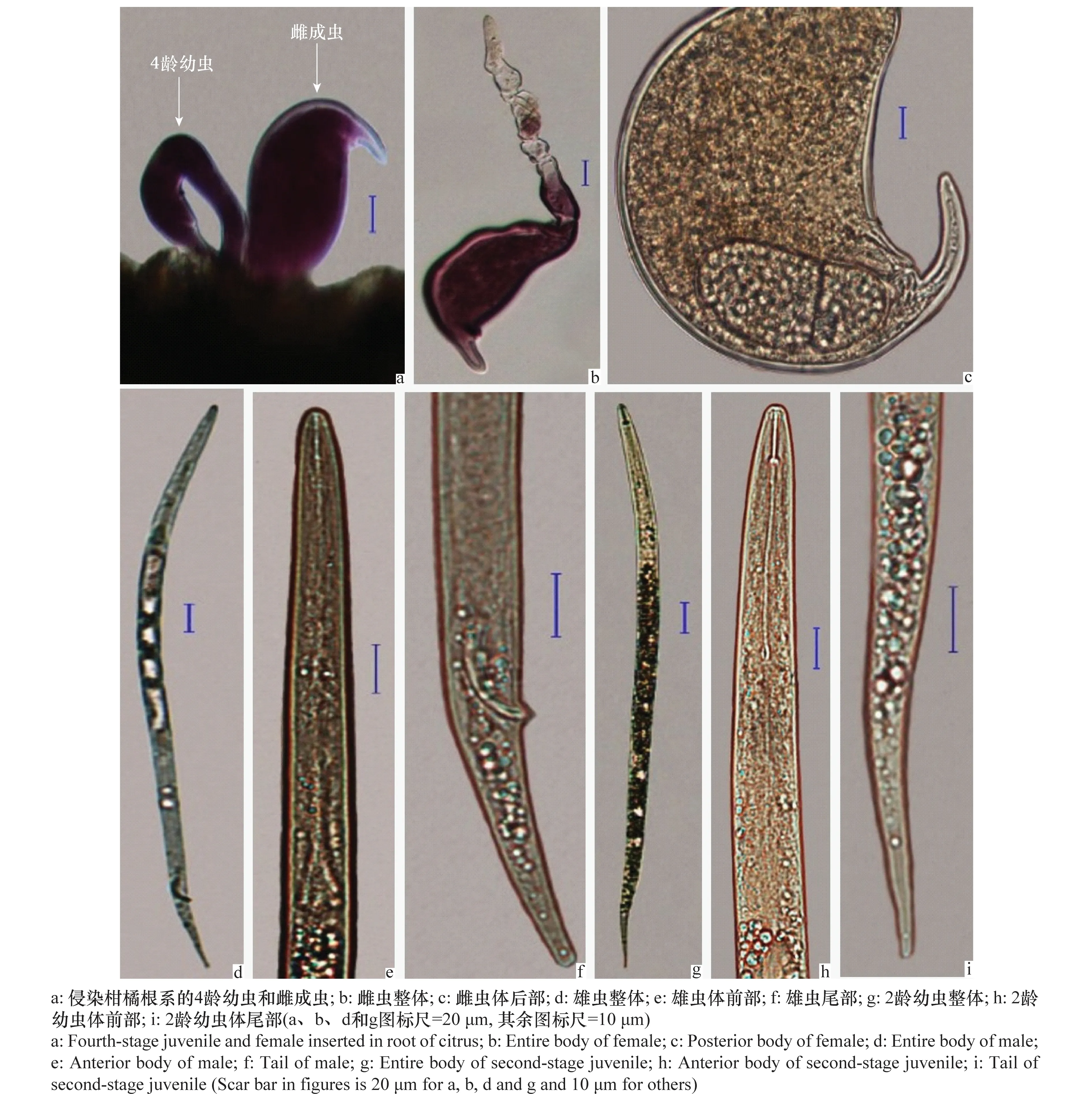
图1 柑橘半穿刺线虫的形态特征图Fig.1 Morphological characters of Tylenchulus semipenetrans
雄虫:n=20;L=360.0(317.9~410.1)μm;a=33.9(29.2~45.6);b=3.2(2.9~3.5);c=8.7(7.7~10.1);c'=4.9(4.0~5.6);Stylet=10.2(9.4~11.1)μm;Spicule=19.1(16.8~21.5)μm;DGO=6.0(5.2~6.9)μm。
2龄幼虫:n=20;L=379.6(337.1~414.5)μm;b=3.4(3.1~3.7);Stylet=13.8(13.0~14.7)μm。
2.1.2形态描述
雌虫:成熟雌虫与雄虫异型,虫体前部潜入根组织内,后部外露于根表面,膨大呈囊状(图1a)。头部骨化弱,口针中等发达,基部球大而圆(图1b)。具两个弯曲的卵巢,阴门向腹面斜裂,近尾端,产卵于胶质卵囊中。排泄孔位于阴门前,无直肠和肛门。尾端有一指形突起(图1c)。
雄虫:虫体蠕虫形,纤细(图1d)。唇区圆形。口针纤细,有基部球。食道细长,中食道球退化,食道腺呈洋梨形,与肠交界明显(图1e)。交合刺细,无交合伞。尾圆锥形,末端稍钝(图1f)。
2龄幼虫:虫体蠕虫形(图1g)。头部骨质化,口针较发达,有基部球。中食道球大,食道腺与肠基本平接或略覆盖肠(图1h)。尾渐细,末端钝圆(图1i)。
2.2柑橘半穿刺线虫分子生物学鉴定
利用柑橘半穿刺线虫特异性引物分别对雌虫、雄虫和2龄幼虫的DNA进行PCR扩增,结果显示,雌虫、雄虫和2龄幼虫均扩增出297 bp大小的特异性片段(图2),表明分离得到的线虫为柑橘半穿刺线虫,其结果与形态学鉴定结果一致。
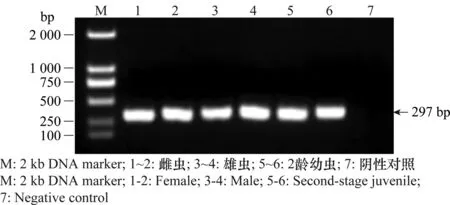
图2 不同龄期柑橘半穿刺线虫PCR产物Fig.2 PCR products amplified from Tylenchulus semipenetrans at different developmental stages using the species-specific primers
2.3柑橘黄龙病病菌检测
利用柑橘黄龙病菌特异性引物A2和J5对采集的28份样品的叶脉DNA进行PCR扩增,结果显示,共有18份样品扩增出一条703 bp的特异性条带,而阴性对照未扩增出相应的条带(图3)。所得序列与GenBank公布的柑橘黄龙病菌亚洲种序列(CP004005.1和CP001677.5等)同源性为100%。
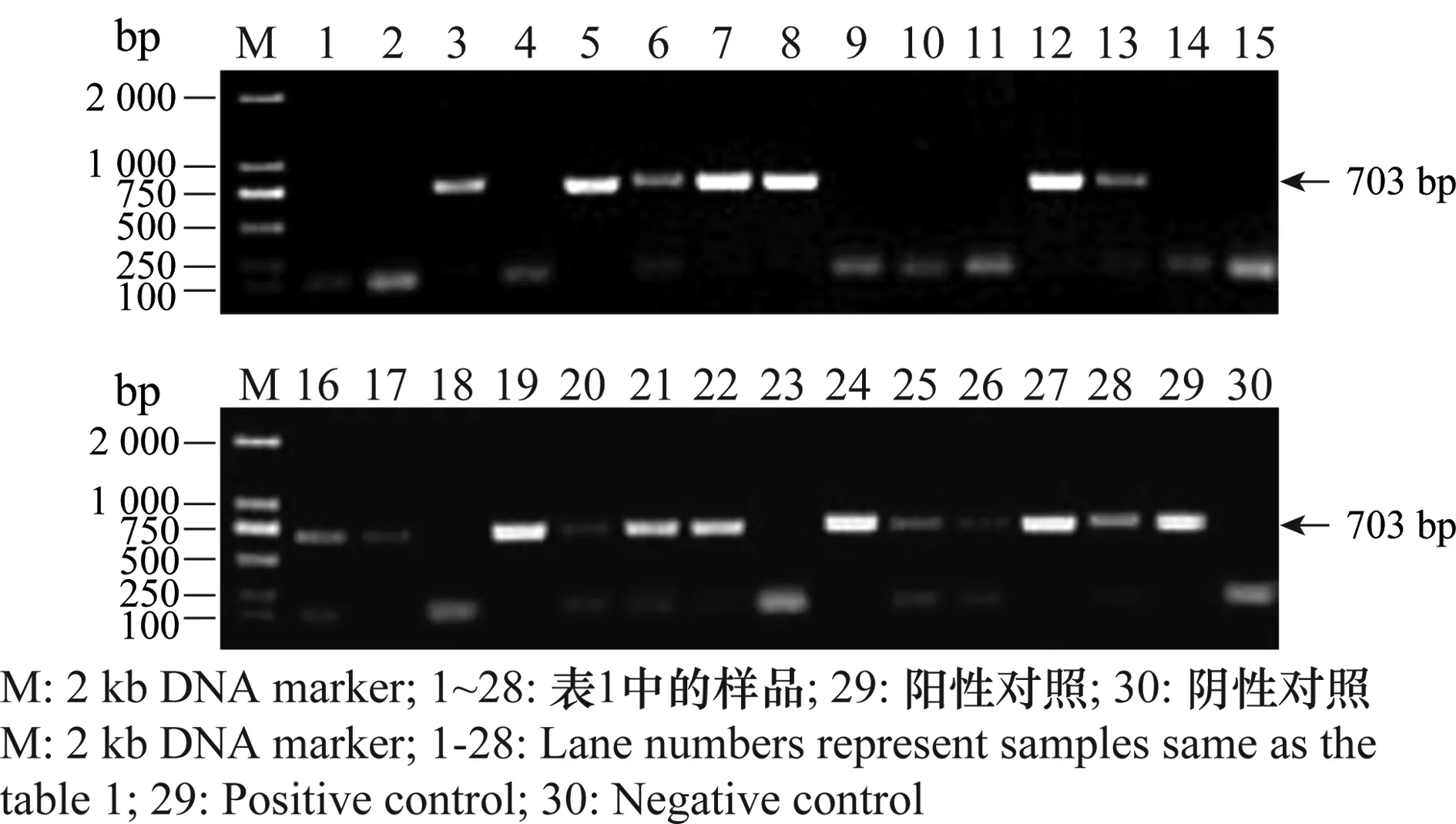
图3 利用特异性引物A2和J5检测湖南永州地区柑橘样品中的柑橘黄龙病菌Fig.3 Electrophoresis of PCR products of HLB pathogen from Yongzhou City, Hunan Province,using primers A2 and J5
2.4柑橘半穿刺线虫和柑橘黄龙病分布
在所采集的28份柑橘土壤样品中,有24份样品检出了柑橘半穿刺线虫,冷水滩区、零陵区、道县和江永县均有柑橘半穿刺线虫的分布,平均发生率为82.1%,土壤中的线虫群体密度最高达到3 077条/100 mL,冷水滩区和零陵区发生率较高,均为100%,其次是江永县,发生率为91.7%,而道县发生率相对较低,为20%(表1)。
从表1中可以看出,永州地区所采集的柑橘叶片样品中,柑橘黄龙病的平均检出率为64.3%,其中江永县检出率最高,为83.3%,道县、零陵区和冷水滩区检出率分别为60.0%、57.1%和25.0%,所检测到的18个柑橘黄龙病分离物均为韧皮部杆菌属类细菌亚洲种。
3 结论与讨论
目前,已在我国湖南、湖北、广东、广西、福建等15个省(市、自治区)的柑橘产区中发现有柑橘半穿刺线虫的分布和危害[3,16]。由于柑橘半穿刺线虫在柑橘根部侵染危害,虫体细小,无法用肉眼观察到,虽发生普遍,危害严重,但其引起的柑橘慢衰病在柑橘生产中却得不到重视,基层技术人员和种植户基本不认识或不了解该病害,所表现的黄化症状常被误诊为柑橘黄龙病,而进行抛荒、砍伐或挖除,造成重大经济损失。本研究利用形态学和分子生物学相结合的方法,明确了湖南省永州地区柑橘主要病原线虫为柑橘半穿刺线虫,平均发生率为82.1%,其中冷水滩区、零陵区和江永县发生率比较高,土壤中的线虫群体密度最高达到3 077条/100 mL,表明柑橘半穿刺线虫在永州地区柑橘产区发生普遍且严重,是引起柑橘黄化症状的重要病因之一。
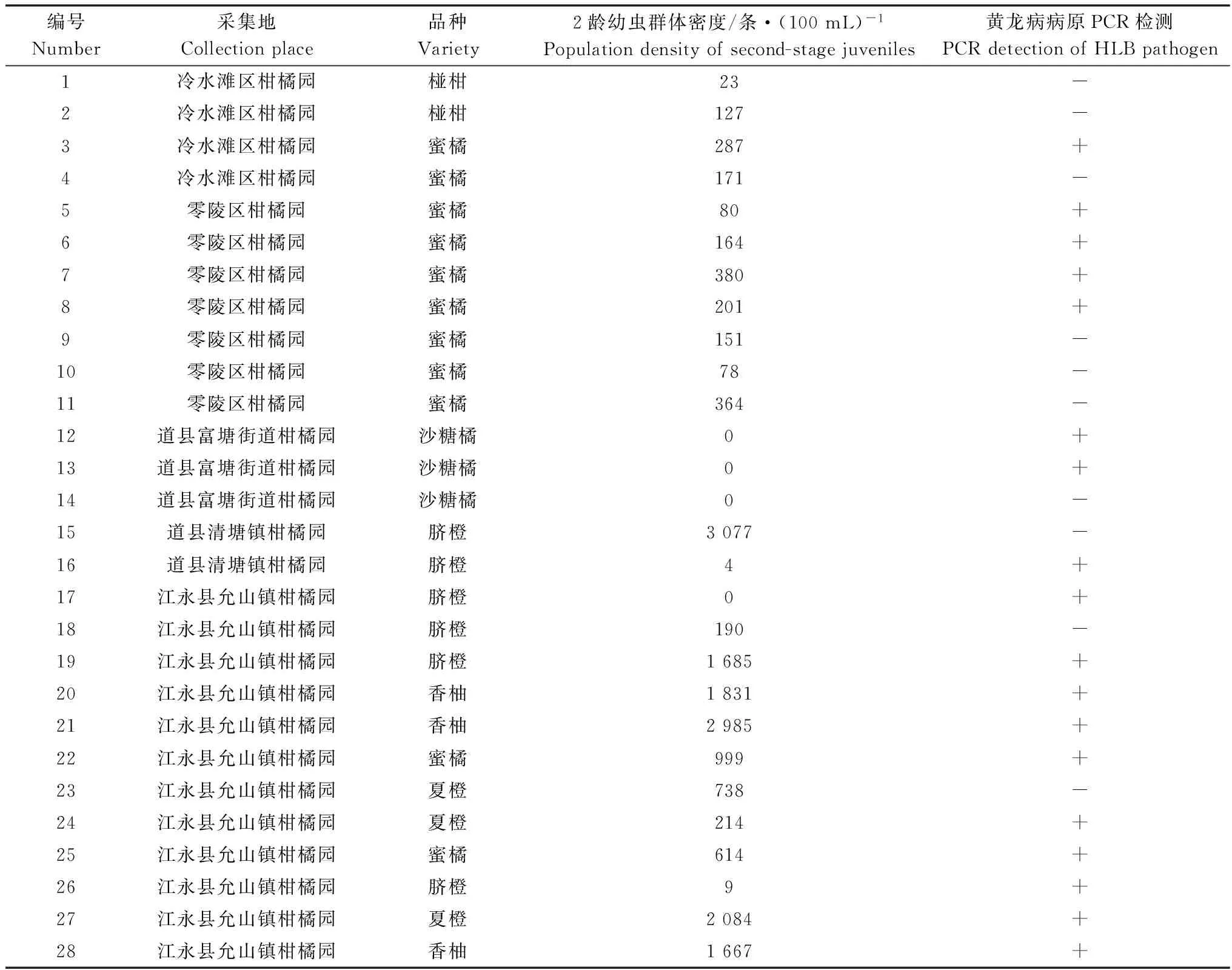
表1 采集样品中柑橘半穿刺线虫2龄幼虫群体密度及黄龙病病菌检测1)
1) “+”and “-”分别代表阳性和阴性结果。
"+"and "-" represent positive and negative results, respectively.
柑橘黄龙病于1919年在我国广东省潮汕地区首次被发现[17],目前已有11个省(市、自治区)的柑橘产区遭受其危害,受害面积占柑橘种植总面积的80%以上[18]。本研究利用分子生物学方法对永州地区疑似柑橘黄龙病植株进行了检测,结果表明所有表现黄化症状的柑橘样品中仅有64.3%的样品检测结果呈现阳性,说明表现黄化症状的柑橘植株不一定都带有黄龙病病菌。
造成柑橘黄化症状的病因有多种,主要包括柑橘黄龙病、柑橘线虫病、柑橘病毒病和生理性病害等,单凭柑橘的田间黄化症状不易正确诊断出其病因。所以,正确快速地诊断出柑橘黄化症的病因是有效控制病害危害和蔓延的基础。本研究通过对表现黄化症状的柑橘调查取样和检测发现,柑橘慢衰病和柑橘黄龙病在永州地区柑橘产区发生普遍且严重,并且存在着混合或复合侵染现象。因此,在重点防控柑橘黄龙病的同时,也应重视并有效控制柑橘半穿刺线虫的危害,从而保障柑橘生产安全,促进柑橘产业发展和增加农民收入。
[1]Ardakani A S, Mafi Z T, Hesar A M, et al. Relationship between soil properties and abundance ofTylenchulussemipenetransin citrus orchards, Kohgilouyeh va Boyerahmad Province[J].Journal of Agricultural Science and Technology, 2014, 16: 1699-1710.
[2]Irshad U, Mukhtar T, Ashfaq M, et al. Pathogenicity of citrus nematode (Tylenchulussemipenetrans) onCitrusjambhiri[J].The Journal of Animal & Plant Sciences, 2012, 22(4):1014-1018.
[3]张绍升. 植物线虫病害诊断与治理[M].福州: 福建科学技术出版社, 1999: 181-183.
[4]Verdejo-Lucas S, McKenry M V. Management of the citrus nematode,Tylenchulussemipenetrans[J].Journal of Nematology, 2004, 36(4): 424-432.
[5]Safdar A, Javed N, Khan S A, et al. Synergistic effect of a fungus,Fusariumsemitectum, and a nematode,Tylenchulussemipenetrans, on citrus decline [J].Pakistan Journal of Zoology, 2013, 45(3): 643-651.
[6]冯志新.植物线虫学[M].北京:中国农业出版社,2001:158-160.
[7]刘国坤, 张绍升, 潘东明, 等. 福建省柑橘半穿刺线虫的分布与为害[M]∥廖金铃, 彭德良, 段玉玺. 中国线虫学研究(第二卷). 北京: 中国农业科学技术出版社, 2008: 93-97.
[8]Murray R G, Schleifer K H. Taxonomic notes: a proposal for recording the properties of putative taxa of procaryotes [J].International Journal of Systematic Bacteriology, 1994, 44(1):174-176.
[9]Texeira D C, Ayres J, Kitajima E W, et al. First report of a Huanglongbing-like disease of citrus in Sao Paulo State, Brazil and association of a new Liberibacter species, “CandidatusLiberibacter americanus”, with the disease [J].Plant Disease, 2005, 89(1):107.
[10]Iftikhar Y, Rauf S, Shahzad U, et al. Huanglongbing: Pathogen detection system for integrated disease management—A review [J].Journal of the Saudi Society of Agricultural Sciences, 2016, 15(1):1-11.
[11]邓明学. 广西柑橘黄龙病危害现状、损失评估及控制对策[C]∥彭友良. 中国植物病理学会2006年学术年会论文集. 北京: 中国农业科学技术出版社, 2006: 393-397.
[12]刘国坤, 杨再福, 叶明珍, 等. 柑橘慢衰病诊断及其病原鉴定[J].福建农林大学学报(自然科学版), 2004, 33(4): 431-433.
[13]王江岭, 张建成, 顾建锋. 单条线虫DNA提取方法[J].植物检疫, 2011,25(2): 32-35.
[14]Liu Guokun, Chen Juan, Xiao Shun, et al. Development of species-specific PCR primers and sensitive detection of theTylenchulussemipenetransin China[J].Agricultural Sciences in China, 2011, 10(2): 252-258.
[15]Hocquellet A, Toorawa P, Bové J M, et al. Detection and identification of the twoCandidatusLiberibacter species associated with citrus Huanglongbing by PCR amplification of ribosomal protein genes of theβoperon[J].Molecular and Cellular Probes, 1999, 13(5): 373-379.
[16]刘维志.植物线虫志[M].北京:中国农业出版社,2003:547-549.
[17]Reinking O A. Diseases of economic plants in southern China[J].Philippine Agriculturist, 1919, 8(4):109-134.
[18]范国成, 刘波, 吴如健, 等. 中国柑橘黄龙病研究30年[J].福建农业学报, 2009, 24(2):183-190.
(责任编辑:杨明丽)
Identification and distribution survey of the pathogens of citrus slow decline disease and citrus Huanglongbing in Yongzhou City, Hunan Province
Song Zhiqiang1,2,Cheng Feixue2,Cheng Ju’e2,Zhang Deyong1,2,He Daijin3,Liu Yong1,2
(1. College of Plant Protection, Hunan Agricultural University, Changsha410128, China; 2. Hunan Key Laboratory of Integrated Management of the Pests and Diseases on Horticultural Crops, Institute of Plant Protection, Hunan Academy of Agricultural Sciences, Changsha410125, China; 3. Hunan Biological and Electromechanical Polytechnic, Changsha410127, China)
In order to determinate the correlation between etiolation symptoms of citrus in Hunan Province and citrus slow decline disease and citrus Huanglongbing (HLB), leaf, root and soil samples were collected from citrus with etiolation symptoms in Yongzhou City, Hunan Province and the identification and distribution survey of two pathogens were carried out based on morphological characteristics and molecular biology techniques. The results showed that the infection ofTylenchulussemipenetransand HLB pathogen were the main cause of etiolation phenomenon of citrus in this area. The average incidence rate ofT.semipenetransin collected samples was 82.1%. The highest population density of juveniles in samples was reached to 3 077 nematodes per 100 mL soil. The HLB pathogen isCandidatusLiberibacter asiaticus and the average detection rate was 64.3% in Yongzhou City. There were mixed infection ofT.semipenetransand HLB pathogen in citrus orchards and mixed infection rate was 53.6%.T.semipenetransis widely distributed in citrus growing regions of Yongzhou City, and it is the important cause of large range of etiolation symptoms of citrus. There is extremely urgent for paying attention to and effectively controllingT.semipenetrans.
citrus slow decline disease;citrus Huanglongbing;Tylenchulussemipenetrans;pathogen identification;distribution survey
2016-01-27
2016-02-29
湖南省研究生科研创新项目(CX2015B249);国家自然科学基金(31171826)
E-mail: haoasliu@163.com
S 436.66
A
10.3969/j.issn.0529-1542.2016.04.032
