山东泰安春秋季节大棚番茄根内根结线虫的发育及动态
2016-09-14吴海燕王振华
何 琼, 吴海燕*, 王振华
(1. 广西大学农学院, 南宁 530004; 2. 山东农业大学植物保护学院, 泰安 271018)
山东泰安春秋季节大棚番茄根内根结线虫的发育及动态
何琼1,吴海燕1*,王振华2
(1. 广西大学农学院, 南宁530004; 2. 山东农业大学植物保护学院, 泰安271018)
于2008年秋季和2009年春季对‘毛粉’和‘金丰盛世’2个番茄品种采用网袋法收集根系,酸性品红-次氯酸钠法染色,体视显微镜下检测,记录根内各龄期根结线虫数量和形成的根结数。结果表明,单位鲜根重线虫数量在2008年温度低时,随番茄生长有下降趋势,2009年春季温度升高时则上升,2个供试品种单位鲜根重线虫数无显著差异(P>0.05);2008年秋季J2到J3,J3到J4的发育时间均长于2009年,根部形成根结的数量变化趋势相同;当土壤平均温度为15℃时,根结线虫在番茄根内完成第1个世代需32 d,25℃时为24 d。
根结线虫;温度;发育;动态;番茄
根结线虫(Meloidogynespp.)是一类重要的植物寄生线虫,常造成严重的经济损失。近年来随着番茄保护地面积的扩大,根结线虫病成为番茄的主要病害,呈逐年上升趋势。据调查,山东寿光市80%的蔬菜大棚内有根结线虫发生,瓜类、茄果类蔬菜受害严重,产量损失可达30%~50%,已成为当前设施蔬菜生产的一大障碍[1]。根结线虫可引起真菌和细菌的复合侵染,诱发植物病害。国内外在根结线虫病的防治方面有较多的研究报道[2-5]。根结线虫在陕西一年发生4~5代[6],湖北一年5代[7],河南一年4代[8]。孔凡玉等[9]的研究表明,根结线虫在山东烟草种植区一年有2次侵染高峰,南方根结线虫在红麻根内一年完成4代[10]。已有研究表明,掌握土壤中根结线虫数量动态变化是了解根结线虫病及评价防治效果的基础[11],但未见有关根结线虫在番茄根部的发育及动态研究的报道。本研究选择两个不同时期,以番茄内根结线虫为研究对象,利用网袋法收集根系,酸性品红-次氯酸钠法染色,体视显微镜检测并记录根内各龄期线虫数量以及根部形成的根结数量,明确根结线虫的发育特点和规律,进而明确用药时间,减少药剂使用量,增加防治效果。
1 材料与方法
1.1试验地概况
试验在山东省泰安市山东农业大学温室大棚内进行。分别于2008年秋季(10月)和2009年春季(5月)对‘毛粉’(MF)和‘金丰盛世’(JFSS)2个供试品种根内根结线虫的发育进程及动态进行监测。2008年土壤中线虫2龄幼虫和卵的群体密度分别为1 189.0条/100 mL和238.2个/100 mL;2009年分别为102.4条/100 mL和28个/100 mL。
1.2试验设计与取样方法
根据苏崇森[12]的研究结果设计尼龙网袋,网孔直径0.18 mm,网袋直径15 cm,网袋高30 cm。为确保根系采集的完整性,将病土混合均匀装入网袋,大棚地面开30 cm沟,将装有病土的网袋嵌入沟内,周围覆盖土壤。育秧钵内育苗,出苗后1个月移栽到网袋中,待番茄苗长势稳定后取样。2008年于10月19日移栽,10月24日第1次取样,此后每隔4 d取样1次,12月8日最后1次取样,共取样12次。2009年于5月13日移栽,5月18日第1次取样,此后每隔4 d取样1次,7月1日最后1次取样,共取样12次。试验地正常除草管理,不施肥打药。取样时随机选3株长势相似的番茄植株,完整取出尼龙网袋,带回实验室备用。
1.3土壤温度和含水量测定
用曲管式地温计测定5 cm和10 cm土层的温度,分别于8:00、14:00和18:00读取,每4 d测定1次,每次选取5~8个点进行测定,取平均值作为各时间点的温度值,然后取3个时间点温度值的平均值作为各土层的温度。利用便携式TDR (Campbell Scientific Australia Pty. Ltd.)于每次取样时分别测定3个取样点的12 cm和20 cm土层的含水量,然后取平均值。
1.4番茄根内根结线虫及根结数的统计
将完整的番茄根系冲洗干净,统计根结的数量,称量番茄的鲜根重,参照刘维志[13]的方法进行根部线虫染色。在体视显微镜(Motic SMZ-168)下检查根内2龄幼虫(J2)、3龄幼虫(J3)、4龄幼虫(J4)和成熟雌虫的数量,再折算成单位鲜根重线虫数(number of nematodes per gram fresh root,Np),单位为条/g鲜根。采用DPS 3.01软件对数据进行统计分析。
2 结果与分析
2.1试验期间土壤温湿度变化
2008年试验期间5、10 cm 土层土壤平均温度分别为15.7和15.3℃,受气温影响,变化幅度分别为11.8~19.3℃ (5 cm)、12.5~17.4℃ (10 cm)。温室从11月15日开始供暖,移栽后24 d土壤温度逐渐上升。2009年土壤温度较2008年高,试验期间5 cm和10 cm土层平均温度分别为25.9和25.2℃,土层温度相对稳定,变幅分别为22.7~28.2℃ (5 cm)和22.7~27℃(10 cm)(图1)。
试验期间,12 cm的土壤湿度为17.33%~23.67%(2008年)和14.67%~24.67%(2009年);20 cm的湿度分别为20.67%~35%(2008年)和19.67%~30.33%(2009年)(图2),由于人为定期浇灌,两年试验期间土壤湿度无明显变化。
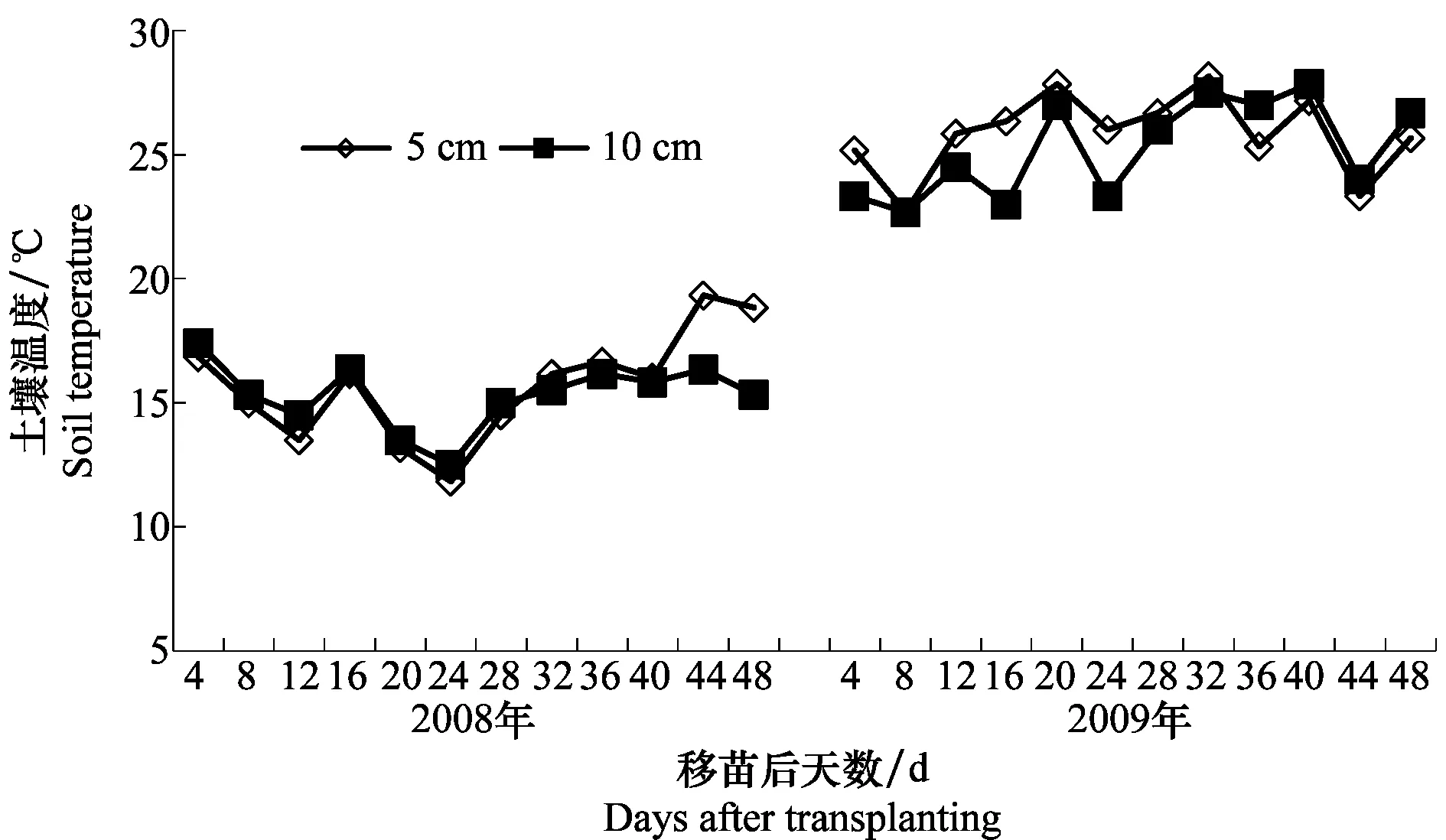
图1 2008年和2009年试验期间土壤5 cm和10 cm的平均温度Fig.1 Mean temperature at 5 and 10 cm soil layer after transplanting in 2008 and 2009
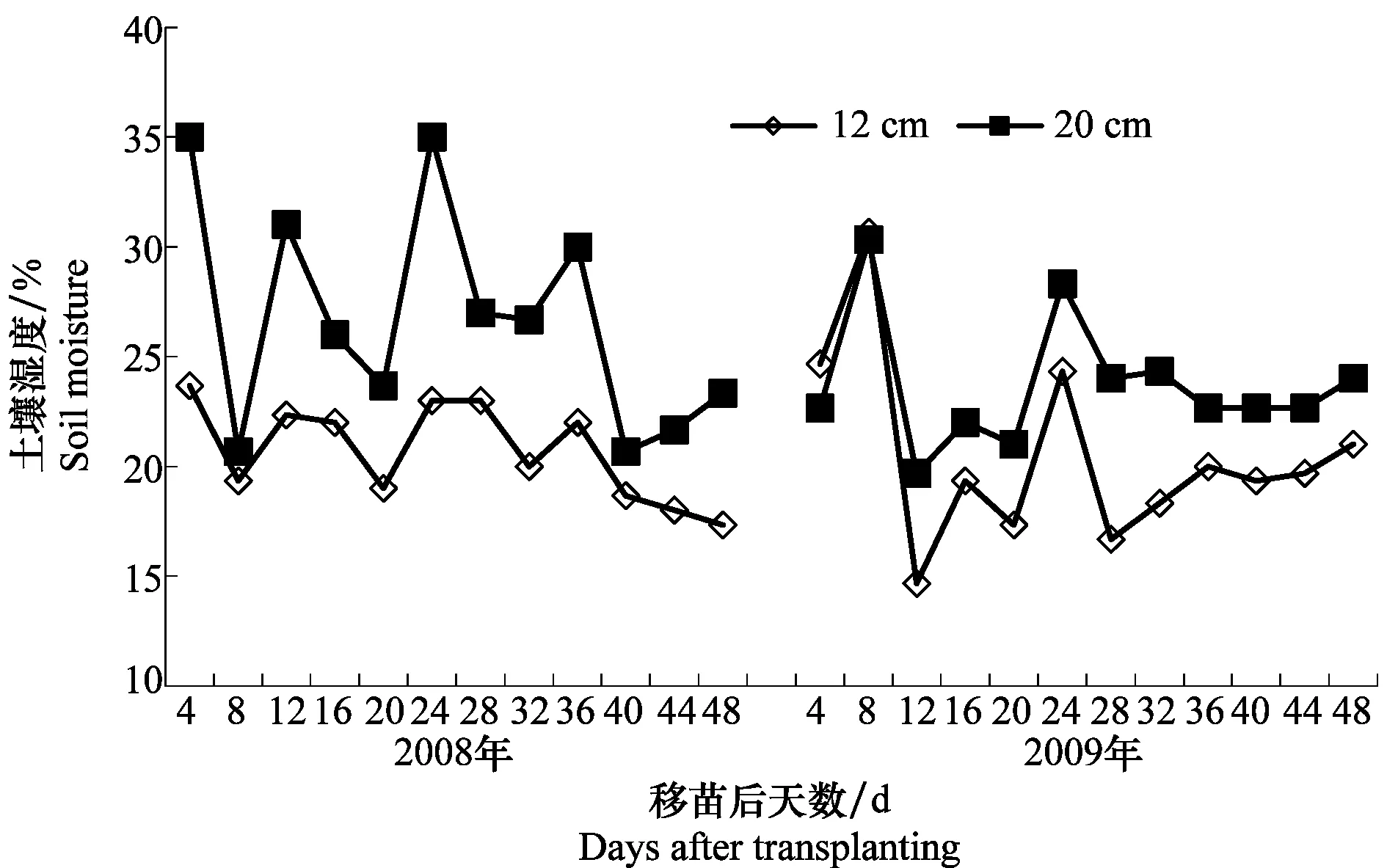
图2 2008年和2009年试验期间土壤12 cm和20 cm土壤的湿度Fig.2 Soil moisture at 12 and 20 cm soil depth after transplanting in 2008 and 2009
2.2番茄移栽后根内根结线虫总数的动态变化
两年试验表明,番茄移栽后,根结线虫2龄幼虫即开始快速侵入根系。2008年,由于土壤温度较低,随移栽后天数增加,2个供试番茄品种单位鲜根重线虫数逐渐减少。根内线虫数量最多出现在移栽后8 d,‘毛粉’和‘金丰盛世’的线虫数分别为662.6条/g鲜根和789.9条/g鲜根,随后逐渐下降。2009年土壤平均温度较高,侵入根内的线虫数量平缓上升。番茄移栽后,单位鲜根重线虫数随着时间的增加,呈现上升的趋势,但整个试验期间侵入线虫数量较少,明显小于2008年,其中‘毛粉’根内的线虫数于移栽后44 d达到最大值,为71.10条/g鲜根,‘金丰盛世’于移栽后36 d达到最大值,为66.97条/g鲜根(图3)。
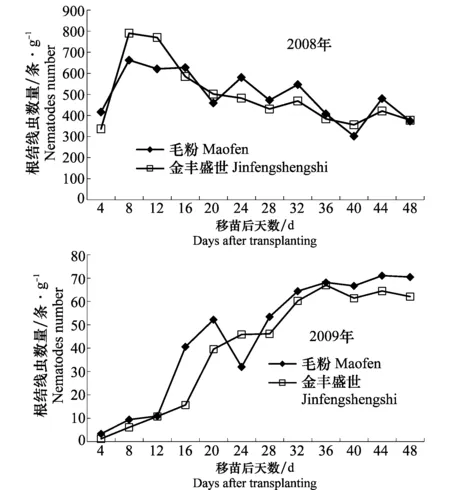
图3 2008年和2009年番茄移栽后根内线虫数量动态Fig.3 Dynamics of the number of total juveniles of Meloidogyne sp. per gram of fresh root after transplanting in 2008 and 2009
2.3番茄移栽后根内根结线虫的发育特点和进程
试验结果显示,两年试验温度条件下,根结线虫均能侵入移栽后的2个供试品种根内并顺利发育,移栽后4 d均可检测到J2(表1)。试验期间,番茄根内的线虫均以J2为优势虫态,2个品种根内不同龄期线虫动态无明显差异,且温度对线虫发育的影响较大。从各龄期线虫所占比例可知,初次侵染的线虫数量较大,线虫在根内发育的同时,还不断有J2侵入。2008年试验表明(图4a),在移栽后48 d内,2个番茄品种‘毛粉’和‘金丰盛世’根内J2所占比例分别为74.7%~100%和77.3%~100%,而J3和J4比例较小,‘毛粉’和‘金丰盛世’J3所占比例分别为5.6%~21.2%和2.9%~18.7%;J4比例分别为4.0%~8.9%和3.8%~12.1%,J3和J4的高峰分别出现在移栽后28 d和32 d。2009年根内各虫态百分比的变化趋势明显不同于2008年(图4b),J2的比例有下降的趋势,J3和J4有上升的趋势,‘毛粉’和‘金丰盛世’根内J2比例分别为41.8%~100%和45.3%~100%;J3比例分别为9.4%~46.0%和12.5%~40.6%;J4比例分别为4.14%~30.67%和5.32%~29.5%,J3和J4占的比例明显高于2008年。另外,图3显示移栽后48 d内单位鲜重根内的线虫数量是增加的,说明J3和J4幼虫的比例增加受温度的影响较大。
2008年,J3和J4分别在移栽后12 d和28 d被检测到,J2到J3约需8 d,J3到J4约需16 d。2009年检测到J3和J4的时间均提前,移栽后20 d可检测到J4,J2发育到J3,以及J3到J4所需要的时间缩短为4 d和8 d。成熟雌虫比2008年提前8 d检测到(2008年在移栽后32 d,2009年在移栽后24 d),2008年平均土温为15℃,根结线虫在番茄根内完成第一个世代约32 d,2009年平均土温为25℃,根结线虫完成第一个世代约24 d(表1)。

表1 番茄移栽后最早检测到各龄期根结线虫的时间
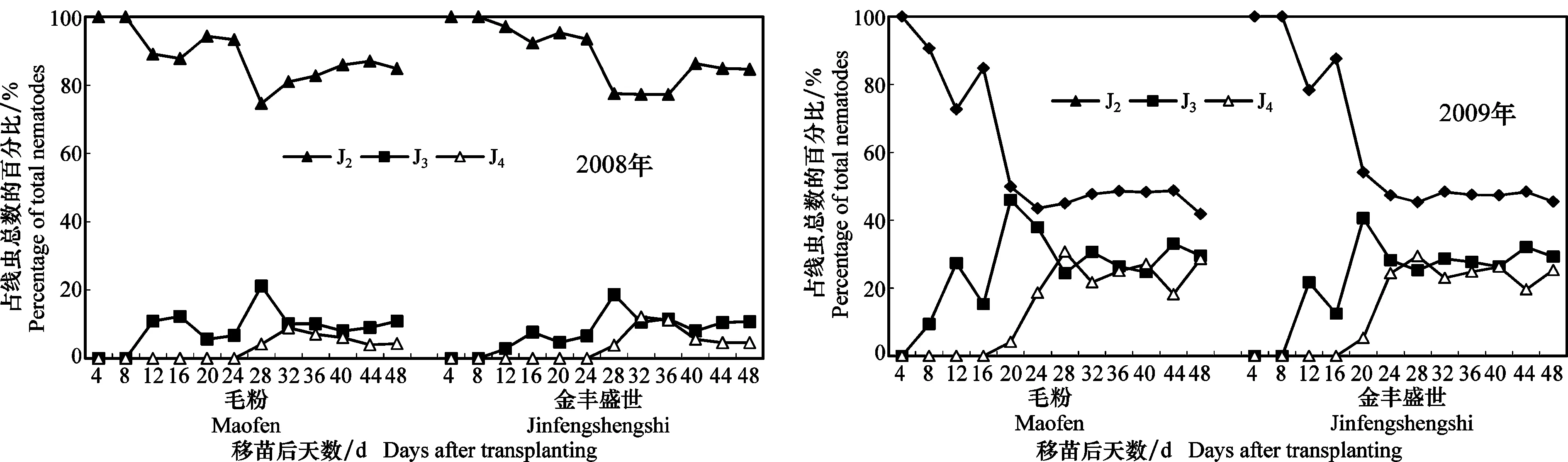
图4 2008年和2009年番茄移苗后根结线虫J2、J3和J4在根内的分布动态Fig.4 Distribution dynamics of root-knot nematode J2, J3 and J4 in the root after tomato transplanting in 2008 and 2009
2.4番茄根部根结数量的动态变化
2个品种移栽后48 d内根部形成根结数的变化趋势如图5所示。2008年根结数量显著高于2009年(P<0.05),但根结数量的变化趋势一致。可以看出,两年试验分别在移栽后20~28 d之间(2008年)和24~28 d之间(2009年)有一个根结增加的停滞期,在此前期和后期根结数量均增加较快。最后1次检测结果表明,2008年‘毛粉’和‘金丰盛世’的根结数量分别为366.0个和410.7个;2009年两者分别为238.7个和219.0个。根结数量(y)与移栽后天数(x)之间的关系可用多项式y=ax3+bx2+cx+d拟合。2008年‘毛粉’和‘金丰盛世’的多项式分别为y=0.718 3x3-13.299x2+95.688x-76.38(R2=0.941 4)和y=-0.413 5x3+9.073 8x2-32.078x+28.633(R2=0.974 3);2009年‘毛粉’和‘金丰盛世’的拟合式分别为y=-0.413 5x3+9.073 8x2-32.078x+28.633(R2=0.974 3)和y=-0.431 2x3+9.809 3x2-40.687x+40.714 (R2=0.974 3)。
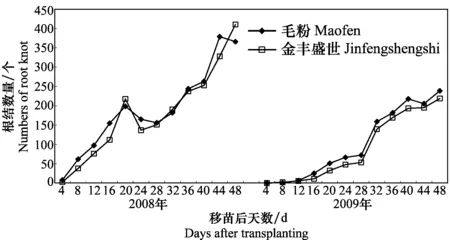
图5 2008年和2009年番茄根部根结数量的动态变化Fig.5 Dynamics of the root knot number in tomato roots in 2008 and 2009
3 讨论
温室条件下对根结线虫在番茄根内的发育及动态进行监测,结果表明,移栽后48 d内番茄根内单位鲜根重线虫数量因试验条件不同而表现出差异。2008年在土壤平均温度15.7℃(5 cm)和15.3℃(10 cm),湿度为17.33%~23.67%(12 cm),20.67%~35%(20 cm)条件下,初始群体密度较大,根内线虫密度总体呈下降趋势;2009年在土壤平均温度25.9℃(5 cm)和25.2℃(10 cm),湿度为14.67%~24.67%(12 cm),19.67%~30.33%(20 cm)条件下,根内线虫密度有上升趋势。温度是影响线虫生长发育的重要因素,根结线虫生长温度范围8~32℃,最适温度25~30℃[14-17];其发育的低温阈值为9℃,高温阈值为28℃,超出这个温度阈值,发育明显迟缓。此外其他因素,如湿度、光照及寄主的状况(包括年龄和营养)也影响根结线虫的发育,而且在不同发育阶段起着不同的作用[18]。本研究结果说明,在山东省,在温度较低的条件下,温室土壤中的根结线虫可正常侵染,虽然线虫的发育受阻,但仍会导致番茄根系形成较多的根结,对根系造成伤害。温度适宜的情况下,土壤中卵的孵化、幼虫的侵染及在根内的发育均较快。
两年试验均在番茄移栽后4 d的根内检测到线虫,2008年单位重量鲜根内线虫数明显大于2009年,但2个品种之间单位鲜根重线虫数没有显著差异(P>0.05)。对本研究中2009年番茄根内单位鲜根重线虫数量较2008年少的原因分析如下:①移栽前土壤中根结线虫密度不同,2008年试验时土壤中大量的根结线虫已经侵入番茄根部,造成土壤里线虫量降低,2009年未重新接种,土壤中线虫的群体密度显著低于2008年。因此,2009年番茄根内单位鲜根重线虫数量比2008年番茄根内线虫数量少,说明在适宜的范围内,接种量越大线虫侵染量也越大[19]。同时研究结果表明,在实际生产中可以利用休棚期间种植感病番茄,并于移栽后40~50 d拔除,能显著降低土壤中根结线虫的群体密度。②根据前人的研究结果,孵化后21 d的幼虫,只有19%侵入寄主植物,而刚刚孵化的幼虫有71%侵入寄主植物[8]。2009年移栽前的土壤温度适合根结线虫卵的孵化,当移栽时这部分孵出的2龄幼虫侵染能力已下降。③2009年的温度(22~24℃)适宜番茄生长,移栽后4 d时‘毛粉’和‘金丰盛世’根系的单株鲜根重分别为0.67 g和0.65 g,而2008年番茄长势较弱,分别为0.34 g和0.24 g,利于线虫的侵染。
线虫能在一个较宽的温度范围内繁殖,但温度对于根结线虫的发育影响较大[20-22],在低温条件下根结线虫J3和J4发育缓慢[23]。本研究中2008年J2发育成J3,以及J3发育成J4的时间均比2009年长,且2008年移栽后32 d检测到成熟雌虫,2009年则提前8 d,在移栽后24 d检测到。两年试验表明,从线虫的侵染、发育上看,普通品种‘毛粉’和耐病品种‘金丰盛世’有相似的动态变化,两者之间没有显著差异,但 ‘金丰盛世’根内线虫的总数及根结数量均小于‘毛粉’。
目前有关根结线虫发生规律的报道,多从环境条件[24-25]或植物抗性[26-28]等方面加以描述。而关于根内根结线虫发育进程及动态的系统研究未见报道。一方面线虫能否成功发育及发育速度可用于评价作物品种对线虫的抗性;另一方面研究线虫在根内的发育动态,明确线虫的发育进程及生活史可为生产上防控该病提供重要的生物学信息。根据线虫生活史中敏感虫态发生时间确定用药时期,避免不必要的多次施药,提高农药的使用效率,达到减药增效的目的,减少农药污染,节约成本。
[1]祝海燕. 寿光设施蔬菜根结线虫病流行原因及防控[J].长江蔬菜, 2015 (1): 53-54.
[2]彭德良. 蔬菜病虫害的综合治理(十) 蔬菜线虫病害的发生和防治[J].中国蔬菜, 1998 (4): 57-58.
[3]Jacquet M, Bongiovanni M, Martinez M, et al. Variation in resistance to the root-knot nematodeMeloidogyneincognitain tomato genotypes bearing theMigene [J].Plant Pathology, 2005,54(2):93-99.
[4]Siguenza C, Schochow M, Turini T, et al. Use ofCucumismetuliferusas a rootstock for melon to manageMeloidogyneincognita[J].Journal of Nematology, 2005, 37(3): 276-280.
[5]Piedrabuena A, Garcia-Alvarez A, Diez-Rojo M A, et al. Use of crop residues for the control ofMeloidogyneincognitaunder laboratory conditions [J].Pest Management Science, 2006, 62(10):919-926.
[6]陈志杰, 张淑莲, 李泽宽, 等. 陕西温室番茄根结线虫病发生规律与绿色防治技术[J].陕西农业科学, 2008(5): 49-51.
[7]王明祖. 猕猴桃根结线虫病的研究[J].山西果树, 1989(3): 26-27.
[8]刘维志. 植物病原线虫学[M].北京: 中国农业出版社, 2000: 255.
[9]孔凡玉,王年,王从丽, 等. 烟草根结线虫数量动态变化及田间流行规律研究[J].中国烟草科学, 1998(4): 35-37.
[10]吴家琴,薛召东.红麻根结线虫病的初步调查及优势虫种世代的研究[J].中国麻作, 1984 (2): 42-45.
[11]Nusbaum C J, Ferris H. The role of cropping systems in nematode population management [J].Annual Review of Phytopathology, 1973, 11: 423-440.
[12]苏崇森. 瓜菜新优品种高效栽培技术[M].北京: 中国农业出版社, 1996: 34.
[13]刘维志. 植物病原线虫学研究技术[M].沈阳: 辽宁科学技术出版社, 1995: 71-72.
[14]Darban D A, Pembroke B, Gowen S R. The relationships of time and temperature to body weight and numbers of endospores inPasteuriapenetrans-infectedMeloidogynejavanicafemales [J].Nematology, 2004, 6(1): 33-36.
[15]Pascal P Y, Dupuy C, Richard P, et al. Bacterivory of a mudflat nematode community under different environmental conditions [J].Marine Biology, 2008, 154(4): 671-682.
[16]Tzortzakakis E A, Trudgill D L. A comparative study of the thermal time requirements for embryogenesis inMeloidogynejavanicaandM.incognita[J].Nematology, 2005, 7(2): 313-315.
[17]雷敬超, 黄惠琴. 南方根结线虫生物防治研究进展[J].中国生物防治, 2007, 23(S1): 76-81.
[18]Lamberti F, Taylor C E. Root-knot nematodes (Meloidogynespecies) systematics, biology and control[M].Elsevier Science, 1979: 173-191.
[19]郭衍银, 徐坤,王秀峰, 等. 南方根结线虫初始接种密度对生姜生长的影响[J].应用生态学报, 2005,16(11): 2135-2139.
[20]Inserra R N, Gfiffin G D, Sisson D V. Effects of temperature and root leachates on embryogenic development and hatching ofMeloidogynechitwoodiandM.hapla[J].Journal of Nematology, 1983, 15(1):123-127.
[21]Vrain T C, Barker K R, Holtzman G I. Influence of low temperature on rate of development ofMeloidogyneincognitaandM.haplalarvae [J].Journal of Nematology, 1978, 10(2):166-171.
[22]Laughlin C W, Williams A S, Fox J A. The influence of temperature on development and sex differentiation ofMeloidogynegraminis[J].Journal of Nematology, 1969, 1(3): 212-215.
[23]Wong T K, Mai W F. Effect of temperature on growth, development and reproduction ofMeloidogynehaplain lettuce [J].Journal of Nematology, 1973,5(2):139-142.
[24]Seinhorst J W. Dynamics of populations of plant parasitic nematodes [J].Annual Review of Phytopathology, 1970,8:131-156.
[25]Dropkin V H. Cellular responses of plants to nematode infections [J].Annual Review of Phytopathology, 1969, 7: 101-122.
[26]Jablonska B, Ammiraju J S S, Bhattarai K K, et al. TheMi-9 Gene fromSolanumarcanumconferring heat-stable resistance to root-knot nematodes is a homolog ofMi-1 [J].Plant Physiology, 2007, 143(2):1044-1054.
[27]Ho J Y, Weide R, Ma H M, et al. The root-knot nematode resistance gene (Mi) in tomato: construction of a molecular linkage map and identification of dominant cDNA markers in resistant genotypes [J].Plant Journal, 1992, 2(6):971-982.
[28]Brito J A, Stanley J D, Kaur R, et al. Effects of theMi-1, N and tabasco genes on infection and reproduction ofMeloidogynemayaguensison tomato and pepper genotypes [J].Journal of Nematology, 2007, 39(4): 327-332.
(责任编辑:杨明丽)
Development and dynamics of root-knot nematode in tomato root under greenhouse in spring and autumn season
He Qiong1,Wu Haiyan1,Wang Zhenhua2
(1. Agricultural College of Guangxi University, Nanning530004, China;2. College of Plant Protection, Shandong Agricultural University, Tai’an271018, China)
The tomato roots of cultivar ‘Maofen’ and ‘Jinfengshengshi’ were collected with mesh bag method in 2008 autumn and 2009 spring, the nematodes in root were stained by the method of acid fuchsin-NaClO, and the number of nematodes (including juveniles at different stage) and root galls were recorded using stereomicroscope. The results in two years indicated that the number of nematodes per gram fresh root was decreased with the growth of tomato under lower temperature in 2008 and increased under higher temperature in 2009. There was no significant difference in the number of nematodes per gram fresh root between two tested cultivars (P>0.05). The development time from J2to J3and J3to J4was longer in 2008 than that in 2009. The number of root galls in 2008 and 2009 showed the similar curve within 48 days after transplanting. Under this experimental condition, at the average soil temperature of 15℃, the first generation of root-knot nematode lasted for 32 days after transplanting, and for 24 days at the average soil temperature of 25℃.
root-knot nematode;temperature;development;dynamics;tomato
2015-08-21
2015-10-10
公益性行业(农业)科研专项(201503114);国家自然科学基金(31460464);广西自然科学基金(2014GXNSFAA118123)
E-mail: wuhy@gxu.edu.cn
S 436.412
A
10.3969/j.issn.0529-1542.2016.04.031
