苜蓿毁灭刺盘孢菌的主要生物学特性
2016-09-14马甲强王生荣袁庆华
马甲强, 王生荣, 袁庆华, 王 瑜
(1. 甘肃农业大学草业学院, 兰州 730070; 2. 中国农业科学院北京畜牧兽医研究所, 北京 100193)
苜蓿毁灭刺盘孢菌的主要生物学特性
马甲强1,2,王生荣1*,袁庆华2*,王瑜2
(1. 甘肃农业大学草业学院, 兰州730070; 2. 中国农业科学院北京畜牧兽医研究所, 北京100193)
苜蓿炭疽病是各苜蓿种植区分布较广的毁灭性病害。毁灭刺盘孢(Colletotrichumdestructivum)是苜蓿炭疽病的主要病原菌之一。本试验研究了培养基、碳源、氮源、温度、pH、光照、湿度对毁灭刺盘孢菌菌丝生长、分生孢子产生和萌发的影响。结果表明:该菌菌丝适宜生长的培养基为PDA、PSA和V-8汁;适宜温度范围为28~36℃,最适温度为32℃;适宜pH范围为4~6。该病菌在PDA培养基上,分别以麦芽糖和蛋白胨为碳、氮源,在28℃,pH 6的条件下培养时其产孢能力最强。孢子萌发的最适碳、氮源分别为可溶性淀粉和牛肉膏、蛋白胨;最佳温度28℃;最适pH为6。相对湿度98%以上有利于孢子的萌发。持续光照利于菌丝生长、产孢和萌发。
苜蓿炭疽病;毁灭刺盘孢;生物学特性
紫花苜蓿(Medicagosativa)是苜蓿属内栽培面积最大的多年生豆科牧草,享有“牧草之王”之美誉。它富含蛋白质、具有高产量、适口性好等饲用价值,已成为我国畜牧发展中不可替代的重要饲料作物[1]。然而,随着苜蓿种植面积的扩大,种植年限的增加,病害问题越来越严重,其中苜蓿炭疽病(alfalfa anthracnose)在世界各地苜蓿种植区分布较广,可造成苜蓿毁灭性损失。1947年,美国南部报道了此病的危害[2],之后世界许多国家和地区也陆续报道[3-7]。近年来我们课题组在吉林、黑龙江、内蒙古、河北等省区进行苜蓿病害调查时发现,苜蓿炭疽病发病程度逐年增加,危害加重。该病发生后苜蓿叶片、茎部及根部均被侵染,发病严重时枝条枯萎,苜蓿减产达25%~30%[7]。目前已报道的能引起苜蓿炭疽病的炭疽菌有7种,分别是三叶草刺盘孢(Colletotrichumtrifolii)、毁灭刺盘孢(C.destructivum)、平头刺盘孢(C.truncatum)、球状刺盘孢(C.coccodes)、束状刺盘孢(C.dematium)、亚麻刺盘孢(C.linicola)和C.americae-borealis[3-4,8,10]。其中,毁灭刺盘孢对苜蓿致病性强,它不仅能够侵染多种豆科牧草,还能侵染禾本科、菊科等12科植物[5, 9-13]。目前该菌在我国烟草上相关报道较多[14-16],我国学者刘若[17]在吉林紫花苜蓿病害调查时发现了此菌,之后该菌引起苜蓿炭疽病的国内报道较少,而且对苜蓿毁灭刺盘孢的生物学特性研究鲜见报道。因此,本文对苜蓿毁灭刺盘孢的生物学特性进行系统研究,了解其菌丝和孢子生长所需营养物质和适宜的环境条件,以期为苜蓿炭疽病的综合防治提供理论依据。
1 材料与方法
1.1病原菌的来源
苜蓿炭疽病病叶样本采集于吉林白城,按照常规组织分离法[18]分离,并经过纯化、单孢分离后获得纯菌株,通过形态学和ITS-rDNA序列分析结合鉴定为毁灭刺盘孢(Colletotrichumdestructivum)[7,10,19]。选取具有代表性的菌株J-4供生物学特性研究。
1.2生物学特性测定
1.2.1不同培养基对菌丝生长及产孢量的影响
将J-4菌株进行菌种活化,然后取菌饼(d=0.5 cm)分别接种到马铃薯葡萄糖琼脂(PDA)、马铃薯蔗糖琼脂(PSA)、水琼脂(WA)、查氏(Czapek)、胡萝卜琼脂(CA)、燕麦片琼脂(OMA)、玉米粉琼脂(CMV)、V-8汁(V-8汁200 mL、CaCO32 g、琼脂17 g、定容至1 000 mL)、米饭琼脂(米饭200 g,水浴过滤、琼脂17 g、定容至1 000 mL)、番茄琼脂(番茄200 g、琼脂17 g、定容至1 000 mL)和番茄+燕麦片(番茄200 g、燕麦片30 g、琼脂17 g、定容至1 000 mL)培养基[20]平板中央(d=9 cm)。然后放入25℃恒温黑暗培养箱中培养。每个处理3次重复,7 d后用十字交叉法测定菌落直径,计算菌落净生长量,15 d后用血球计数板测定产孢量[18]。
1.2.2不同碳源对菌丝生长、产孢量和孢子萌发的影响
试验以真菌生理培养基(氮源1 g、KH2PO40.5 g、MgSO4·7H2O 0.5 g、碳源5 g、琼脂12 g、蒸馏水1 000 mL)[21]为基础,硝酸钾为氮源,分别用相同含碳量的可溶性淀粉、半乳糖、果糖、麦芽糖、葡萄糖、蔗糖和甘露醇,配制成7种不同碳源的培养基,以不加碳源为对照,每个处理3次重复。孢子萌发测定,先配制与1%葡萄糖溶液中含碳量相同的可溶性淀粉、半乳糖、果糖、麦芽糖、蔗糖和甘露醇溶液,然后分别用上述溶液配制孢子悬浮液。采用凹玻片萌发法[18],用移液枪吸取50 μL孢子悬浮液滴于凹玻片上,25℃恒温黑暗培养9 h后时观察100个分生孢子,统计分生孢子萌发数和孢子总数,计算分生孢子的萌发率。每个处理3次重复。
1.2.3不同氮源对菌丝生长、产孢量和孢子萌发的影响
以真菌生理培养基为基础,葡萄糖为碳源,分别加入硝酸钾、硫酸铵、氯化铵、尿素、蛋白胨、牛肉膏、硝酸铵各1 g配成7种不同氮源的培养基。以不加氮源为对照,每处理3次重复。孢子萌发测定以0.5%的量加入硝酸钾、硫酸铵、氯化铵、尿素、蛋白胨、牛肉膏、硝酸铵配成孢子悬浮液。采用1.2.1和1.2.2的方法测定菌落直径、产孢量和孢子萌发率。
1.2.4不同温度对菌丝生长、产孢量和孢子萌发的影响
将病原菌菌饼(d=0.5 cm)接种到PSA平板中央,分别置于4、8、12、16、20、24、28、32、36、40℃等10个不同温度梯度下黑暗培养。每处理3次重复。采用1.2.1测定方法测定菌丝生长和产孢量。孢子萌发采用水琼脂玻片法[18],将孢子悬浮液滴在水琼脂玻片上,置于带有湿滤纸的培养皿中,然后放在不同温度的恒温培养箱培养。采用1.2.2统计方法计算孢子萌发率。
1.2.5不同 pH对菌丝生长、产孢量和孢子萌发的影响
以PSA为基础培养基[20],用0.1% NaOH和0.1% HCl溶液调配培养基酸碱度,pH分别设置为2、3、4、5、6、7、8、9、10、11、12共11个梯度,每处理3次重复。采用1.2.1和1.2.2的方法测定菌落直径、产孢量和孢子萌发率。
1.2.6不同光照对菌丝生长、产孢量和孢子萌发的影响
以PSA为基础培养基[20],分别放置在持续光照、持续黑暗、光暗交替的培养箱内。每处理3次重复。采用1.2.1和1.2.2的方法测定菌落直径、产孢量和孢子萌发率。
1.2.7不同湿度对孢子萌发的影响
在干燥器内配制不同浓度硫酸溶液和饱和盐溶液[18]控制相对湿度,设相对湿度梯度为50%、65%、75%、86%、90%、98%,以水滴中孢子萌发率为对照,将孢子悬浮液(约100个/视野)直接涂于玻片上,每个处理3次重复。置于25℃黑暗培养12 h后统计孢子萌发率。
1.3数据分析
各试验数据采用SPSS(19.0)软件进行方差分析,Excel(2010版)程序绘图。
2 结果与分析
2.1不同培养基对菌丝生长、产孢量的影响
不同培养基对菌丝生长具有显著的影响(P<0.05),在PDA、PSA和V-8液汁培养基上菌丝生长速度快,菌丝较稠密,菌落表面小黑点(分生孢子盘)相对较多;在水琼脂和查氏培养基上菌丝生长速度最慢,说明水琼脂和查氏培养基不适宜此菌的生长。从产孢量来看,不同培养基间也存在显著差异(P<0.05),其中PDA培养基产孢量最大,为1.5×106个/mL,显著高于其他培养基的产孢量;其次是PSA和V-8汁,分别为3.8×105个/mL和2.3×105个/mL;胡萝卜和番茄燕麦培养基产孢量少,而其余培养基均不产孢(图1)。

图1 不同培养基对菌丝生长和产孢量的影响Fig.1 Effects of media on mycelium growth and spore production
2.2不同碳源对菌丝生长、产孢量和孢子萌发的影响
不同碳源对菌丝生长有显著的影响(P<0.05),菌丝在蔗糖、甘露醇、不加碳源的对照、可溶性淀粉和葡萄糖的培养基上生长较快,而在半乳糖和果糖培养基上生长较慢,在甘露醇和半乳糖培养上的生长速率分别是1.0、0.6 cm/d,甘露醇培养基上的生长速率是半乳糖培养基上的生长速率的1.7倍。从产孢量来看,不同碳源间产孢量也存在显著差异(P<0.05),其中麦芽糖培养基产孢量最高,达6.8×106个/mL,并且与其他碳源培养基之间存在显著差异。而半乳糖培养基产孢量最少,仅2.2×105个/mL(图2a)。7种碳源溶液对分生孢子萌发与对照相比存在显著差异(P<0.05),其中最适合分生孢子萌发的碳源为可溶性淀粉,其次是果糖、葡萄糖和麦芽糖,总体来说7种碳源对分生孢子的萌发均有促进作用(图2b)。
2.3不同氮源对菌丝生长、产孢量和孢子萌发的影响
在含蛋白胨和KNO3的培养基上菌丝生长速度最快,其次是尿素和牛肉膏培养基,并且在这4种培养基上菌丝生长速度显著高于对照(P<0.05),而在 (NH)2SO4和NH4Cl培养基上菌丝生长速度最慢,明显低于对照;从产孢量来看,蛋白胨培养基上产孢量最大,显著高于其他氮源的产孢量,其次是KNO3和尿素培养基,产孢量少的是NH4Cl和(NH)2SO4培养基,在不加氮的CK培养基上不产生孢子(图3a);不同氮源对分生孢子的萌发有显著影响(P<0.05),蛋白胨和牛肉膏溶液对孢子萌发有明显的促进作用,可使孢子萌发率达50%以上,其次是(NH)2SO4和NH4NO3溶液,而在NH4Cl溶液中孢子萌发率最低,仅为14.5%,显著低于对照(图3b)。

图2 不同碳源对菌丝生长、产孢量和分生孢子萌发的影响Fig.2 Effects of carbohydrates on mycelium growth,spore production and germination

图3 不同氮源对菌丝生长、产孢量和分生孢子萌发的影响Fig.3 Effects of nitrogen sources on mycelium growth, spore production and germination
2.4不同温度对菌丝生长、产孢量和孢子萌发的影响
不同培养温度对菌丝生长有显著的影响(P<0.05),菌丝体可在8~36℃之间生长,适宜的生长温度范围为24~36℃,最适生长温度为32℃。该病菌在8~36℃均可产生分生孢子,适宜产孢的温度范围为24~32℃,最适产孢温度为28℃,在此温度下产孢量达5.9×106个/mL,显著高于其他温度处理(图4a)。不同温度处理对分生孢子萌发率的影响存在显著差异(P<0.05),随着温度的升高分生孢子萌发率呈现上升趋势,当温度达到28℃时,分生孢子萌发率达到最高,为62.0%,之后随着温度的增加萌发率出现明显的下降趋势,当温度达到40℃时,孢子不能萌发(图4b)。
2.5不同pH对菌丝生长、产孢量和孢子萌发的影响
菌丝在pH 3~11范围内均可生长(图5a),其中以pH4~5时最适合菌丝的生长,在此范围内菌落直径及日生长量都达到最大,其次是pH6、7和8,当pH值低于3或高于11时,不能形成成熟的菌落,不适合菌丝生长。从产孢量来看,pH 3~10时均可产生分生孢子,其中pH为6时,产孢量最大,显著高于其他pH的产孢量(P<0.05)。不同pH对分生孢子萌发有显著的影响(P<0.05),在pH 3~12范围内分生孢子均可萌发,适宜分生孢子萌发的pH范围为5~7,萌发率达到38.2%以上,以pH为6时萌发率最高,达47.6%,当pH值小于3的条件下,孢子萌发率不足20.0%,不适宜病菌萌发(图5b)。
2.6不同光照对菌丝生长、产孢量和孢子萌发的影响
不同光照条件对菌丝生长、产孢量及孢子萌发率有显著的影响(P<0.05),在持续光照条件下菌落直径、产孢量及分生孢子萌发率均显著高于其他处理(P<0.05),持续光照处理菌落直径、产孢量及孢子萌发率分别比持续黑暗处理高12.5%、82.0%、50.2%,比黑暗交替处理高7.8%、80.4%、44.8%。说明该病原菌对光照比较敏感,菌丝生长,孢子萌发及产孢均喜欢持续的光照(表1)。
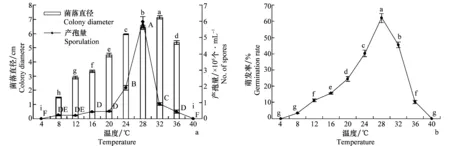
图4 不同温度对菌丝生长、产孢量和分生孢子萌发的影响Fig.4 Effects of temperature on mycelium growth, spore production and germination
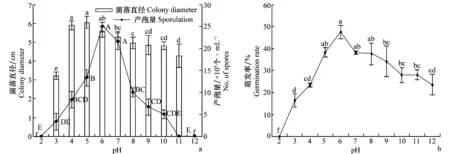
图5 pH对菌丝生长、产孢量和分生孢子萌发的影响Fig.5 Effects of pH on mycelium growth,spore production and germination

处理方式Treatment菌落直径/cmColonydiameter产孢量/105个·mL-1No.ofspores孢子萌发率/%Germinationrate持续黑暗Continuousdark5.6b2.3b31.3b黑暗交替Alternatinglightanddark5.9b2.5b34.7b持续光照Continuouslight6.4a12.8a62.9a
1) 同列数据后不同小写字母表示在P<0.05水平差异显著。
The lowercase letters in the same column indicate significant difference at 0.05 level.
2.7湿度对孢子萌发的影响
该病菌分生孢子在相对湿度50%和75%的条件下均不能萌发,在相对湿度为86%、90%时萌发率仍较低,分别为3.3%、8.9%,在相对湿度98%条件下萌发率达37.9%,在水滴中的萌发率最高,达54.6%(表2)。

表2 湿度对孢子萌发的影响
3 结论与讨论
苜蓿毁灭刺盘孢菌的生物学特性很少有文献报道,本文就其菌丝生长、产孢和孢子萌发条件等生物学特性作了较深入的研究。结果表明,PDA、PSA、V-8液汁培养基对菌丝生长和产孢均有促进作用,尤其是在PDA培养基上产孢量最高,这与田华等[16]的研究结果一致。说明PDA是苜蓿毁灭刺盘孢的最佳培养基。本研究还发现苜蓿毁灭刺盘孢在单独有燕麦片或番茄的培养基上均不产孢,且菌丝稀疏,但将两者混合后,其菌丝稠密,且产生少量分生孢子,说明两者混合可能增加了分生孢子形成所需要的生长物质或微量元素,也可能两者混合后中和某些抑制物质,还有待于进一步研究。这些研究结果表明,毁灭刺盘孢菌是否产孢的关键因素是培养基的营养成分。不同碳源和氮源对苜蓿毁灭刺盘孢菌丝生长、孢子产生和萌发有显著的影响。以麦芽糖、可溶性淀粉最利于产孢和萌发的氮源,说明二糖适合病菌孢子产生和萌发。氮源对孢子的产生和萌发尤为重要,与对照相比差异显著。最利于菌丝生长、产孢和萌发的氮源均为蛋白胨。碳源和氮源相比,碳源对孢子萌发影响更大。
适宜苜蓿毁灭刺盘孢菌丝生长、孢子产生和萌发的温度范围为24~32℃,低于24℃或高于32℃时,菌丝生长、孢子产生和萌发都会受阻。菌丝生长最适温度为32℃,孢子产生和萌发的最适温度均为28℃,说明该病菌适宜在高温下生长,这与刘爱媛等[21]、傅俊范等[22]对其他作物炭疽病菌的研究结果基本一致;而与田华等[16]的研究结果不符,可能是寄主不同,地域不同,病原菌对温度的要求不同。另外,分生孢子萌发对湿度的要求严格,相对湿度在98%以上时,分生孢子的萌发率比较高。持续光照更有利于该菌菌丝生长、产孢和孢子萌发。同时,对苜蓿炭疽病菌进行致病性测定时,发现延长光照周期有利于发病,由此也佐证了其对持续光照敏感。该菌对酸碱适应能力强,pH在3~11范围均可生长,菌丝生长、产孢和孢子萌发的最适pH均为6。这与唐爽爽等[20]对西瓜炭疽病的研究结果一致,可见该病菌宜在偏酸性环境下生长。这与吉林7月、8月日照时长、高温多雨的季节病害流行相吻合。因此利用提早刈割,降低空气湿度等措施,可以有效控制病害发生。
[1]袁庆华. 我国苜蓿病害研究进展[J]. 植物保护, 2007, 33(1): 6-10.
[2]Graham J H, Stuteville D L, Frosheiser F I, et al.A compendium of alfalfa diseases [M]. American: The American Phytopathological Society, 1979.
[3]Vasic T, Bulajic A, Krnjaja V, et al. First report of anthracnose on alfalfa caused byColletotrichumlinicolain Serbia [J]. Plant Disease, 2014, 98(9): 1276.
[4]Koch S H, Baxter A P, Knox-Davies P S.Identity and pathogenicity ofColletotrichumspecies fromMedicagosativain South Africa [J]. Phytophylactica, 1989, 21(1): 69-78.
[5]Welty R E, Rawlings J O.Effects of inoculum concentration and temperature on anthracnose severity in alfalfa [J]. Phytopathology, 1985, 75 (5): 593-598.
[6]郑芳芳, 贺伟, 尹淑霞. 20个苜蓿品种对炭疽病(Colletotrichumtruncatum)的抗性测定[J]. 植物保护, 2008, 34(6): 99-101.
[7]薛福祥. 草地保护学(第三分册: 牧草病理学)[M]. 北京: 中国农业出版社, 2008.
[8]Graham J H, Devine T E, Hanson C H.Occurrence and interaction of three species ofColletotrichumon alfalfa in the mid-Atlantic United States [J]. Phytopathology,1976,66(5):538-541.
[9]Latunde-Dada A O, Bailey J A, Lucas J A.Infection process ofColletotrichumdestructivumO’Gara from lucerne (MedicagosativaL.)[J]. European Journal of Plant Pathology, 1997, 103(1): 35-41.
[10]Damm U, O’Connell R J, Groenewald J Z, et al. TheColletotrichumdestructivumspecies complex-hemibiotrophic pathogens of forage and field crops [J]. Studies in mycology, 2014(79): 49-84.
[11]Shen S H, Goodwin P, Hsiang T.Hemibiotrophic infection and identity of the fungus,Colletotrichumdestructivum, causing anthracnose of tobacco [J]. Mycological Research, 2001, 105(11): 1340-1347.
[12]邢红梅, 丁平, 王克荣, 等. 红掌毁灭炭疽菌的分子检测[J]. 华中农业大学学报, 2011, 30(5): 589-593.
[13]王娜. 吉林省树莓病害的病原学研究及室内药剂筛选[D]. 长春: 吉林农业大学, 2013.
[14]王进, 黄艳飞, 汪汉成, 等. 烟草疫霉拮抗菌枯草芽胞杆菌21b菌株的分离鉴定及其生物学特性研究[J]. 微生物学通报, 2014, 41(12): 2481-2487.
[15]王静, 孔凡玉, 陈晓红, 等. 短小芽胞杆菌AR03对烟草炭疽病的抑制作用[J]. 植物保护, 2015, 41(1): 104-107.
[16]田华, 赵杰, 王静, 等. 一株烟草炭疽病病原鉴定与生物学特性研究[C]∥吴孔明.中国植物保护学会成立50周年庆祝大会暨2012年学术年会——植保科技创新与现代化建设.北京: 中国农业科学技术出版社, 2012: 78-83.
[17]刘若. 草原保护学[M]. 北京: 中国农业出版社, 1998.
[18]方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998.
[19]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[20]唐爽爽, 刘志恒, 于朝阁, 等. 辽宁省西瓜炭疽病病原菌鉴定及生物学特性研究[J]. 植物保护, 2014, 40(4): 38-44.
[21]刘爱媛, 陈维信, 李欣允. 荔枝炭疽病菌生物学特性的研究[J]. 植物病理学报, 2003, 33(4): 313-316.
[22]傅俊范, 王思文, 周如军, 等. 辽宁山药炭疽病病原鉴定及其生物学特性[J]. 吉林农业大学学报, 2014, 36(4): 395-400.
(责任编辑:田喆)
Major biological characteristics of Colletotrichum destructivum causing anthracnose of alfalfa
Ma Jiaqiang1,2,Wang Shengrong1,Yuan Qinghua2,Wang Yu2
(1. Pratacultural College of Gansu Agricultural University, Lanzhou730070, China; 2. Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing100193, China)
Alfalfa anthracnose is a destructive disease in the alfalfa-planting areas, which was mostly caused byColletotrichumdestructivum. The effects of medium, carbon, nitrogen, temperature, pH, illumination and humidity on the mycelial growth, sporulation and conidia germination of alfalfa anthracnose fungus were studied. The results showed that PDA, PSA and V-8 juice were the optimal medium for hyphal growth; the optimal temperature for mycelium growth ranged from 28℃ to 36℃, with the optimum temperature of 32℃ and the optimum pH of 4-6. The sporulation ability ofC.destructivumwas best when it was cultured on PDA, with maltose and peptone as carbon and nitrogen sources, respectively, at 28℃ and pH 6. For conidia germination, the optimal carbon and nitrogen sources were soluble starch, beef paste and peptone, and the optimal temperature was at 28℃; the optimum pH value was 6. The 98% or higher relative humidity favored the conidia germination, while the continuous light was conducive to mycelial growth, sporulation and conidia germination.
alfalfa anthracnose;Colletotrichumdestructivum;biological characteristic
2015-07-27
2015-08-26
公益性行业(农业)科研专项(201303057);“十二五”国家科技支撑计划项目(2011BAD17B01)
E-mail:wangsr@gsau.edu.cn;yuanqinghua@hotmail.com
S 435.4
A
10.3969/j.issn.0529-1542.2016.04.016
