两个玉米自交系对纹枯病的抗病反应机制初探
2016-09-14罗丽雅张翠苹孙小芳龚国淑常小丽
戴 浩, 罗丽雅, 张翠苹, 孙小芳, 龚国淑, 张 敏, 常小丽
(四川农业大学农学院植物病理系, 成都 611130)
两个玉米自交系对纹枯病的抗病反应机制初探
戴浩,罗丽雅,张翠苹,孙小芳,龚国淑,张敏,常小丽*
(四川农业大学农学院植物病理系, 成都611130)
玉米纹枯病是由立枯丝核菌(RhizoctoniasolaniKühn)引起的一种重要病害。具有优良性状的自交系是开展玉米抗病品种选育的重要种质资源。本试验以西南地区两个优良玉米自交系R08与18-599R为材料,采用人工接种R.solani菌丝融合群AG1-IA,对成株期玉米进行了抗性鉴定,并对病原菌诱导后苗期玉米叶片上的活性氧(ROS)、抗病相关基因(PR1、ZmDREB2A、ZmERF3 和WIP1)表达及细胞坏死情况进行了动态检测。结果显示,R08对纹枯病表现为中抗,而18-599R为高感材料;受R.solani侵染后,玉米叶片ROS的积累在R08中较18-599R多;两个自交系中基因表达量及表达时间存在显著差异;R08叶片出现显著的细胞坏死反应,而18-599R相对较轻。本研究表明两个自交系对R.solani的抗性差异主要体现在相关抗病反应的时间和强度上,这为进一步研究玉米纹枯病抗病机理提供了依据。
玉米;立枯丝核菌;抗病性;活性氧;抗病相关基因
玉米(ZeamaysLinn.)是世界主要的食、饲兼用作物,也是重要的工业原料。在我国,玉米种植面积及产量已超过水稻和小麦,跃居三大作物之首[1]。近年来,由于玉米种植面积连年扩大,各地玉米病害加重,每年因各种病害导致的玉米产量损失达10%以上,严重影响了玉米产业发展及国家的粮食安全。其中,玉米纹枯病(maize banded leaf and sheath blight, BLSB)是世界玉米产区广泛发生、危害严重的土传病害之一,该病自1934年首次在美国南部报道以来,已在中国、印度、日本、南非、法国等国相继发生[2]。在我国,玉米栽培种植纬度跨度大,地形地貌复杂,耕作栽培制度多样,导致纹枯病菌群体结构多样性,但主要为立枯丝核菌(Rhizoctoniasolani),且以菌丝融合群AG1-IA为优势菌群[3-6],该菌群具有土传性、寄主范围广、适应性强和高致病性等特点[6]。目前,防治玉米纹枯病大多采用减少越冬菌源,选用抗病品种,加强栽培管理并辅以药剂保护的综合防治措施,然而,玉米种质资源对纹枯病抗性受环境因素影响较大,年份间抗性存在较大差异,迄今为止,生产上尚无对玉米纹枯病抗性较好的品种[7-8]。因此,深入研究玉米对纹枯病的抗病机制,挖掘或培育具有广谱、高效、稳定及持久抗病性品种受到越来越广泛的重视。
植物受到病原菌侵染时,会诱导一系列的抗性反应,包括植物本身的某些结构和化学因子,如细胞壁角质、蜡质、木质素、特殊气孔结构,以及降解病原菌细胞壁的几丁质酶、葡聚糖酶、植物保护素和有毒酚类物质;另外,受病原菌诱导产生的一系列组织细胞生理生化反应,如抗氧化物酶激活、活性氧积累、细胞坏死反应及抗病相关基因的表达等[9-10]。研究植物与病原菌互作中的抗病反应信号,对于揭示植物的抗病机制具有重要意义。
玉米自交系18-599R和 R08均具有较高的配合力、遗传背景单一、高产、抗逆、综合性状优良等特性,是西南地区玉米转基因工程育种研究领域重要的优良受体自交系,但关于其对纹枯病的抗病机制尚不清楚[11-12]。本试验以18-599R和 R08为研究材料,以纹枯病菌(R.solani) 菌丝融合群AG1-IA为供试菌株,通过AG1-IA接种后,对成株期玉米进行抗性鉴定, 并对接种后不同时间点自交系苗期叶片中的活性氧(ROS)、抗病相关基因表达及细胞坏死情况进行测定,初步研究两个自交系对纹枯病的抗病机理,为玉米抗纹枯病育种提供依据。
1 材料与方法
1.1材料
供试玉米自交系18-599R和R08由四川农业大学玉米研究所提供;立枯丝核菌(R.solani)融合群菌株AG1-IA由四川农业大学植物病理系实验室提供。
1.2生化试剂及仪器
RNA提取试剂盒:Trizol®Reagent试剂(Invitrogen, USA)、Trizol-Mate(Tiandz)购自天根公司;反转录试剂盒:PrimeScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa),购自上海宝生物公司;PCR试剂盒:Taq PCR Master Mix(BioBasic)购自成都温江区瑞金特公司;台盼蓝(Trypan blue)、核酸染料、琼脂糖及其他试剂均购自成都市温江区博大泰克公司;二氨基联苯胺DAB(3,3-diaminobenzidine)试剂盒购自Sigma公司;台式高速冷冻离心机(5424R,Eppendorf)、真空抽滤泵(Vacuubrand CVC2)、PCR基因扩增仪(1000TM Thermal Cycler,Bio-Rad)、电泳仪(DYY-6C型,北京六一仪器厂)、凝胶成像仪(Universal Hood II,Bio-Rad)由四川农业大学农学院植物病理系提供。
1.3试验方法
1.3.1实验室育苗及病原菌活化
将自交系18-599R和R08的种子用75%乙醇处理1 min,然后用5%的次氯酸钠处理10 min,蒸馏水冲洗3~5次,将消毒后的玉米种子置于放有浸润卫生棉的培养皿中,置于生长温度25~28℃,相对湿度75%的温箱中培养催芽,1 d后取出移栽于装有灭菌基质土的直径34 cm,高23 cm的花盆中。每个自交系玉米种5盆,每盆种3株玉米。
将处于保存状态下的AG1-IA接入马铃薯葡萄糖琼脂(又称PDA)平板培养基上(马铃薯200 g,葡萄糖10 g,琼脂8 g,水1 000 mL),并置于25~28℃恒温下扩大培养至长满整个培养皿待用。
1.3.2抗性鉴定及病斑扩展情况观察
在玉米大喇叭口期对其接种,并于乳熟期进行抗性鉴定。将AG1-IA菌饼接种于玉米第6叶鞘部位,用保鲜膜包扎保湿,置于(25±3)℃,L∥D=16 h∥8 h的人工气候室内培养,到乳熟期观察并记录发病情况,病害分级及抗性评价标准参考黄天述等[8]的方法。病情分级标准如下:0级,全株不发病;1 级,果穗位下第4叶鞘及以下叶鞘发病;3级,果穗位下第3叶鞘及以下叶鞘发病;5级,果穗位下第2叶鞘及以下叶鞘发病;7级,果穗位下第1叶鞘及以下叶鞘发病;9级,果穗位及其以上叶鞘发病。对玉米抗病性评价依据病级划分为不同抗病类型:免疫(I,0级)、高抗(HR,1级)、抗(R,3级)、中抗(MR,5级)、感(S,7级)和高感(HS,9级)。
病斑扩展情况观察采用苗期玉米(5~6叶期)离体叶片进行。取苗期玉米上、中、下叶片各1片,剪至长4 cm、宽2 cm的叶段,在叶脉一侧接种1个R.solaniAG1-IA菌饼,放于垫有灭菌滤纸并加入少量无菌水的培养皿中,置于(25±3)℃下保湿培养,于接种后0、6、12、24、48、72和96 h记录病斑扩展面积,计算病斑面积占总叶段面积的百分比,并采用SPSS软件进行差异显著性分析。每个时间点各3片叶,试验重复3次。
1.3.3活性氧的测定
采用1.3.2的方法接种离体叶段,分别于接种后0、6、12、24、48、72、96 h对叶段进行DAB染色。DAB染色法参照前人的方法[13-14],并做了相应调整。取玉米叶段,蒸馏水洗净后置于15 mL离心管中,加入DAB染液(1 mg/mL,pH 5.8)至完全浸没叶段,用真空抽滤泵抽滤5 min 后,置于28℃避光保存8 h,随后光照1 h至显现红棕色斑点,弃染液,无菌水漂洗3次洗去浮色后,加入脱色液(含75%乙醇,5%甘油,20%无菌水)并沸水浴直至叶片绿色完全脱去, 重复脱色一次, 样品在脱色液中置于4℃冰箱内保存,采用显微镜拍照,并计算叶段染色面积占总叶段面积的百分比作为活性氧积累量。
1.3.4叶片细胞坏死情况检测
采用1.3.2的方法,于接种后0、6、12、24、48、72、96 h取玉米叶段,细胞坏死反应检测方法参照龙书生等[13]的方法,并稍作修改,用蒸馏水洗净后将其置于培养皿中,加入台盼蓝染液(乳酸、水饱和酚、甘油、1 mg/mL台盼蓝体积比为1∶1∶1∶1)至完全浸没叶段,28℃下放置4 h。随后取出叶段, 用无菌水漂洗3次后放入脱色液(含有75%乙醇,20%甘油,5%无菌水)中并沸水浴直至叶片完全褪绿, 弃掉脱色液,并重复脱色一次,最后叶段保存于脱色液中,置于4℃冰箱内直至拍照记录,并计算叶片染色面积占总叶片面积的百分比。
1.3.5抗病相关基因表达检测
为了检测两个自交系在基因水平上对纹枯病菌AG1-IA的反应差异,本试验选择了前人已报道的玉米抗逆相关基因,包括伤害诱导蛋白WIP1 (wound-inducibe protein 1)[15]、病程相关蛋白家族基因PR1(pathogenesis-related protein 1)[15]、包含ERF/AP2结构域的玉米转录因子基因ZmDREB2A(ERF/AP2 domain containing transcription factor)[16]和乙烯响应转录因子基因ZmERF3(ethylene responsive transcription factor 3)[16]。核糖体小亚基基因18SrRNA作为持家基因,用于基因表达的半定量分析。
试验采用1.3.2的接种方法,分别于接种后0 、6、12、24、48、72、96 h取3个叶段,用无菌水洗净,灭菌纸擦干后加入液氮进行混合研磨,取200 mg,参照TRIzol试剂盒说明书提取总RNA。RNA样品的质量经1.2%琼脂糖凝胶电泳检测,并用NanoDrop 2000超微量分光光度计检测。cDNA的获得按照反转录试剂盒说明进行,反应体系为:1 μg 总RNA,1 μL Anchored Oligo(dT)18 Primer、10 μL 2×TS Reaction Mix、1 μL Fracs Script RT/RI Enzyme Mix、gRNA Remover,用RNase-free Water补足至20 μL 。反应条件为:42℃,30 min;85℃,5 min;4℃,保持。反转录获得的cDNA用ddH2O按1∶20稀释后待用。
基因表达水平通过半定量RT-PCR(semi-quantitative RT-PCR)检测。PCR扩增体系包含:12.5 μLTaqPCR Master Mix、9.5 μL 灭菌ddH2O、1 μL primer F、1 μL primer R、1 μL cDNA。反应条件为:94℃预变性5 min;94℃变性30 s,58℃退火20 s,72℃延伸20 s,循环40次;72℃延伸5 min,4℃保持。PCR扩增产物通过溶有核酸染料的2%的琼脂糖凝胶电泳检测,拍照,保存。电泳条件:110 V,25 min。所有引物序列见表1(由上海生工合成)。

表1 用于半定量RT-PCR基因表达分析的寡聚核苷酸引物列表
2 结果与分析
2.1自交系18-599R和R08对纹枯病菌的抗性
于玉米乳熟期调查了两个自交系病情级别并划分抗性等级,结果表明,18-599R和R08对纹枯病抗性存在差异,18-599R病级为9级,属高感材料,而R08为5级,属中抗或耐病材料。
苗期玉米离体叶片接种结果显示,18-599R在接种后6 h开始,菌饼附近有明显的菌丝;接种后12 h 内,18-599R开始出现水渍状,而R08的接种部位均未出现病斑;接种后24 h,18-599R的菌饼附近开始有水渍状小病斑出现,而R08叶片开始出现水渍状;接种后48 h,水渍状病斑面积扩大,且两个自交系上均大量出现病斑;接种后72 h,叶片上病斑继续扩大,且18-599R叶片开始出现褪绿;接种96 h后,两个玉米叶片病斑与相邻的病斑相连,并出现典型的云纹状病斑。表明接种后24~48 h 为R.solani侵染阶段,48 h 后被侵染的玉米叶片开始大量发病。同时,18-599R的叶片发病严重程度高于R08(图1a)。接种后不同时间点测定的R08叶段上病斑面积占总叶段面积的百分比始终低于18-599R(图1b),表明R08抗性较强,离体接种与盆栽接种结果一致。
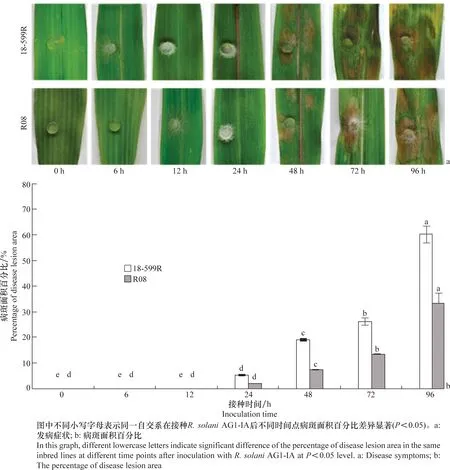
图1 两个玉米自交系叶片受纹枯病菌AG1-IA侵染后病斑扩展情况Fig.1 Development of disease lesion induced by Rhizoctonia solani AG1-IA on the leaves of two maize inbred lines
2.2自交系18-599R和R08叶片细胞内ROS积累情况
对18-599R和R08叶片细胞内ROS的测定,结果如图2所示,两个自交系在接种后6 h均在叶片上开始出现少量棕色斑点,表明有极少量的活性氧ROS产生;自接种后24 h开始,随着时间推移,叶片上棕色斑点数量和面积开始增加,表明ROS积累逐渐增多,表现为经DAB染色形成的棕色斑块较多且颜色较深。在相同时间下,R08叶片产生ROS面积百分比始终大于18-559R,表明自交系R08抗性较18-599R强。
2.3自交系18-599R和R08叶片细胞坏死情况
对18-599R和R08叶片产生的坏死斑测定结果显示,自交系R08在接种后6 h开始出现少量的蓝色斑点,表示叶片细胞坏死开始发生;接种12 h 后,18-559R叶片也开始出现细胞坏死。两个自交系中,叶片细胞坏死面积随接种后时间的延长而增加,且在接种后24 h,均大量出现(图3a)。在相同时间点,18-559R叶片细胞坏死的面积均小于R08(图3b),可见AG1-IA在自交系R08 叶片上的侵染受到一定限制,且R08抗性较好。

图2 两个自交系接种纹枯病菌AG1-IA后叶片中活性氧积累情况Fig.2 ROS accumulation in the leaves of two inbred lines at different time points after inoculation with Rhizoctonia solani AG1-IA

图3 玉米在接种纹枯病菌AG1-IA后不同时间点叶片细胞坏死情况Fig.3 Cell death in maize leaves at different time points after inoculation with Rhizoctonia solani AG1-IA
2.4自交系18-599R和R08叶片抗病相关基因表达情况
对18-599R和R08的总RNA进行RT-PCR检测,结果显示,接种R.solaniAG1-IA后不同时间点,自交系18-599R和R08中持家基因18SrRNA的表达量基本相同(图4),即为组成型表达,可用作基因表达定量分析的参照基因。
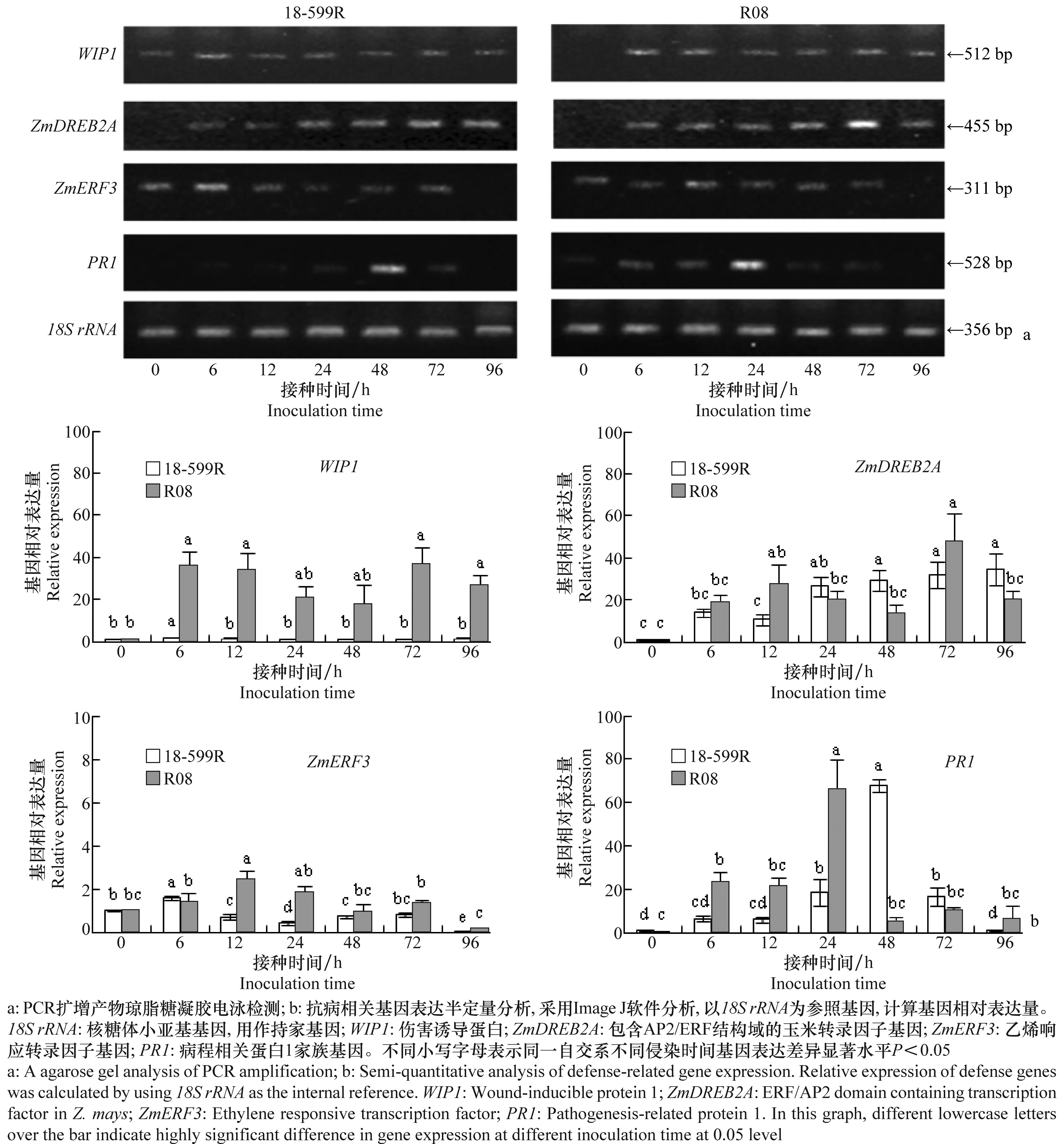
图4 自交系18-599R 和 R08中抗病相关基因的表达情况Fig.4 Expressions of defense-related genes in 18-599R and R08
PCR扩增产物经琼脂糖凝胶电泳检测,如图4a所示,接种R.solaniAG1-IA后6 h,R08中的WIP1被高水平诱导表达,接种后24 h和48 h其表达量稍有下降,其变化不显著,而18-599R中WIP1的相对表达量很低,且不同时间点变化不大。对于ZmDREB2A基因,在接种后6 h在R08中迅速且大量表达,随后略微降低,于72 h又出现一个表达高峰;而在18-599R中,其接种后在6 h时开始被诱导,随后缓慢增加,于96 h时达到最大。与接种0 h相比,ZmERF3基因于接种后6 h时在18-599R表达量增加1.8倍,其表达量随时间延长而降低,而在自交系R08中,该基因在12 h时出现表达高峰,与0 h相比表达量达到2.4倍,随后降低。病程相关蛋白基因PR1在自交系R08接种R.solaniAG1-IA后6 h开始表达,在24 h时表达量最大(66倍),48 h后表达量显著降低,而18-599R在接种后0 h时PR1基因未表达,接种前期微量表达且缓慢增加,到48 h时表达量最大(68倍),在随后的72 h和96 h时显著下降。综上所述,抗病相关基因在两个自交系接种后不同时间点均诱导表达,但其表达量存在差异,R08 中3个抗病基因WIP1、ZmDREB2A、ZmERF3和PR1在纹枯病菌AG1-IA接种前期(6~12 h)迅速诱导表达且表达水平高,而18-599R中,基因表达较迟且水平较低(ZmDREB2A,PR1),或被抑制(WIP1,ZmERF3)。
3 讨论
本试验研究了受纹枯病菌融合群菌株AG1-IA侵染后玉米自交系18-599R和R08的抗性差异及抗病相关防御反应,包括ROS的积累、叶片细胞坏死反应及抗病相关基因的表达情况,结果表明,两个自交系对纹枯病菌表现不同抗性,且病原菌能诱导自交系叶片中ROS产生、叶片细胞坏死反应及抗病相关基因表达,但其抗病差异表现在反应时间和强度。本试验初步探究了两个自交系对R.solani的抗病机制,为进一步深入研究玉米对纹枯病抗病机理奠定了基础。
具有优良性状的玉米自交系是玉米抗病育种的重要种质资源,本试验选用的18-599R和R08均为西南地区玉米育种研究领域重要的优良受体自交系,目前已被育成许多新品种,并被广泛推广及应用[11-12]。本试验采用自交系盆栽人工接种法对纹枯病的抗性进行鉴定,结果表明,在相同条件下,两个自交系对纹枯病菌R.solaniAG1-IA的抗性不同,18-599R为高感材料,R08表现为中抗,这与杨爱国等[17]的研究结果基本一致。与前人的田间抗性鉴定不同,本试验采用室内人工气候室盆栽植株进行,创造了病原菌侵染更有利的环境条件,因此发病较重。同时,由于玉米对纹枯病菌的抗性属于多基因控制的数量性状抗性[18],这类抗性的表达极易受气候环境条件(温度、湿度等)、种植制度、栽培措施等的影响,自交系抗病性受年度间环境相关因素的变化也会造成抗性级别的变化[19]。另外,近年来,由R08育成的玉米品种在西南地区推广种植,也可能导致纹枯病菌群体结构的变化,加上环境因素变化的影响,使得R08对纹枯病的抗性可能发生变化。
活性氧(ROS)是生物体内与氧代谢有关的含氧自由基和易形成自由基的过氧化物的总称,主要包括H2O2、OH-和O2-[20]。在正常情况下,植物体内ROS处于动态平衡状态,一旦遭受外界胁迫,活性氧迅速积累[13-14,20]。大量的研究发现,活性氧的变化与植物抗病性具有密切的相关性[20]。本试验中,接种R.solani后6 h,R08叶片中ROS(主要是H2O2)迅速产生且随侵染过程发展不断增加,而18-599R中ROS的产生则相对迟缓且诱导量较少(图2),表明ROS变化与自交系对R.solani的抗性有关。
病原菌侵染常诱导植物体内一系列抗病相关基因的表达,并翻译成抗病蛋白并被转运到特定部位在病原菌侵入、扩展及定殖等不同阶段起作用。本研究选取了前人已研究过的抗病相关基因WIP1[15]、PR1[15]、ZmDREB2A[16]和ZmERF3DREB[16],研究了不同自交系中这些基因表达与对纹枯病抗性之间的关系。WIP1(wound-inducible protein 1)是一个伤害诱导特异蛋白,属于Bowman-Birk 蛋白酶抑制剂[21],是植物抵抗动物摄食和病原侵染的重要防御蛋白[22]。Chintamanani等[15]研究发现,在抗病基因Rp1-D21玉米突变植株中WIP1基因大量表达,且与玉米抗病相关的过敏性坏死反应密切相关。本试验中, 自交系R08中WIP1从接种6 h 开始表达,随后表达虽降低,但一直维持相对较高水平,而在18-599R中在不同接种时间其表达量均很低。ERF(乙烯应答元件结合因子)和DREB均属于AP2/ERF家族中与植物抗病密切相关的转录因子,参与调控低温、干旱、高盐等非生物胁迫和病原菌侵染等生物胁迫[23]。研究发现,过量表达AtERF2基因的拟南芥植株对枯萎病、灰霉病等病害的抗性提高[24]。苜蓿中MtERF1基因表达与对R.solani的抗性有关,过量表达MtERF1基因的植株对立枯病等病害的抗性增强[25]。此外,过量表达ERF基因后,也能增强对某一种或几种病害的抗性[26-27],表明该基因具有一定的广谱抗病性,有助于培育广谱抗病性的作物新品种。Nguyen等[16]通过低温处理玉米后构建抑制消减文库筛选发现,ZmDREB2A和ZmERF3受低温、干旱、高温及盐胁迫后均能大量表达。本试验中ZmDREB2A基因在两个自交系中均从6 h 开始表达,随着时间的推移,其表达量出现波动,表明除参与植物的抗旱、耐盐性等非生物胁迫外,也与纹枯病菌侵染的生物胁迫有关系。ZmERF3基因在病原菌侵染6 h后在两个自交系中均高水平表达,且该基因的表达较为持久,这说明了ZmERF3基因的差异调节可能为不同玉米抗纹枯病所共有的。PR1是病程相关蛋白,具有攻击病原物、降解细胞壁大分子、降解病原物等多种功能,同时与植物过敏性反应和系统性获得抗性有关[28-30]。本试验中,R08中,PR1在接种后6 h开始诱导,24 h表达量最大,随后降低,表明在侵染前期,表现较强抗性,而18-599R,其PR1基因的表达相对滞后,在接种后48 h表达量最多(图4),其结果与乐美旺等[31]防御反应基因诱导表达研究结果基本相似,由此可推测R08对纹枯病的抗性反应较早,主要在侵入阶段起作用。
寄主植物通过识别并限制病原物的扩展蔓延,常在侵染点诱发局部的细胞坏死反应,对于活体寄生菌或专性寄生菌来说,常表现为过敏性坏死反应(hypersensitive reaction,HR)[13],而对于玉米纹枯病来说,其病原菌(R.solani)是一种非专性致病菌,主要通过分泌各种酶类导致植物细胞坏死,形成坏死斑,并从死细胞中吸收营养。本试验发现,在叶片相同部位细胞坏死被大量诱导,且在自交系18-599R较R08中表现更明显,表明R08具有较强的抵御病原菌酶类的能力。同时,叶片细胞坏死部位与ROS产生部位吻合度较高,表明ROS的产生与寄主细胞坏死的发生有着密切联系,这与王晨芳等[32]的研究结果相似。除了ROS外,van Loon等[33]1970年在烟草花叶病毒(TMV)侵染的烟草叶片中检测到了与HR细胞坏死相关的蛋白, 被命名为病程相关蛋白(pathogenesis-related proteins,PRs)。这样,许多抗病反应信号如活性氧ROS[20, 32]、病程相关基因的表达[15, 28-30, 33-35]等抗病信号均与植物细胞坏死反应的产生相关。
另外,本次试验采用室内盆栽苗进行玉米对纹枯病抗性鉴定,由于R.solaniAG1-IA在室内人工培养条件下不产生无性孢子,侵染靠营养体菌丝和其组织体菌核,因此试验采用菌饼接种,可能会对病原菌侵入的观察有一定影响。本试验对育种中两个重要的玉米自交系材料和纹枯病菌R.solaniAG1-IA间的抗性反应进行了初步研究,对于玉米与纹枯病的互作机理还有待深入研究。由于作物对纹枯病的抗性是多基因控制的,这方面的研究在水稻上进行的较多、较深入,目前,四川农业大学水稻研究所已经对立枯丝核菌(R.solaniAG1-IA)进行了全基因组测序[36],这也为纹枯病菌致病机理研究提供了重要的信息源。
[1]邹军顺, 李新果, 马文峰. 中国玉米种植产业发展现状分析及政策建议[J]. 粮食科技与经济, 2014, 39 (1): 13-15.
[2]唐海涛, 荣延昭, 杨俊品. 玉米纹枯病研究进展[J]. 玉米科学, 2004, 12(1): 93-96.
[3]肖炎农, 李建生, 郑用链, 等. 湖北省玉米纹枯病病原丝核菌的种类和致病性[J]. 菌物系统,2002, 21(3): 419-424.
[4]夏海波, 伍恩宇, 于金凤. 黄淮海地区夏玉米纹枯病菌的融合群鉴定[J]. 菌物学报, 2008, 27(3): 360-367.
[5]牛福芳, 董明明, 赵新兰, 等. 我国部分地区玉米丝核菌组成及其致病类型分析[J]. 植物保护学报, 2009, 36(4): 289-294.
[6]李菊,夏海波,于金凤. 中国东北地区玉米纹枯病菌的融合群鉴定[J]. 菌物学报, 2011, 30(3): 392-399.
[7]荣廷昭, 李晚枕, 杨克诚, 等. 西南生态区玉米育种[M]. 北京: 中国农业出版社, 2003: 187-191.
[8]黄天述, 叶华智, 王晓鸣, 等. 玉米种质资源对纹枯病的抗性鉴定与评价[J]. 植物遗传资源学报, 2005, 6(3): 291-295.
[9]Nürnberger T.Signal perception in plant pathogen defense [J]. Cellular and Molecular Life Sciences, 1999, 55(2): 167-182.
[10]Thordal-Christensen H.Fresh insights into processes of nonhost resistance [J]. Current Opinion in Plant Biology, 2003, 6(4): 351-357.
[11]苏顺宗, 吴玲, 张晓霞, 等. 以玉米自交系18-599为受体的转基因再生体系优化[J]. 四川农业大学学报, 2013, 31(2): 122-124.
[12]熊尧宇, 李芦江, 文水清, 等. 玉米自交系08-641不同选择方向回交改良后代主要性状的配合力[J]. 玉米科学, 2012, 20(1): 10-14.
[13]龙书生, 曹远林, 李亚玲, 等. 小麦抗条锈病过敏性坏死反应中的活性氧代谢[J]. 西北农林科技大学学报, 2009, 37(11): 334-336.
[14]张小莉, 王鹏程, 宋纯鹏. 植物细胞过氧化氢的测定方法[J]. 植物学报, 2009, 44(1): 103-106.
[15]Chintamanani S, Hulbert S H, Johal G S, et al. Identification of a maize locus that modulates the hypersensitive defense response, using mutant-assisted gene identification and characterization [J]. Genetics, 2010, 184: 813-825.
[16]Nguyen H T, Leipner J, Stamp P, et al. Low temperature stress in maize (ZeamaysL.) induces genes involved in photosynthesis and signal transduction as studied by suppression subtractive hybridization [J]. Plant Physiology and Biochemistry, 2009, 47: 116-122.
[17]杨爱国, 潘光堂, 叶华智, 等. 玉米自交系纹枯病抗性鉴定及抗病资源筛选[J]. 植物保护, 2003, 29(1): 25-28.
[18]Wisser R J, Balint-Kurti P J, Nelson R J.The genetic architecture of disease resistance in maize: a synthesis of published studies [J]. Phytopathology, 2006, 96: 120-129.
[19]赵茂俊. 抗玉米纹枯病种质资源筛选及QTL定位[D]. 成都: 四川农业大学, 2004.
[20]Levine A, Tenhaken R, Dixon R, et al. H2O2from the oxidative burst orchestrates the plant hypersensitive disease resistance response [J]. Cell, 1994, 79: 583.
[21]Rohrmeier T, Lehle L.WIP1, a wound-inducible gene from maize with homology to Bowman-Birk proteinase inhibitors[J]. Plant Molecular Biology, 1993, 22: 783-792.
[22]练云, 刘允军, 王国英. 玉米受伤诱导基因wip1的启动子克隆机表达分析[J]. 中国农业科学, 2014, 47(14):2889-2896.
[23]Gutterson N, Reuber T L.Regulation of disease resistance pathways by AP2/ERF transcription factors [J]. Current in Opinion Plant Biology, 2004, 7(4): 465-471.
[24]Pre M, Atallah M, Champion A, et al. The AP2/ERF domain transcription factor ORA59 integrates jasmonic acid and ethylene signals in plant defense [J]. Plant Physiology, 2008, 147 (3): 1347-1357.
[25]Anderson J P, Lichtenzveig J, Gleason C, et al. The B-3 ethylene response factor MtERF1-1 mediates resistance to a subset of root pathogens inMedicagotruncatulawithout adversely affecting symbiosis withRhizobia[J]. Plant Physiology, 2010, 154 (2): 861-873.
[26]Zhang Gaiyuan, Chen Ming, Li Liancheng, et al. Overexpression of the soybean GmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco [J]. Journal of Experimental Botany, 2009,60(13): 3781-3796.
[27]Liang Chen, Zhang Zhengyan, Liang Hongxia, et al. Over expression ofTiERF1 enhances resistance to sharp eyespot in transgenic wheat [J]. Journal of Experimental Botany, 2008, 59 (15): 4195-4204.
[28]Sels J, Mathys J, De Coninck B M, et al. Plant pathogenesis-related (PR) proteins: A focus on PR peptides [J]. Plant Physiology and Biochemistry, 2008, 46(11): 941-950.
[29]van Loon L C.Induced resistance in plants and the role of pathogenesis-related proteins[J]. European Journal of Plant Pathology, 1997, 103(9): 753-765.
[30]Chen Zhixiang, Malamy J, Henning J, et al. Induction, modification, and transduction of the salicylic acid signal in plant defense responses [J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(10): 4134-4137.
[31]乐美旺, 陈实, 潘庆华, 等. 水稻和稻瘟病菌互作中的信号传导及防御反应基因诱导表达的研究[J]. 植物病理学报, 2007, 37(1): 42-49.
[32]王晨芳. 小麦与条锈病互作过程中活性氧迸发的组织学和细胞化学研究[D]. 杨凌:西北农林科技大学,2008.
[33]van loon L C, van Kammen A.Polyacrylamide disc electrophoresis of the soluble leaf proteins fromNicotianatabacumvar. ‘Samsun’ and ‘Samsun NN’ Ⅱ. Change in protein constitution after infection with tobacco mosaic virus[J]. Virology, 1970, 40: 190-211.
[34]Morris S W, Vernooij B, Titatarn S, et al. Induced resistance responses in maize[J]. Molecular Plant Microbe Interaction, 1998, 11: 643-658.
[35]Mittler R, Vanderauwera S.ROS signaling: the new wave?[J]. Trends in Plant Science, 2011, 16(6): 300-309.
[36]Zheng Aiping, Lin Runmao, Zhang Danhua, et al. The evolution and pathogenic mechanisms of the rice sheath blight pathogen [J]. Nature Communications, 2013, 4:1424.
(责任编辑:田喆)
Preliminary exploration of the defense mechanisms of two maize inbred lines against maize banded leaf and sheath blight
Dai Hao,Luo Liya,Zhang Cuiping,Sun Xiaofang,Gong Guoshu,Zhang Min,Chang Xiaoli
(Department of Plant Pathology, College of Agriculture, Sichuan Agricultural University, Chengdu611130, China)
Maize banded leaf and sheath blight (BLSB) is an important disease caused byRhizoctoniasolaniKühn, and screening and breeding of resistant maize germplasms is one of major strategies for disease control. In this study, after inoculation withR.solaniAG1-IA, the resistance of two inbred maize cultivars R08 and 18-599R was evaluated, and defense responses, including production of reactive oxygen species (ROS), expression of defense-related genes (PR1,ZmDREB2A,ZmERF3 andWIP1) and cell death, were examined on the detached leaves of maize seedlings at different indicated time points. The results showed that R08 was susceptible to AG1-IA, whereas 18-599R was highly susceptible. Reactive oxygen species (ROS) was accumulated in a higher level at indicated time points on the detached leaves of R08 than that of 18-599R.Expression of four defense-related genes was induced differently in timing and aptitude in the two inbred lines. Eventually, cell death appeared significantly in the leaves of R08 as compared to 18-599R.These data indicate that the difference of two maize inbred lines in resistance might be not of qualitative, but of quantitative nature, which provides significant basis for uncovering the resistance mechanism of maize toR.solani.
maize;Rhizoctoniasolani;disease resistance;ROS;defense-related gene
2015-06-14
2015-09-21
四川省教育厅一般项目(13ZB0278);四川省科技支撑计划项目(2015NZ0040)
E-mail: xl_changkit@126.com
S 435.131
A
10.3969/j.issn.0529-1542.2016.04.005
