甘蓝型油菜生殖生长期叶片和角果光合与产量关系的研究
2016-09-02王春丽王周礼杨建利陈文杰穆建新田建华赵小光
王春丽,王周礼,陈 婷,杨建利,陈文杰,穆建新,田建华, 赵小光
穆建新1,田建华1, 赵小光1
甘蓝型油菜生殖生长期叶片和角果光合与产量关系的研究
王春丽1,王周礼1,陈婷2,杨建利1,陈文杰1,穆建新1,田建华1, 赵小光1
穆建新1,田建华1, 赵小光1
(1 陕西省杂交油菜研究中心,陕西杨陵712100; 2 西北农林科技大学 农学院,陕西杨陵712100)
以11个不同适生区甘蓝型油菜品种为材料,研究了油菜生殖生长期植株叶片和角果的光合气体交换参数、光合色素含量、光合关键酶蛋白含量、主要农艺性状及其与产量的关系,探讨影响叶片(角果)光合效率及单株籽粒产量的主要因子,为油菜高产高光效品种的系统评价提供理论依据。结果显示:(1)油菜植株叶片与角果的净光合速率间相关性较小,但叶片净光合速率远大于角果。(2)叶片净光合速率与其叶绿素a+b含量及气孔导度呈不显著的正相关关系(相关系数较大),与其光合关键酶PEPC、RuBisCO蛋白含量相关系数较小或呈不显著负相关;角果(皮)净光合速率与其叶绿素a、b含量、类胡萝卜素含量及气孔导度相关性较强;光合色素含量是影响叶片、角果净光合速率的第一主因子。(3)单株叶面积、角果数及角果表面积与籽粒产量显著正相关关系,是影响籽粒产量的第一主因子;叶片净光合速率和角粒数是影响籽粒产量的第二主因子;单株生物学产量与叶面积呈显著正相关关系,角果表面积、叶面积及叶片净光合速率是影响生物学产量的第一、二主要因子。研究表明,油菜高产高光效品种的综合评价指标应首选单株角果数、叶片面积,其次选择叶片净光合速率、叶片和角果皮的叶绿素含量以及角粒数。
油菜;光合;光合色素;叶片面积;角果数; 产量
油菜在中国种植面积大、分布地区广,是中国重要的油料作物。油菜籽油是健康的食用油,约占中国食用油的40%。近年来双低油菜品种被广泛推广,其籽粒油中油酸含量提高到50%以上,亚油酸含量20%左右,亚麻酸含量达8%左右,饱和脂肪酸含量降低至7%以下,芥酸含量一般不超过5%,硫甙含量一般不高于30 μmol·g-1,油菜籽油已成为营养价值较高的优质食用油。另外,油菜籽油还是优质润滑油和潜在的生物柴油原料[1-2],被越来越多地应用于工业生产。随着中国耕地面积减少和对菜籽油需求的增加,提高油菜籽粒产量是育种及科研工作面临的一项艰巨任务。
前人的研究发现,油菜初花期、盛花期叶面积系数与干物质积累及产量呈抛物线关系,而终花期以后角果表面积系数与干物质积累及产量呈显著线性正相关[3];Müller等[4]根据冬油菜冠层面积系数得出了其生长的“S”型曲线,并根据此曲线来预测油菜籽粒产量。稻永忍等[5]的研究认为,油菜角果发育所需碳素总量的70%是由角果自身的光合作用供给的,30%是由其它器官转运来的。作者的研究发现,油菜花期叶面积及叶片光合显著影响角果数、角粒数及籽粒产量,而终花后角果表面积及角果光合显著影响千粒重、籽粒产量及籽粒含油量[6]。
关于油菜光合与产量的关系,梁颖等[7]提出影响油菜经济产量和生物学产量的主导因素是叶片叶绿素含量;周可金等[8]提出,油菜角果叶绿素含量与籽粒产量、含油量之间无显著相关,油菜产量、含油量与角果发育期间的光能利用率存在一定相关性。宋稀等[9]报道,油菜植株每角粒数、主花序有效角果数、单株有效角果数、结角密度与小区产量都显著正相关;李凤阳[10]的研究结果显示,油菜农艺性状对小区产量的直接影响由大到小排列顺序是分枝位>单株角果数>千粒重>二次分枝>第一次分枝>主茎角>角果数>每角果粒数>根茎粗>株高,且单株有效角果数与产量负相关。以上研究从不同方面考察了油菜植株绿色器官光合或植株农艺性状与产量的关系。本研究以不同适生区油菜品种为材料,首先研究了油菜植株初花期后叶片、角果光合差异及其与叶绿素含量、光合关键酶含量、气孔导度等的关系,在此基础上综合分析了油菜植株不同光合器官的光合、植株的农艺性状等对产量的影响,并总结出影响叶片(角果)光合效率及单株籽粒产量的主要因子,为油菜高产高光效品种的系统评价提供理论依据。
1 材料和方法
1.1试验材料
参试材料包括11个通过国审或省审的油菜品种,分别为‘秦油88’(Q-88)、‘秦优10号’ (Q-10)、‘秦优33 ’(Q-33)、‘蓉油8号’ (R-8)、‘沣油737’ (F-737)、‘杂1012’ (Z-1012)、‘秦优7号 ’(Q-7)、‘蓉油11’ (R-11)、‘华油2号’ (H-2)、‘沪油15’ (H-15)和‘德仲油1号’ (D-1),于2014年9月25日种植于陕西省杂交油菜研究中心试验地(陕西杨陵)。每个品种重复种植5个小区,小区面积12 m2(3.0 m×4.0 m),行距0.4 m,株距0.11 m, 种植密度约1.5万株/hm2。统一施肥,统一耕作管理,记载各品种物候期。
1.2测定指标及方法
1.2.1角果和叶片光合指标油菜盛花期测定叶片光合参数,每品种选取10株,测定倒一或倒二短柄叶。终花期后2周测定角果光合参数,各品种选取10株,测定主花序倒28~31位朝南角果。光合参数测定采用Li-6400便携式光合测定仪(USA)。测定指标包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr) 等。测定过程中采用开放式气路,自然温度条件,空气流速 500 μmol·s-1,光照强度设定为1 200 μmol·m-2·s-1。
1.2.2角果和叶片光合色素及光合酶蛋白含量于盛花期或终花后,在测定光合参数的同时,采用丙酮比色法分别测定各品种油菜叶片及角果皮叶绿素a、叶绿素b、叶绿素a+b及类胡萝卜素含量[11],并采用ELISA试剂盒检测叶片和角果皮中磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC,EC 4.1.1.31) 和1,5-二磷酸核酮糖羧化酶/加氧酶(ribulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCO,EC 4.1.1.39)含量。
1.2.3绿色角果表面积和叶面积在盛花期(2015年4月2日前后),每个品种随机选取20株,用雅欣-1241型叶面积仪测定每株叶面积,计算平均值。于终花期后第20天(5月8日),角果完全伸长膨大后,每个品种选取5株,统计单株总角果数;每株从上、中、下部均匀采摘角果50枚,沿角果开裂线小心剥开,轻轻展平角果皮并用雅欣-1241型叶面积仪测定角果皮面积,换算成单株角果表面积,并计算平均值。
1.2.4产量指标角果蜡黄时(2015年5月29日),于收获前统计单株角果总数、每角粒数。成熟期每小区收获1 m2,晾干后分别统计千粒重、生物学产量和籽粒产量。
1.3数据处理
试验数据处理及图表制作采用Excel2010和DPS V7.55分析软件。
2 结果与分析
2.1不同油菜品种植株角果和叶片光合气体交换参数比较
首先,各品种油菜植株叶片净光合速率(Pn)分别按照Q-88、Q-10、Q-33、R-8、F-737、Z-1012、Q-7、R-11、H-2、H-15、D-1的顺序逐渐减小;叶片气孔导度(Gs)大于0.90 mol·m-2·s-1的有品种Q-33、Z-1012、R-11、R-8、Q-88、H-15,其余品种均在0.90~0.70 mol·m-2·s-1范围内;叶片蒸腾速率(Tr)大于5.00 mmol·m-2·s-1品种有Z-1012、R-11、R-8、H-15、Q-33、D-1,其余的品种均在4.70 mmol·m-2·s-1左右;叶片胞间CO2浓度(Ci)较大品种有 Q-7、Q-33、Q-88、Q-10,接着依次是F-737、R-8、H-2、D-1、Z-1012、R-11(图1)。其次,植株角果Pn较大的品种有Q-7、Q-33、D-1,接着依次是品种H-15、Q-88、R-8、R-11、Z-1012、F-737、Q-10及H-2;植株角果Gs大于0.24 mol·m-2s-1的品种有R-11、D-1、Z-1012、Q-33,其余品种均小于0.24 mol·m-2·s-1;植株角果的Tr较大的品种有R-11、D-1、Z-1012、H-15、Q-33,其次是品种Q-7、Q-88、R-8、H-2、Q-10及F-737;植株角果Ci较大的有品种H-2、R-11和Q-88,接着依次是Z-1012、Q-33、R-8、Q-7、D-1、Q-10、H-15(图1)。总体上,植株叶片、角果的Pn分别与Gs、Tr、Ci相关性不明显,但Gs与Tr间相关性明显。叶片和角果的Pn在品种间变化趋势不一致,即叶片Pn较高的植株,其角果Pn不一定高。
另外,参试品种植株叶片净光合速率在28.04~25.66 μmol·m-2·s-1范围,气孔导度大于0.70 mol·m-2·s-1,胞间CO2浓度变化范围为349~305 μmol·mol-1,蒸腾速率变化范围在6.01~4.61 mmol·m-2·s-1;而植株角果净光合速率变化范围在8.12~13.28 μmol·m-2·s-1,气孔导度小于0.40 mol·m-2·s-1,胞间CO2浓度变化范围为334~279 μmol·mol-1,蒸腾速率变化范围在5.95~2.56 mmol·m-2·s-1。品种R-11、D-1、Q-88、Q-7植株叶片和角果的蒸腾速率差异不显著,其余品种叶片的蒸腾速率显著高于角果。品种Q-7、Q-33、Q-10、F-737植株叶片胞间CO2浓度显著高于角果皮,其余品种叶片与角果皮胞间CO2浓度差异不显著。总之,参试品种植株叶片净光合速率、气孔导度均远高于角果;大部分品种植株的叶片蒸腾速率显著高于角果,而大部分品种胞间CO2浓度叶片和角果间差异不显著(图1)。
2.2不同品种油菜植株角果皮和叶片光合酶蛋白及光合色素含量比较
2.2.1光合酶含量如图2所示,各参试品种油菜叶片和角果皮磷酸烯醇式丙酮酸羧化酶(PEPC)蛋白含量范围分别为0.66~0.37 IU·g-1和0.69~0.47 IU·g-1,而它们的1,5-二磷酸核酮糖羧化酶/加氧酶(RuBisCO)蛋白含量范围分别为251.80~148.38 ng·g-1和317.23~187.78 ng·g-1。总的来看,植株角果皮中RuBisCO蛋白含量显著高于相应叶片;除D-1和Q-10外,其余品种角果皮PEPC含量都显著高于叶片(图2)。
品种间比较,植株叶片、角果皮中PEPC蛋白含量较高的品种分别有D-1、Q-10、H-15、R-11和H-15、D-1、R-11、R-8,其余品种的叶片和角果皮中PEPC蛋白含量均较低;品种H-15、R-11、Z-1012植株叶片和角果皮中RuBisco酶蛋白含量较高,品种Q-88、F-737、H-2植株叶片和角果皮中的RuBisco酶蛋白含量较低。如图2所示,分别按照叶片的RuBisCO和PEPC蛋白含量由高到低排列各品种,发现角果皮中RuBisco、PEPC含量也呈现由高到低的变化趋势。显然,植株叶片的RuBisco或PEPC含量高的,角果皮中的含量相应也较高。
2.2.2光合色素含量各参试油菜品种植株叶片叶绿素a、叶绿素b、叶绿素a+b及类胡萝卜素含量分别高于1.00、0.26、1.26和0.31 mg·g-1,而角果皮中相应含量则分别低于0.26、0.09、0.34及0.10 mg·g-1(表1)。显然,叶片光合色素含量远高于角果皮。在品种间相比较,植株叶片叶绿素a、叶绿素b、a+b及类胡萝卜素含量均按照Q-10、F-737、Q-88、Q-33、Q-7、Z-1012、H-15、R-8、 R-11、D-1、H-2顺序依次逐渐减少,进一步比对前面参试品种植株叶片Pn的品种间变化趋势发现,二者具有较大相似性;同时,品种D-1植株角果皮叶绿素a、b、a+b、类胡萝卜素含量及角果Pn均较高,品种Q-10、F-737、H-2植株角果皮叶绿素a、b、a+b、类胡萝卜素含量及Pn均较低。根据以上结果推断,油菜植株叶片及角果皮的光合色素含量与其Pn间相关性较大,光合色素含量低则会影响光合作用进行。
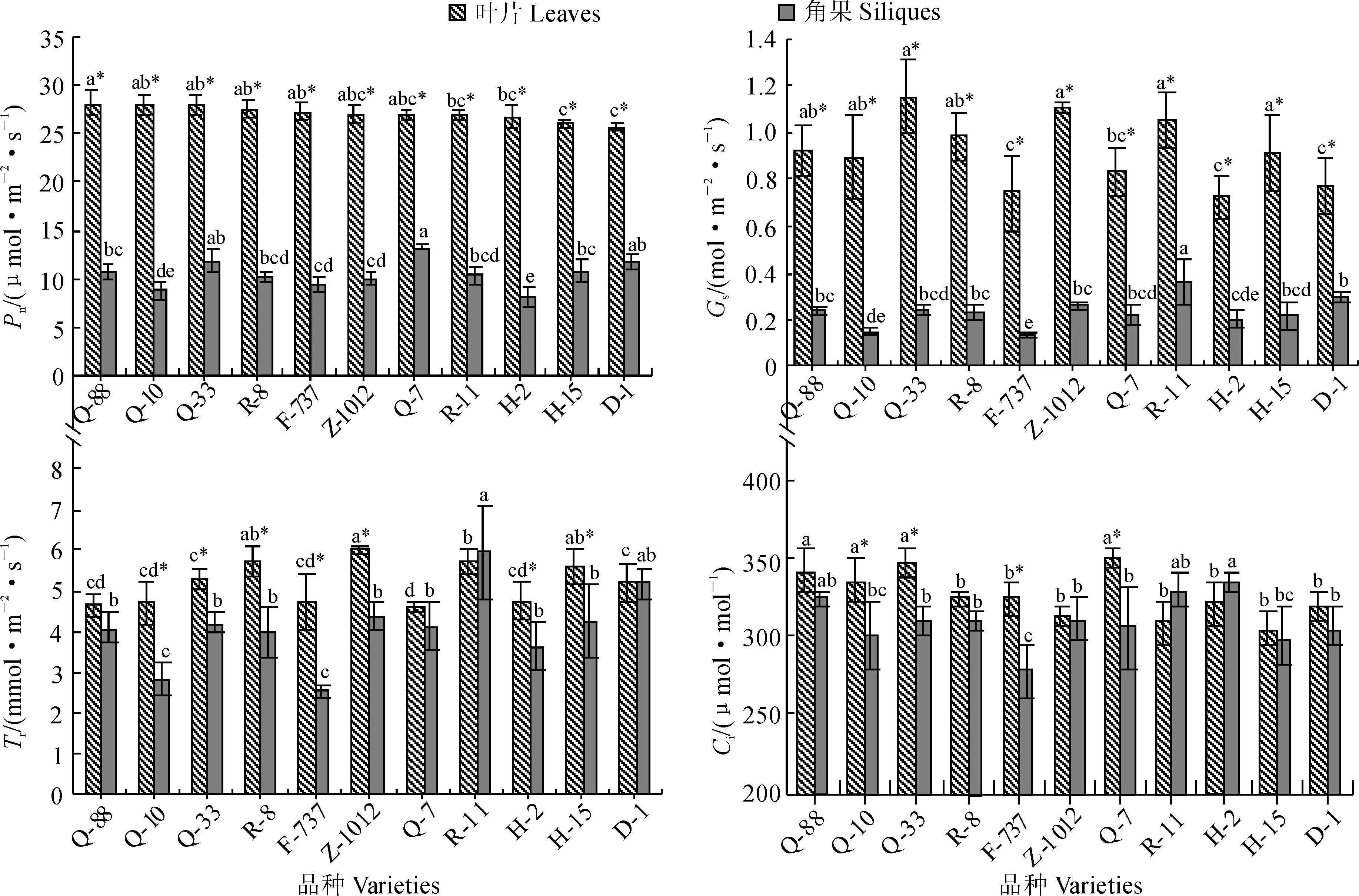
图中“*”表示叶片和角果皮间差异显著(P<0.05),柱形图上不同小写字母表示品种间差异显著(P<0.05),下同图1 不同品种油菜植株的角果和叶片的光合指标Comparing between leaves and siliques significant difference (P< 0.05) in photosynthesis indexes was presented as bars with “*”, comparing among tested varieties of oilseed rapes significant difference (P< 0.05) of photosynthesis indexes was indicated as different letters (lowercase) above bars. The same as belowFig. 1 Photosynthesis indexes of siliques and leaves of rape plants of different varieties

图2 不同品种油菜叶片和角果皮中PEPC及RuBisCO酶蛋白含量Fig. 2 Contents of PEPC and RuBisCO protein in leaves and silique shells of rape plants of different varieties
2.3不同品种油菜植株角果和叶片的光合面积及干物质积累的比较
从表2可知,不同油菜品种的单株绿色叶片表面积均大于相应角果表面积,二者比值(SS/LS)范围为0.54~0.98;角粒数变化范围为21.18~33.56,千粒重变化范围3.47~5.75 g,角果数变化范围108.22~306.32,单株籽粒产量和生物学产量分别在16.53~32.37 g、68.57~22.72 g范围内。其中,品种F-737的单株籽粒产量最高,接着依次是品种R-8、R-11、Q-10、Q-7、Q-88、H-15、Q-33、D-1、Z-1012,而品种H-2单株籽粒产量最低。各品种按照单株籽粒产量由高到低的排列,植株叶面积、角果数、角果表面积、生物学产量呈现由高到低的变化趋势,但角粒数、千粒重及每角果表面积并未表现出明显增大或减小的变化趋势。总结产量因子品种间变化规律,油菜单株籽粒产量和生物学产量的高低与角果数、叶片面积及角果表面积相关性较大,与角粒数、千粒重等相关性较小。
2.4油菜角果、叶片光合作用的主要影响因子分析
2.4.1角果、叶片净光合速率与其它光合生理参数的相关分析油菜叶片、角果的净光合速率与其它光合生理参数相关分析结果(表3)表明,叶片净光合速率与叶片叶绿素a、叶绿素b、叶绿素a+b及类胡萝卜素含量的相关系数分别为0.148、0.211、0.376、0.022,与气孔导度、蒸腾速率、胞间二氧化碳浓度相关系数是0.446、0.189、0.128,与PEPC、RuBisCO蛋白含量的相关系数分别为0.270和-0.394;而角果净光合速率与角果皮、叶绿素a、b、a+b及类胡萝卜素的相关系数分别是0.413、0.371、0.476、0.414,与气孔导度、蒸腾速率、胞间二氧化碳浓度相关系数是0.321、0.466、-0.207,与PEPC和RuBisCO蛋白含量的相关系数是-0.250和0.202,但以上相关系数均未达到显著水平(表3)。显然,叶片、角果的净光合速率均与其叶绿素a+b含量及气孔导度有较大正相关性,且角果净光合速率还与叶绿素a、b和类胡萝卜素含量、蒸腾速率间相关系数较大,而叶片和角果的光合效率与光合酶PEPC、RuBisCO蛋白含量呈负相关或相关系数较小。
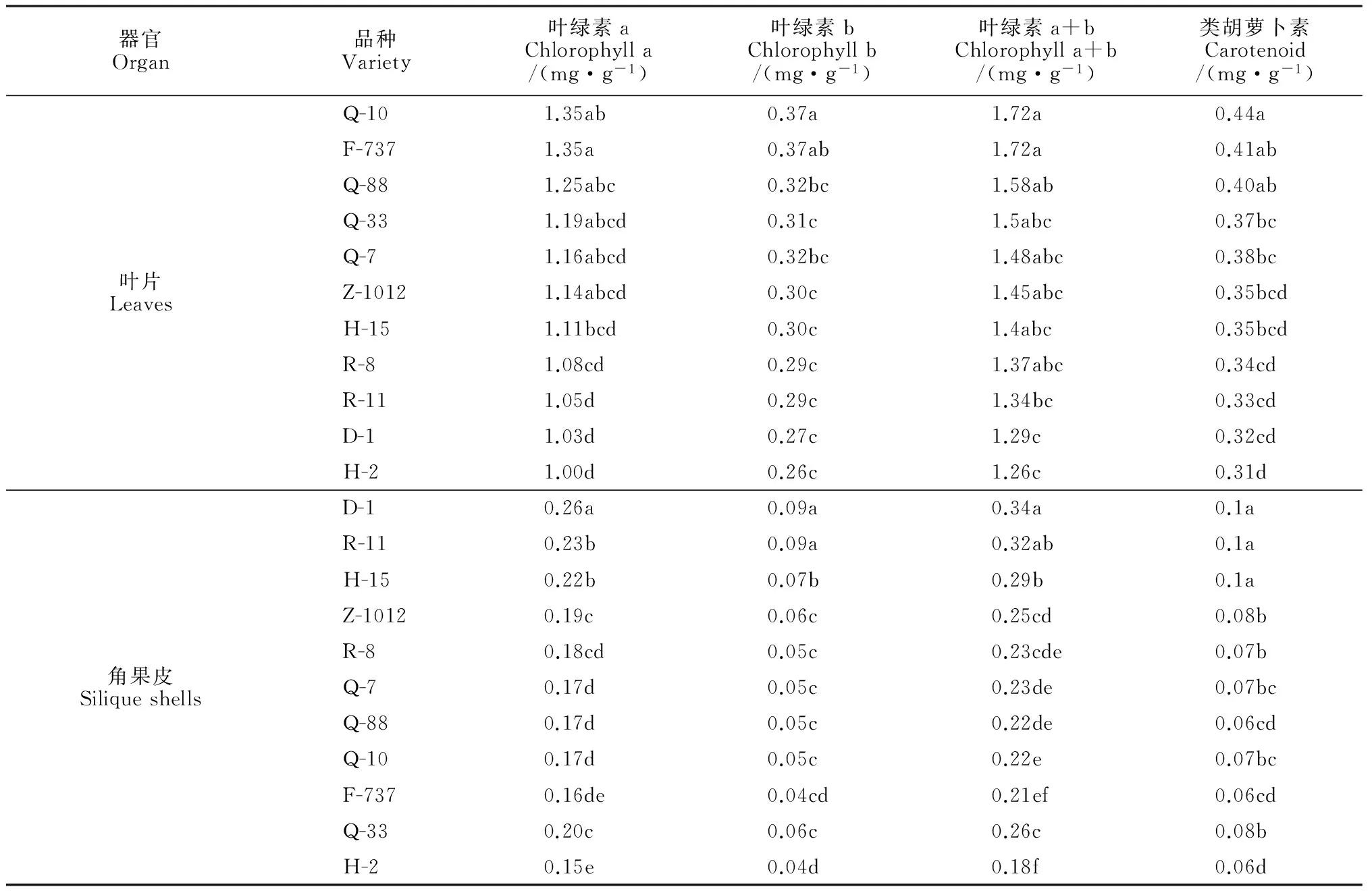
表1 不同品种油菜叶片和角果皮光合色素含量
注:光合色素含量按照样品鲜重计算;表中同列不同小写字母表示品种间差异显著(P<0.05),下同。
Note: Photosynthetic pigment content was calculated by fresh weight of the samples; in table values followed by different letters (lowercase) indicated significant difference (P<0.05) comparing among tested varieties of oilseed rape. The same as below.

表2 不同品种油菜单株叶片、角果表面积及干物质积累
2.4.2净光合速率对其它光合生理参数的主成分分析首先,对叶片净光合速率及其影响因子进行主成分分析 (表4),得到的回归方程拟合度为86.1%,相关系数为0.958,P值大于0.096,相关性不显著。其中,前4个主成分贡献率依次是51.40%、22.51%、14.35%和7.66%,累积贡献率95.91%。第一主成分包括叶片叶绿素a、b、a+b及类胡萝卜素含量;第二主成分为叶片气孔导度和蒸腾速率,第三主成分胞间CO2浓度,第四主成分分别为叶片RuBisCO、PEPC蛋白含量,与前面结果的分析基本一致。其次,角果皮净光合速率及其影响因子的主成分结果显示,回归方程拟合度为61.2%,相关系数0.782,P值大于0.05,相关性也不显著。

表3 叶片、角果净光合速率与其影响因子的相关系数
注:相关系数临界值分别为r=0.602(a=0.05,)和r=0.735(a=0.01)。*、**分别表示相关系数在0.05、0.01水平显著;下同
Note: Critical values of correlation coefficient arer=0.602(a=0.05)andr=0.735(a=0.01),respectively 。The * or ** respectively indicated that the correlation coefficient is significant at 0.05 or 0.01 level, respectively. The same as below
其中,影响角果皮Pn的前3个主成分贡献率依次是64.58%、19.22%、12.04%,累积贡献率为95.84%。第一主成分包括角果皮叶绿素a、b、a+b及类胡萝卜素含量、气孔导度和蒸腾速率,第二主成分包括RuBisCO酶含量和胞间CO2浓度,第三主成分是角果皮PEPC蛋白含量(表4)。以上结果说明,油菜植株叶片和角果皮光合速率受到光合色素、气孔导度、光合相关酶蛋白等诸多因素影响,其中的光合色素含量是最主要影响因素,其次是气孔导度及蒸腾速率。
2.5油菜单株产量的影响因子分析
2.5.1生物学产量相关分析结果表明,油菜单株生物学产量与单株叶面积相关系数为0.851,大于P<0.01临界值0.735,但与角果表面积、角果净光合速率及叶片净光合速率相关系数分别是0.554、-0.143、-0.074,后三者均未达到0.05显著水平。进一步对单株生物学产量及其相关因子进行主成分分析(表5),回归方程拟合度达82.2%,相关系数0.907,P值为0.005,达显著水平。其中,前3个主成分贡献率依次是38.04%、35.88%、17.05%,累积贡献率90.96%。影响植株生物学产量的第一、二主成分包括单株叶面积、叶片净光合速率及单株角果表面积;第三主成分为角果净光合速率。即单株叶面积、叶片净光合速率、角果表面积决定单株生物学产量70%以上。

表4 叶片和角果皮光合效率影响因子的主成分回归分析
2.5.2籽粒产量籽粒产量与其主要影响因子的相关性分析(表6)显示,叶片与角果净光合速率间相关系数较小(0.131),即植株叶片、角果光合效率的高低不一致。单株籽粒产量与单株叶面积、单株角果数、角果表面积的相关系数分别为0.724、0.915、0.791,均达到显著水平,而与其余指标相关系数绝对值较小且不显著,即单株叶片面积、角果数及角果表面积与籽粒产量显著正相关;同时,从表6还发现单株叶面积与角果数、叶片净光合速率与角粒数分别显著正相关,即叶片净光合速率及叶片对CO2的固定显著影响结角和座粒;千粒重与角果数、角果表面积显著负相关,角粒数与角果数、角果表面积的相关系数分别为-0.330、-0.391,可见随着角果数的增加,千粒重显著降低,角粒数也有减小趋势。另外,角果净光合速率与角果数、千粒重及籽粒产量的相关系数均小于0.100,与角粒数的相关系数是0.339,即角果光合效率对座粒和角粒数有一定影响。

表5 生物学产量影响因子的主成分回归分析
进一步对籽粒产量及其影响因子进行主成分分析(表7)表明,回归方程拟合度达83.2%,相关系数0.912,P值0.050,达显著水平。其中,前4个主成分贡献率依次是43.49%、26.51%、17.32%、10.50%,累积贡献率97.81%。第一主成分包括叶面积、角果数及角果表面积,决定了约43%的籽粒产量;第二主成分包括叶片净光合速率和角粒数,决定了约26%的籽粒产量;第三、四主成分包括角果净光合速率和千粒重,决定了约27%的籽粒产量。此结果与以上相关性分析结果基本一致。

表6 叶片和角果光合和单株籽粒产量的相关系数
注:相关系数临界值分别为r=0.602(a=0.05,)和r=0.735(a=0.01)
Note: Critical values of correlation coefficient arer=0.602(a=0.05,)andr=0.735(a=0.01),respectively

表7 籽粒产量的主成分回归分析
3 讨 论
油菜干物质的生产依赖于冠层对光照的吸收和利用效率,其籽粒的90%~95%来自光合产物,相同的光照条件下,叶片的光合效率高于角果[12-14]。油菜植株开花前叶片和绿色茎杆是主要光合器官,开花后叶面积指数迅速降低,角果膨大伸长、表面积逐渐增加[15]。终花后2周,角果固定的CO2就超过了叶片[12]。本研究考察了不同品种油菜植株的叶片和角果光合特征,发现盛花期叶片的净光合速率、气孔导度远远大于终花后角果的同类指标,并且盛花期叶片光合面积大于终花后绿色角果表面积,因此推断,花期叶片固定CO2的量超过终花后的绿色角果。虽然油菜植株叶片和角果具有相同的遗传基因,但二者组织分化不同,其光合情况差异很大。如本研究结果显示,叶片光合色素含量、净光合速率、气孔导度远高于角果皮;各品种植株叶片和角果的光合效率间相关系数较小,叶片净光合速率较高的植株,其角果光合效率不一定高。
植物PEPC不仅是C4循环光合固碳的关键酶之一,而且还参与植物体内多个代谢过程。将玉米 PEPC 基因转入水稻,虽不能提高水稻的光合速率,但减少了干旱胁迫下光合速率的下降[16]。在重度干旱胁迫下, PEPC基因过表达增强了干旱胁迫下水稻抵御强光胁迫的能力[17]。Bandyopadhyay 等[18]将完整的玉米PEPC基因整合进籼稻中,观察到在高温下转基因籼稻的光合速率得到了提高,但是产量并没有变化。另外,PEPC也是控制植物种子中蛋白质和脂肪酸合成的关键酶之一[19],抑制其活性可以提高植物体中脂肪酸的含量[20]。陈锦清等[21]用反义PEPC基因转化油菜,籽粒含油量比对照最高增加15%以上,且油脂含量与蛋白质含量呈显著负相关,据此认为底物竞争调控籽粒蛋白质和油脂比率。植物RuBisCO是调节光合和光呼吸的另一关键酶,属于别构酶,光照、Mg2+浓度、pH值、NADPH、RuBisCO活化酶等都可参与其活性的调节;植物RuBisCO也是一种重要的储藏蛋白,占植物体内可溶性蛋白质的50%左右[22-23]。本研究中,植株叶片和角果皮PEPC、RuBisCO酶蛋白含量与净光合速率呈负相关或相关系数较小;植株叶片的光合效率远高于角果,但参试的所有品种角果皮中RuBisco酶、及大部分品种角果皮PEPC酶蛋白含量显著高于叶片。推测油菜体内只有部分PEPC、RuBisCO被活化并参与了光合暗反应,而叶片、角果净光合速率的高低取决于组织中被活化的PEPC、RuBisCO酶的量。本研究中,植株叶片RuBisCO、PEPC蛋白含量高的品种,其植株角果皮中的含量也有升高的趋势,可能是由于叶片和角果基因相同。
植物的光合效率与组织中叶绿素含量密切相关,前人对59 个水稻品种的研究发现剑叶总叶绿素及叶绿素a、b 含量与其净光合速率正相关性显著或接近显著水平[24],对冬小麦研究发现同一季节内叶片叶绿素含量与光合速率呈显著正相关[25]。气孔导度是影响植物光合的另一主要因子,外施甲醇/乙醇能提高油菜叶片光合效率的同时,气孔导度也显著增大[26]。本研究发现,油菜植株叶片、角果净光合速率与其光合色素含量相关性较明显,其中叶绿素a+b与净光合速率存在不显著正相关,叶片、角果的叶绿素a、b、a+b及类胡萝卜素含量是影响净光合速率的第一主因子;且光合色素含量对光合效率的影响大于PEPC、RuBisCO含量,显然光合色素(叶绿素)含量在叶片、角果光合作用中意义重大。本研究还发现,角果气孔导度远小于叶片,角果、叶片的气孔导度均与其净光合速率间相关系数较大,角果的蒸腾速率与其净光合速率间相关系数较大,气孔导度、蒸腾速率是影响叶片、角果净光合速率的第一、二主因子。可见,气孔因子及光合组织的蒸腾对油菜叶片、角果光合作用有一定影响,今后相关研究有待进一步加强。
油菜光合速率及光合产物的分配对产量影响很大,花期叶片是植株固定CO2的主要器官,其光合的产物储存于茎杆,是植株生长、开花、分枝、座果及幼角、幼粒生长发育的主要营养来源。结角、座粒和籽粒灌浆期同化产物的供应决定了植株有效角果的形成,而植株有效角果数是影响籽粒产量的主要因子,同时这一时期的营养供应也决定了座粒及幼粒的生长[9,14,15,27]。与前人的研究结果一致,本研究发现,品种间比较,随着单株籽粒产量由高到低,植株的生物学产量、单株角果数、叶片面积及角果表面积也表现出降低趋势,但角粒数、千粒重并未表现出明显增大或减小的变化趋势;植株叶片面积、角果数及角果表面积与籽粒产量显著正相关,叶片净光合速率与角粒数相关性显著;植株叶片面积、角果数、叶片净光合速率及角粒数分别是影响籽粒产量的第一、二主因子;角果表面积、叶片净光合速率及叶面积是影响生物学产量的第一、二主因子。总之,叶面积、角果数(或角果表面积)、叶片净光合速率及角粒数与籽粒产量及生物学产量紧密相关。
终花后角果是光合作用和利用同化产物的主要器官,角果的光合产物主要供应角果及籽粒的生长发育;从籽粒灌浆直至成熟,籽粒是干物质积累的主要器官[27]。本研究发现,植株角果数、角果的光合面积分别与千粒重显著负相关,与角粒数呈不显著负相关,这可能是由于角果数越多(角果表面积越大),同化产物的分配到每个角果及籽粒的越少,影响了角果座粒及籽粒生长,使角粒数及千粒重减少。本研究还发现,角果净光合速率与角粒数为不显著正相关,说明提高角果光合效率,有利于角果座粒和籽粒发育。
[1]SULEK M W, KULCZYCHI A, MALYSA A. Assessment of lubricity of compositions of fuel oil with biocomponents derived from rape-seed [J].Wear, 2010,268:104-108.
[2]STEPHENSON A L, DENNIS J S, SCOTT S A. Improving the sustainability of the production of biodiesel from oilseed rape in the UK [J].ProcessSafetyandEnvironmentalProtection, 2008,86: 427-440.
[3]戴敬, 郑伟,喻义珠,等.油菜花后光合面积变化及其与产量的关系[J]. 中国油料作物学报,2001,23(2): 19-22.
DAI J, ZHENG W, YU Y Z,etal. The relationship between yield and photosynthetic area after flowering in rapeseed [J].ChineseJournalofOilCropSciences, 2001,23 (2): 19-22.
[4]MÜLLER J, BEHRENS T, DIEPENBROCK W. Use of a new sigmoid growth equation to estimate organ area indices from canopy area index in winter oilseed rape (BrassicanapusL.) [J].FieldCropsResearch, 2006,96(2-3): 279-295.
[5]稻永忍, 玖村敦彦, 村田吉男,等.关于油菜的物质生产的研究—角果的光合作用、呼吸作用及碳素代谢[J]. 中国油料, 1981, (3): 74-79
INANAGA S, KUMURA N, MURATA Y,etal. Research on material production on rapeseed-photosynthesis, respiration and carbon metabolism of pod[J].ChineseJournalofOilCropSciences, 1981, (3): 74-79.
[6]WANG C L, HAI J B, YANG J L,etal. Influence of leaf and silique photosynthesis on seeds yield and seedsoil quality of oilseed rape (BrassicanapusL.)[J].EuropeanJournalofAgronomy, 2016,74: 112-118.
[7]梁颖,李加纳, 唐章林,等.油菜光合生理指标与产量的关联分析[J]西南农业大学学报, 1999,21(3):244-247.
LIANG Y, LI J N, TANG Z L,etal. Correlative analysis of photosynthesis physiological targets and yield of rape[J].JournalofSouthwestAgriculturalUniversity, 1999,21(3):244-247.
[8]周可金,肖文娜,官春云.不同油菜品种角果光合特性及叶绿素荧光参数的差异[J].中国油料作物学报, 2009,31(3): 316-321.
ZHOU K J, XIAO W N, GUAN C Y. Analysis on photosynthetic characteristics and chlorophyll fluorescence of siliques for different winter rapeseed varieties (BrassicanapusL.)[J].ChineseJournalofOilCropSciences, 2009,31(3): 316-321.
[9]宋稀,刘凤兰,郑普英,等.高密度种植专用油菜重要农艺性状与产量的关系分析[J]. 中国农业科学, 2010,43 (9): 1 800-1 806.
SONG X,LIU F L, ZHENG P Y,etal. Correlation analysis between agronomic traits and yield of rapeseed (BrassicanapusL.)for high-density planting[J].ScientiaAgriculturaSinica, 2010,43 (9): 1 800-1 806.
[10]李凤阳.不同肥密条件下早熟油菜光合特性研究[D].长沙:湖南农业大学,2012.
[11]高俊凤.植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 74-77.
[12]GAMMELVIND L H, SCHJOERRING J K, MOGENSEN V O,etal. Photosynthesis in leaves and siliques of winter oilseed rape (BrassicanapusL.)[J].PlantSoil, 1996,186(2): 227-236.
[13]HABEKOTTÉ B. Evaluation of seed yield determining factors of winter oilseed rape (BrassicanapusL.) by means of crop growth modeling[J].FieldCropsResearch, 1997,54: 137-151.
[14]WANG X, MATHIEU A,etal. Variability and regulation of the number of ovules, seeds and pods according to assimilate availability in winter oilseed rape (BrassicanapusL.)[J].FieldCropsResearch, 2011,122 (1): 60-69.
[15]DIEPENBROCK W. Yield analysis of winter oilseed rape (BrassicanapusL.): a review[J].FieldCropsResearch, 2000,67(1): 35-49.
[16]周宝元,丁在松, 赵明.PEPC过表达可以减轻干旱胁迫对水稻光合的抑制作用[J].作物学报,2011,37(1): 112-118.
ZHOU B Y, DING Z S, ZHAO M. Alleviation of drought stress inhibition on photosynthesis by over expression of PEPC gene in rice[J].ActaAgronomicaSinica, 2011,37(1): 112-118.
[17]丁在松, 周宝元, 孙雪芳, 等. 干旱胁迫下PEPC过表达增强水稻的耐强光能力[J].作物学报,2012,38(2):285-292.
DING Z S, ZHOU B Y, SUN X F,etal. High light tolerance is enhanced by overexpressed PEPC in rice under drought stress[J].ActaAgronomicaSinica,2012,38(2):285-292.
[18]BANDYOPADHYAY A, DATTA K, ZHANG J,etal. Enhanced photosynthesis rate in genetically engineered indica rice expressing pepc gene cloned from maize[J].PlantScience, 2007,172(6): 1 204-1 209.
[19]汪小福, 刘仁虎, 陈笑芸, 等. 甘蓝型油菜磷酸烯醇式丙酮酸羧化酶的研究分析[J]. 浙江农业学报, 2010,22(3): 276-280.
WANG X F, LIU R H, CHEN X Y,etal. Analysis ofBrassicanapusphosphoenolpyruate carboxylase (PEPC)[J].ActaAgriculturaeZhejiangensis, 2010,22(3): 276-280.
[20]魏绍巍, 黎茵. 植物磷酸烯醇式丙酮酸羧化酶的功能及其在基因工程中的应用[J]. 生物工程学报, 2011,27(12): 1 702-1 710.
WEI S W, LI Y. Functions of plant phosphoenolpyruvate carboxylase and its applications for genetic engineering[J].ChineseJournalofBiotechnology, 2011,27(12): 1 702-1 710.
[21]陈锦清, 郎春秀,等.反义PEP基因调控油菜籽粒蛋白质/油脂含量比率的研究[J].农业生物技术学报, 1999,7(4): 316-320.
CHEN J Q, LANG C X,etal. Antisense PEP gene regulates to ratio of protein and lipid content inBrassicanapusseeds[J].JournalofAgriculturalBiotechnology, 1999,7(4): 316-320.
[22]韩鹰, 陈刚, 王忠.Rubisco活化酶的研究进展[J].植物学通报, 2000,17(4):306-311.
HAN Y, CHEN G, WANG Z. The progresses of studies on rubisco activase[J].ChineseBulletinofBotany, 2000,17(4):306-311.
[23]陈为钧, 赵贵文, 顾月华. RubisCO的研究进展[J]. 生物化学与生物物理进, 1999,26(5): 433-436.
CHEN W J, ZHAO G W, GU Y H. Advance of ribulose-1,5-bisphosphate carboxylase/oxygenase (RubisCO)[J].ProgressinBiochemistryandBiophysics, 1999,26(5): 433-436.
[24]孟军, 陈温福, 徐正进, 等.水稻剑叶净光合速率与叶绿素含量的研究初报[J].沈阳农业大学学报,2001,32(4): 247-249.
MENG J, CHEN W F, XU Z J,etal. Study on photosynthetic rate and chlorophyll content[J].JournalofShenyangAgriculturalUniversity, 2001,32(4): 247-249.
[25]张秋英, 李发东, 刘孟雨.冬小麦叶片叶绿素含量及光合速率变化规律的研究[J].中国生态农业学报, 2005,13(3): 95-98.
ZHANG Q Y, LI F D, LIU M Y. Changing laws of chlorophyll content and photosynthetic rate in winter wheat leaves[J].ChineseJournalofEco-Agriculture, 2005,13 (3): 95-98.
[26]赵艳.甲醇和乙醇促进油菜生长和光合作用的分子机理研究[D].昆明:昆明理工大学, 2010.
[27]ROOD S B,MAJOR D J,CHARNETSKI W A. Sasonal changes in14CO2assimilation and14C translocation in oilseed rape[J].FieldCropsResearch, 1984,8: 341-348.
(编辑:裴阿卫)
Relationship between Yield and Photosynthesis of Leaf and Silique of DifferentBrassicanapusL. Varieties during Reproduction Period
WANG Chunli1, WANG Zhouli1, CHEN Ting2, YANG Jianli1,>CHEN Wenjie1, MU Jianxin1, TIAN Jianhua1, ZHAO Xiaoguang1
(1 Hybrid Rapeseed Research Center of Shaanxi Province, Yangling, Shaanxi 712100, China; 2 College of Agronomy, Northwest A&F University; Yangling, Shaanxi 712100,China)
Taking 11BrassicanapusL. varieties of different suitable areas as material, we examined the photosynthetic gas exchange parameters, photosynthetic pigment contents and key enzyme protein contents in leaf and silique of plants during reproductive growth period, also investigated agronomic characters, relationship between yield and photosynthesis of the plants; The study aimed to explore main factors affecting photosynthetic efficiency of leaves (siliques) and seeds yield per plant, thus elaborating a theory evidence to systematically assess rape variety with high yield and high photosynthesis efficiency. Results showed that: (1) Net photosynthesis efficiency was hardly correlative among leaves and siliques, and net photosynthesis efficiency of leaves was far higher than that of siliques. (2) Net photosynthetic efficiency of leaves not significantly positive-correlated with chlorophyll a+b and carotenoid contents(correlation coefficients were higher), and, not significantly negative-correlated with PEPC, RuBisCO protein content of leaves, or the correlation coefficients among net photosynthetic efficiency and PEPC, RuBisCO protein contents were lower. Correlation coefficients of net photosynthetic efficiency and chlorophyll a, b, carotenoid contents, photosynthetic stomatal conductance of silique (shell) were higher. Photosynthesis pigment contents were first principal factor influenced photosynthesis efficiency of leaves and silique. (3) Leaf area, silique number and silique surface area significantly correlated with seeds yield of rape plant. These indexes were attributed to first principal factors influenced the seeds yield; similarly, net photosynthetic efficiency of leaves and seed number per silique were attributed to second principal factor influenced the seed yield. Significantly, leaf area and biological yield was correlated, the silique surface area, leaf surface area and leaf net photosynthetic efficiency were statistically attributed to primary or second principal factors influenced biological production of a rape plant. Thus leaf area and silique number per plant are primary indexes, and leaf net photosynthesis efficiency, chlorophyll content of leaves and silique shell, and, seed number per silique are second indexes in assessing rape variety with high light efficiency and high yield.
oilseed rape; photosynthesis; photosynthesis pigments; leaves area; siliques number; yield
1000-4025(2016)07-1417-10
10.7606/j.issn.1000-4025.2016.07.1417
2015-10-20;修改稿收到日期:2016-07-06
陕西省自然科学基础研究计划(2014JM2-3023)
王春丽(1969-),女,博士,主要从事植物生理生化研究。E-mail: chliwang262@163.com
Q945.79
A
