四国药典胰酶标准浅析
2016-08-31黄素娟刘莉莎范慧红
黄素娟,刘莉莎,范慧红Δ
(1.中国食品药品检定研究院,北京 100050;2.中国药科大学,江苏 南京 211100)
四国药典胰酶标准浅析
黄素娟1,2,刘莉莎1,范慧红1Δ
(1.中国食品药品检定研究院,北京 100050;2.中国药科大学,江苏 南京 211100)
本文阐述了中国药典、美国药典、英国药典、日本药局方中胰酶标准的历史沿革,并对现行版四国药典胰酶标准进行比较和讨论,发现各国药典胰酶标准各有异同,其中活力限度要求差异较大,应予以重视,就效价测定方法而言,美国药典、英国药典的方法更为合理。
胰酶;中国药典;美国药典;英国药典;日本药局方;效价测定
胰酶是从猪、羊或牛胰中提取的多种酶混合物,主要为胰蛋白酶、胰淀粉酶和胰脂肪酶。临床上广泛用于消化不良及肝、胰腺疾病引起的消化障碍,尤其是胆囊纤维变性疾病。胰酶的使用有一定的历史,早在20世纪五六十年代已经被各国药典收录,至今仍广泛使用。目前,国内现有胰酶药品共有批准文号84个,其中有2个进口药品,制剂包括片剂、肠溶胶囊以及复方制剂,相关生产单位53家。通过查阅中国药典、美国药典、英国药典和日本药局方,发现各国药典胰酶的质量标准各不相同,尤其是胰酶中胰蛋白酶、胰淀粉酶和胰脂肪酶三酶的限度、效价单位以及相应测定方法,应当引起重视。本文对各国药典胰酶标准进行对比讨论,旨在发现异同并为胰酶的质量研究提供参考。
1 四国药典胰酶收载概况
1.1 历史沿革 第一版中国药典(1953年版)开始收载胰酶,最初标准的检测项目仅包含性状、脂肪、酪蛋白转化量。直至1977年版药典,标准中效价测定修订为采用半定量的比浊法测定胰酶中胰蛋白酶的活力,方法误差较大;脂肪限度由原标准不得超过30 mg提高到不得超过20 mg。随着药典不断更新修订,胰酶的标准要求也有所变化。1985年版药典,胰酶标准增加了干燥失重项目,开始规定胰酶中胰蛋白酶、胰淀粉酶、胰脂肪酶三酶活力限度,并建立起相应效价测定方法,一直沿用至今。2010年版药典新增微生物限度。
美国药典于1955年版(第15版)开始收载胰酶,标准要求检查性状、脂肪、胰蛋白酶与胰淀粉酶活力,其酶活力测定方法分别为简单的比浊法与比色法。在1970年版(第18版)建立了新的胰蛋白酶测定方法,以胰酶标准品做标准曲线,采用紫外分光光度法在280 nm下测定效价。此外,该版本首次要求限定微生物不得检出沙门氏菌,直至2015年版(第38版)新增该项下不得检出大肠杆菌。在1975年版(第19版)增加干燥失重测定项以及胰脂肪酶效价限度。用胰酶标准品绘制标准曲线,并采用pH指示连续滴定法测定胰脂肪酶活力。在1990年版(第22版)胰淀粉酶效价测定方法由原比色法更新为使用标准品的相对法。2000年版(第24版)开始使用胰淀粉酶胰蛋白酶混合标准品测定胰淀粉酶和胰蛋白酶的效价,胰脂肪酶标准品测定胰脂肪酶效价,方法至今未变。
英国药典1953年版到1968年版胰酶标准比较简单,规定检测项目有性状、鉴别、酶活力,其中胰蛋白酶及胰淀粉酶活力测定方法采用比色法,胰脂肪酶采用pH指示滴定法。1973年版,增加微生物限度、干燥失重,并开始规定胰蛋白酶、胰脂肪酶、胰淀粉酶三酶效价,建立效价测定新方法。其中胰蛋白酶以胰酶标准品做标准曲线,采用紫外分光光度法在280 nm下测定效价。胰脂肪酶的效价测定以橄榄油为底物,牛胆盐溶液为激活剂,开始使用标准品定量,胰淀粉酶仍采用比色法定量。1980年版,胰蛋白酶效价测定法的检测波长由280 nm改为275 nm,胰脂肪酶效价测定方法中激活剂由原标准牛胆盐溶液改用牛磺胆酸钠。1988年版,胰淀粉酶效价测定方法更新,开始使用标准品进行效价测定。
日本药局方从1986年版(第11版)到1991年版(第12版),胰酶标准检查项目有性状、脂肪、酸败、干燥失重、炽灼残渣,并要求对胰蛋白酶和胰脂肪酶活力进行测定,采用了半定量方法。1996年版(第13版)开始限定胰酶中三酶效价并相应建立新的测定方法。
由四国药典胰酶标准的历史沿革可见,胰酶的标准在长时间内检测项目的增补及提高较少。效价测定的方法由半定量到定量,由绝对到相对,逐步提高方法的专属性和合理性。从标准提高的进程来看,美国药典、英国药典发展要比我国稍快。美国药典早在1955年版开始要求胰酶效价测定,英国药典于1973年版增加胰酶中三酶效价测定,中国药典直到1985年版才新增三酶效价测定项。
1.2 现行版四国药典胰酶标准对比 现行版四国药典对胰酶定义及性状的描述基本一致,均对胰酶中胰蛋白酶、胰淀粉酶、胰脂肪酶三酶的效价进行了明确的限度规定,但是由于效价的定义和测定方法均不相同(见下文),各国限度也均不一致。鉴别项仅有英国药典要求按照相应方法检测胰淀粉酶和胰脂肪酶。对于脂肪的检测,中国药典和日本药局方要求较美国药典和英国药典更为严格。此外,日本药局方没有对微生物限定,而是通过检测酸败来进行安全性检查。各国药典对胰酶的标准中均没有纯度、有关物质以及重金属等检查项目。胰酶药典中质控项目规定见表1。
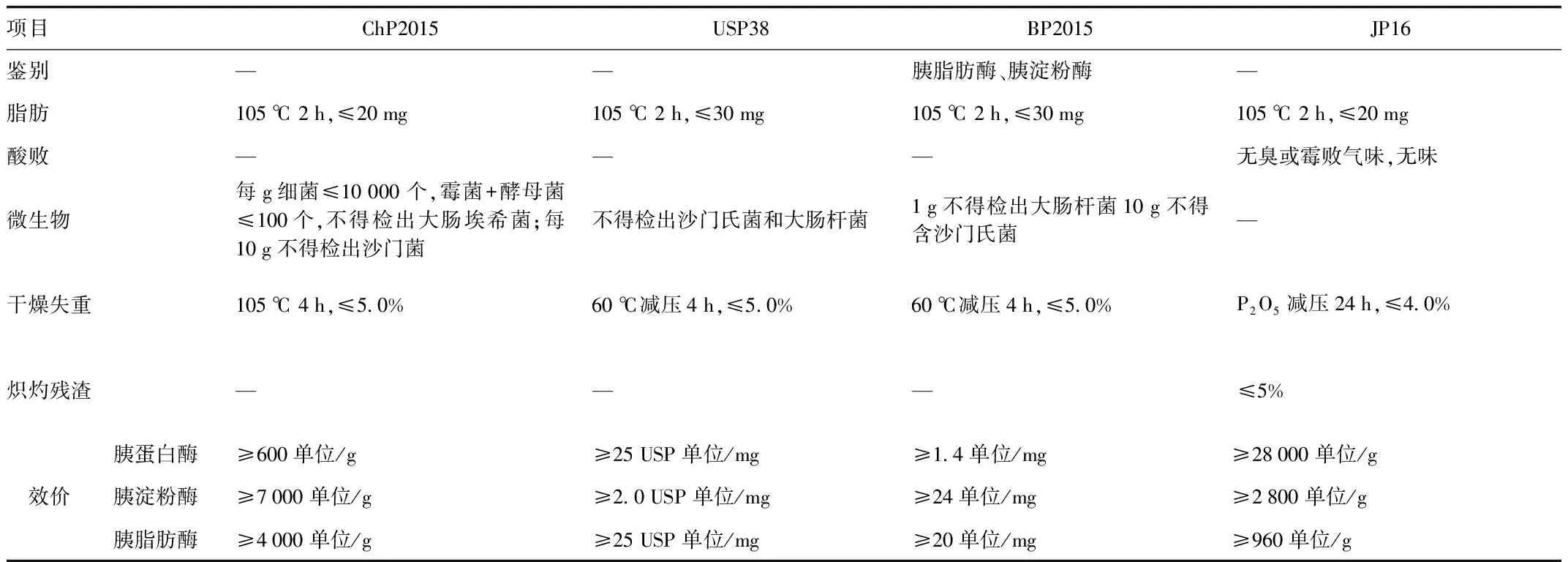
表1 现行版四国药典胰酶标准
-表示未规定,means not provided
2 现行版四国药典胰酶效价测定方法比较
酶类药物以活力来确保其有效性,可见效价测定至关重要,但是各国胰酶效价测定法以及酶活力单位的定义都各有不同。胰酶主要含胰蛋白酶、胰淀粉酶和胰脂肪酶,下面就现行版四国药典分别对此三酶的效价测定方法进行阐述。


表2 现行版四国药典胰酶中胰蛋白酶效价测定Tab.2 The latest edition of trypsase potency determination in four countries’ pharmacopeia
2.2 胰淀粉酶 胰淀粉酶可作用于α-1,4-糖苷键催化淀粉水解,终产物为麦芽糖和葡萄糖[5-6],各国药典均通过终产物的定量来确定酶的效价。中国、美国、英国药典均采用次碘酸法,利用碘在碱性溶液中生成具有强氧化性的次碘酸盐与糖中的醛基结构反应,使葡萄糖转化为葡萄糖酸,用硫代硫酸钠滴定剩余碘量,达到定量测定胰淀粉酶活力的目的。中国药典直接以硫代硫酸钠滴定液滴定供试品反应后的剩余碘量,进而计算胰淀粉酶活力。美国、英国药典方法相似,利用已知活力单位的标准品与供试品平行测定,以相应的结果比值来计算,将标准品的活力单位量值传递给供试品,从而达到测定目的。日本药局方测定方法则是先用斐林试剂与淀粉水解产物葡萄糖反应生成氧化亚铜,再加入硫酸与碘化钾,经进一步反应生成碘单质,用硫代硫酸钠定量滴定碘生成量来确定胰淀粉酶的效价。

表3 现行版四国药典胰酶中胰淀粉酶效价测定Tab.3 The latest edition of pancreatic amylase potency determination in four countries’ pharmacopeia
2.3 胰脂肪酶 各国最新版药典中胰酶的胰脂肪酶效价测定原理均为:胰脂肪酶能裂解大分子底物,在一定条件下把甘油三酯类脂肪逐步水解,终产物为甘油及相应的脂肪酸[5-6],采用一定方法检测脂肪酸的生成量即可确定胰脂肪酶的活力。中国、美国、英国药典所用的方法是pH指示连续滴定法,保持滴定体系的pH稳定,用已知浓度碱液滴定水解液,定量测定胰脂肪酶的活力。中国药典直接以氢氧化钠滴定液滴定供试品水解液中的酸量,进而确定胰脂肪酶活力。而美国药典和英国药典均用了相应的标准品测定,美国药典中根据测定时的滴定时间和滴定液消耗体积作相关曲线,用其中滴定液消耗速率恒定的直线段上的点计算产酸速率,通过比较供试品与标准品的酶活力确定供试品中胰脂肪酶是否符合限度要求;英国药典则参照标准品耗碱量来计算供试品的胰脂肪酶活力。日本药局方采用反滴定法,首先加入过量氢氧化钠,再用盐酸返滴定,通过氢氧化钠消耗的量来确定胰脂肪酶活力。

表4 现行版四国药典胰酶中胰脂肪酶效价测定Tab.4 The latest edition of pancrelipase potency determination in four countries’ pharmacopeia
综上所述,四国药典中胰酶效价测定方法原理基本一致,但中国药典和日本药局方均采用绝对法,而美国、英国药典采用了法定标准品,其中英国药典采用欧洲药典会提供的胰酶标准品,均从猪的胰脏中分离提纯获得。美国、英国药典采用相对法以法定标准品为参照进行胰酶的效价测定,更为合理。
3 小结
综观四国药典中胰酶收载情况,其标准规定在一些方面趋于一致,一些方面又存在差别。从历史沿革看,胰酶标准修订的进展较慢,各国标准中测定的项目也不多,这与酶本身的特性有关,胰酶乃至众多的酶类药物在质量标准中很少有纯度、有关物质的检测,这是酶类药物安全性控制研究过程中值得思考并且需要突破的问题。胰酶是一种混合酶制剂,除了胰蛋白酶、胰脂肪酶和胰淀粉酶外,还可能存在其他酶[7],这对于胰酶的使用存在安全性风险。酶的效价决定了酶的有效性,效价测定的重要性不言而喻,比较四国药典发现,就胰酶效价测定方法而言,日本药局方中的方法相对简单,我国药典所使用的方法是绝对法,一直未用到标准品,美国药典与英国药典方法趋于一致,均采用了相对法,以标准品为基准,方法更具合理性。找出并认识各国药典间的标准差异,为缩小差距奠定基础。随着用药安全要求的不断提高,我国有必要将药典标准不断改善,尝试研制胰酶标准品,采用相对法测定效价,使之更为合理,以更好地保障胰酶药品的安全、有效、质量可控。
[1] 中国药典ChP[S].1953年版-2015年版.
[2] 美国药典 USP[S].第15版-第38版.
[3] 英国药典BP[S].1953年版-2015年版.
[4] 日本药局方JP[S].第11版-第16版.
[5] 陈乐仪,关祖真,梁玉玲,等.胰酶中脂肪酶、淀粉酶、蛋白酶活力测定方法的研究[J].生化药物杂志,1985,01:48-57.
[6] 游文素.胰酶酶活力测定方法分析[J].中国药业,2000,9(5):23.
[7] 刘湘新,唐小武,刘进辉,等.胰酶的制备与生物活性测定[J].中兽医医药杂志,2006,6:35-37.
(编校:吴茜)
Analysisonthepancreatinstandardsoffourcountries’pharmacopoeia
HUANG Su-juan1,2, LIU Li-sha1, FAN Hui-hong1Δ
(1.National Institutes for Food and Drug Control, Beijing 100050;2.China Pharmaceutical University,Nanjing 211100,China)
The history about pancreatin standards in different pharmacopeia, i.e.the Chinese Pharmacopoeia (ChP), the United States Pharmacopoeia (USP), the British Pharmacopoeia (BP), and the Japanese Pharmacopoeia (JP) were clarified in this paper.As well as the latest edition of pancreatin standards in different pharmacopeia were compared and discussed.There are many similarities and differences of the pancreatin standards between ChP and the three other pharmacopoeias.We should attach importance to the significant difference of the potency limitation in four countries’ pharmacopoeia.Otherwise,the potency test method of pancreatin in USP and BP is more reasonable.
pancreatin; Chinese Pharmacopoeia; the United States Pharmacopoeia; British Pharmacopoeia; Japanese Pharmacopoeia; potency determination
10.3969/j.issn.1005-1678.2016.10.002
黄素娟,女,硕士在读,研究方向:生化药物分析,E-mail: susuhappy138@163.com;范慧红,通信作者,女,博士,研究员,研究方向:生化药物分析,E-mail: shenghuayaoshi@126.com。
中国食品药品检定研究院2015年中青年发展研究基金(2015A02)
R921
A
