粉红香水百合离体培养与植株再生
2016-08-12涂红艳华秀香梁什娟
涂红艳,肖 望,华秀香,梁什娟
(广东第二师范学院 生物与食品工程学院, 广东 广州 510303)
粉红香水百合离体培养与植株再生
涂红艳,肖望*,华秀香,梁什娟
(广东第二师范学院 生物与食品工程学院, 广东 广州 510303)
摘要:以粉红香水百合花丝、花柱和子房为外植体进行了离体培养,研究了不同外植体和植物生长调节物质对其愈伤组织的诱导及植株再生的影响.结果表明:三种外植体中,花丝愈伤组织诱导率最高,在光照条件下为40%,在黑暗条件下为50%.培养基中含有2.0 mg/L picloram有利于进行愈伤组织增殖,增殖倍数高达6.29;愈伤组织分化成小鳞茎最佳培养基为MS+2.0 mg/L 6-BA+0.2 mg/L NAA;在MS+1.5 mg/L NAA+ 0.1% 活性炭的生根培养基中,生根效果最好.再生植株经过驯化移栽到室外,30 d后成活率为90%.
关键词:粉红香水百合;离体培养;植株再生
0引言
香水百合(LiliumcasaBlanca)是百合科(Liliaceae)百合属(Lilium)东方百合杂交系统的多年生草本植物.香水百合花朵硕大,花色美丽,香气芬芳四溢,深受人们喜爱.香水百合的生长期较长,约110d,品种丰富,颜色有白色、粉红色、紫色,白色带红色斑点,红色带紫色斑点等,目前已成为花卉市场上的畅销品种之一[1-4].香水百合为杂交种,有性繁殖后代易出现性状分离,并且播种苗的生育周期较长.通常采用分鳞茎、分珠芽、扦插的无性繁殖方法进行繁殖[4],但繁殖系数比较低,而且长期的无性营养繁殖易感染病毒,导致品种优良种性退化,影响产量和质量[5-6].利用组织培养技术,既可加快繁殖速度,消除病毒在体内的积累,还可以与基因工程相结合,为百合育种提供新方法.目前,对香水百合的组织培养主要是以鳞片为外植体诱导再生植株[1-7],以花器官为外植体进行植株再生的试验较少[8-9].
本实验以粉红色香水百合(简称粉红香水百合)的花丝、花柱和子房为外植体,研究了不同种类和浓度的植物生长调节物质在粉红香水百合愈伤组织的诱导、增殖、分化以及鳞茎苗生根中的影响,建立稳定的快速繁殖体系,为香水百合的规模化育苗及进一步生物技术研究提供技术支持.
1材料与方法
1.1材料
供试材料粉红香水百合(LiliumcasaBlanca) 于2012年12月购于广东岭南花卉市场.
2方法
1.2.1粉红香水百合愈伤组织的诱导
取粉红香水百合刚现蕾的小花苞(长度3~5cm),用自来水冲洗30min去除表面污物,于超净工作台上用75%酒精进行表面消毒30s,再用0.1%HgCl2消毒10min,无菌水洗涤5~6次.除去花苞外层花瓣,用剪刀和镊子把花冠切开,将花丝、花柱和子房分离出,切成0.5cm长的小段,分别接种到愈伤组织诱导培养基MS+2.0mg/Lpicloram(毒莠定),进行光照和黑暗培养.30d后记录外植体愈伤组织的诱导情况,统计愈伤组织的诱导率.
诱导率(%)= (产生愈伤组织的外植体个数 / 接入外植体个数)× 100%
1.2.2愈伤组织的增殖
挑选0.7g色泽鲜黄、颗粒状的愈伤组织接种在不同的增殖培养基中,培养基配方见表1.黑暗条件下培养60d后取出称重,记录愈伤组织的增殖倍数及增殖过程中的形态变化.
愈伤组织增殖倍数 = 新生愈伤组织的质量(g) / 接种愈伤组织的质量(g).
表1愈伤组织增殖培养基中植物生长调节物质的组成

培养基picloram(mg/L)2,4-D(mg/L)control00P11.0P22.0D11.0D22.0
注:愈伤组织增殖培养基以MS为基本培养基
1.2.3愈伤组织的分化
选择增殖获得的质地均一、致密块状愈伤组织接种在含不同浓度6-BA(0、1.0、2.0、3.0mg/L)的MS+0.2mg/LNAA的分化培养基中,分别在光照、黑暗+光照两种条件下进行培养.黑暗+光照培养时,愈伤组织10d后移出到光照条件下继续培养15d,25d后统计光照和黑暗+光照培养下愈伤组织分化所得小鳞茎数目.
1.2.4生根培养和移栽
取分化得到的长势一致小鳞茎,接种到添加不同浓度NAA(0、0.5、1.0、1.5mg/L)的MS+0.1% 活性炭的生根培养基上.每个处理15个重复,30d后观察并统计根系的生长状况.
选择具有良好根系、鳞茎健壮的幼苗(高3cm以上)作为移栽苗.移栽前,瓶苗置室内靠窗自然散射光下炼苗2~3d,打开瓶盖继续炼苗4~5d.将苗轻轻移出,用流水冲洗掉附着在苗上的培养基,移栽至经过高温灭菌的营养土:泥土(体积比1∶1)的基质中.用1/4MS营养液浇透保湿,每天喷雾一次,每周用1/4MS营养液浇一次,观察其生长情况,30d后统计成活率.
1.2.5培养条件和数据处理
以上所有培养基都采用固体形式,含蔗糖30g/L,琼脂7g/L,pH5.8.培养温度(25±2)℃,光照培养为每天光照16h,光照强度为2000lx,黑暗培养采用完全黑暗条件.所有试验均重复3次,采用均数±标准差表示.用SPSS13.0 数据处理软件分析各处理之间的差异显著性.
2结果与分析
2.1外植体和培养条件对粉红香水百合愈伤组织诱导的影响
花丝在愈伤组织诱导培养基上培养15d,大部分外植体膨大,部分外植体切口处开始出现愈伤组织;30d后,在光照培养下,诱导出瘤状和根茎状,颜色为绿色的愈伤组织(图1-a),愈伤组织诱导率为40%;在黑暗培养下,所诱导的愈伤组织呈疏松颗粒状,颜色有黄白色、乳白色和浅黄色(图1-b),愈伤组织诱导率为50%.
花柱和子房接入培养基后,只出现膨大现象,没有诱导出愈伤组织,随后绝大部分外植体坏死.
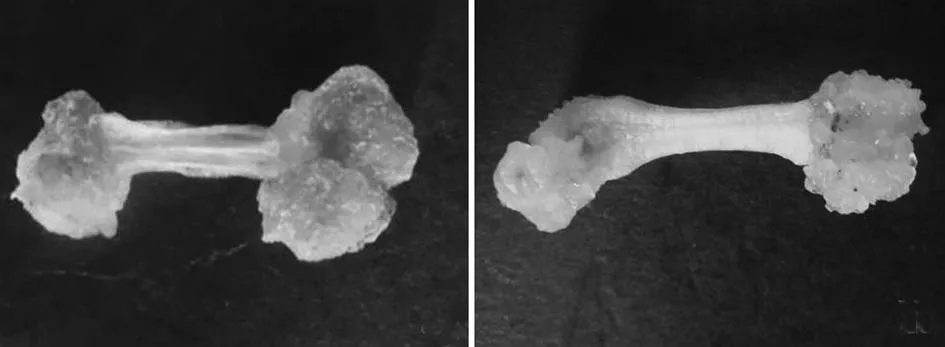
图1 在不同培养条件下从花丝诱导出的愈伤组织
2.2不同种类和浓度的激素对愈伤组织增殖的影响
将在黑暗培养条件下从花丝诱导出的黄色、疏松颗粒状愈伤组织接种到继代增殖培养基中. 在含picloram的培养基中,愈伤组织20d左右恢复生长,之后快速增殖,60d左右达到增殖高峰,但愈伤组织形态没有明显变化,仍然呈黄色、疏松颗粒状.当picloram浓度为1.0mg/L时,增殖倍数为5.67,当picloram浓度为2.0mg/L时,增殖倍数高达6.29(表2所示).而在含2,4-D的增殖培养基中,愈伤组织需30d左右恢复生长,增殖速度较慢,并且随着2,4-D浓度的增加,增殖倍数逐渐降低,当2,4-D浓度为2.0mg/L时,增殖倍数只有2.89倍,但愈伤组织形态发生了转变,产生了黄色、致密块状的愈伤组织,部分愈伤组织长出少许白色小鳞茎和根毛.
综上所述,当培养基中含有2.0mg/L的picloram,愈伤组织的增殖速度最快。
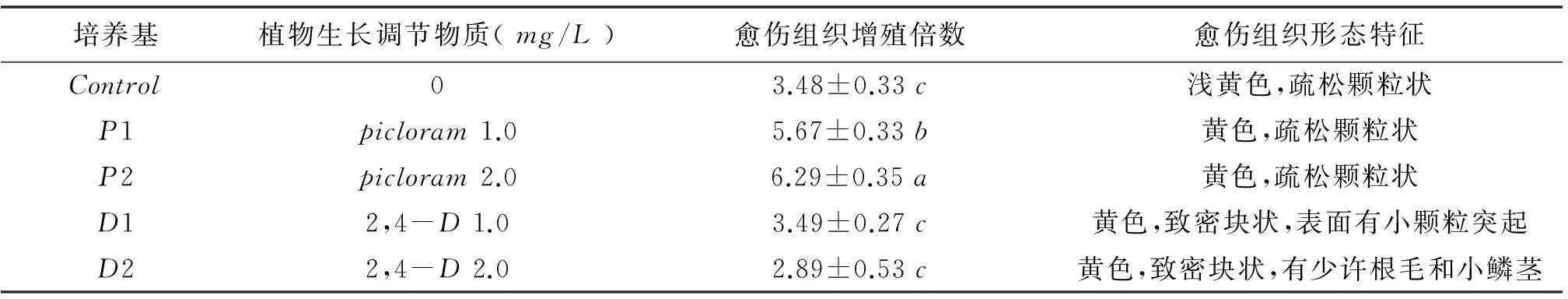
表2 植物生长调节物质对愈伤组织增殖的影响
注:表中数据为3次重复试验的平均值±标准差.不同小写字母(p<0.05)表示差异显著,下同.
2.36-BA的浓度和培养条件对愈伤组织分化的影响
将所获得的质地均匀、致密块状的愈伤组织接种到分化培养基中促进其进一步分化,发现6-BA浓度对愈伤组织分化成小鳞茎影响较大(表3).随着6-BA浓度的增加,愈伤组织分化形成的小鳞茎数目逐渐增加,当6-BA浓度为2.0mg/L时,分化形成的小鳞茎数目最多,从每克愈伤组织可获得51.9个小鳞茎;但随着6-BA浓度进一步升高为3.0mg/L时,分化形成的小鳞茎数目减少.
表36-BA和培养条件对愈伤组织分化的影响
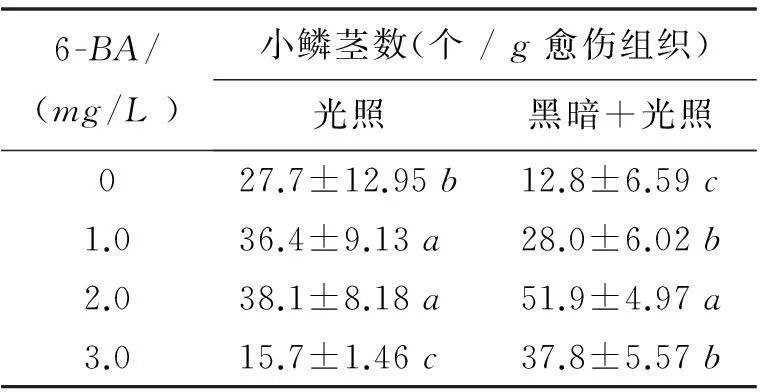
6-BA/(mg/L)小鳞茎数(个/g愈伤组织)光照黑暗+光照027.7±12.95b12.8±6.59c1.036.4±9.13a28.0±6.02b2.038.1±8.18a51.9±4.97a3.015.7±1.46c37.8±5.57b
注:黑暗+光照条件为先在黑暗条件下培养
10d,再转入光照条件下培养15d.
培养条件对小鳞茎的形成和品质有一定影响.在黑暗条件下,培养7d时从愈伤组织分化出白色的小鳞茎,10d后将白色粗壮的小鳞茎(图2-b)转入光照培养,小鳞茎逐渐转绿, 25d后统计发现,从每克愈伤组织最高可获得51.9个小鳞茎,小鳞茎生长正常,在生根培养基中可发育为健壮的试管苗.在光照条件下,培养15d后愈伤组织逐渐分化出绿色的小鳞茎(图2-a),25d后统计发现,从每克愈伤组织最高可获得38.1个小鳞茎,部分小鳞茎外层鳞片发育成叶片状,在生根培养基中不能展开发育成正常的试管苗. 综上所述,从愈伤组织分化小鳞茎的最适培养基组成为MS+2.0mg/L6-BA+0.2mg/LNAA,黑暗培养10d后再转入光照培养条件.

图2 在光照(a) 或黑暗(b)培养条件下愈伤 组织分化形成的小鳞茎
2.4NAA对小鳞茎生根的影响
将分化所得的小鳞茎接种到不同的生根培养基中进行生根培养,7d后小鳞茎开始生根、长叶,鳞茎增大变粗,一定浓度的NAA有利于试管苗生根.如表4所示,随着NAA浓度的增加,鳞茎苗不仅生根多,而且叶片逐渐展开,苗变得健壮,当NAA浓度为1.5mg/L时,鳞茎苗生根最多,根长而粗,苗最健壮.而在不含NAA的培养基中,鳞茎苗根细弱,叶片卷缩,无法展开,部分叶片黄化.
表4NAA浓度对小鳞茎生根的影响

NAA/(mg/L)株高(cm)根数根长(cm)03.57±0.20b3.60±0.33b1.79±0.23b0.53.57±0.23b4.44±0.80a1.88±0.20b1.03.64±0.48b3.82±0.46b2.38±0.19b1.54.90±0.33a4.92±0.77a4.92±0.77a
将具有良好根系、鳞茎健壮的再生植株(高3cm以上)炼苗后移栽在花盆中,7d后幼苗开始长出新叶和幼根,30d后统计其成活率为90%.
3讨论
外植体的生理状态对百合愈伤组织的形成和植株再生影响很大,取材部位和发育阶段不同,再生能力存在较大差异.Arzate等[10]以麝香百合(Lilium longiflorum)的花丝为外植体,通过诱导愈伤组织分化再生植株.Nhut等[11]用麝香百合的花梗、花托、花瓣、花柱等外植体进行离体培养,结果花托最易成活,且诱导率最高.柳玉晶等[12]以东方百合(Lilium‘Orientalhybrid’)的花柱、花丝、花瓣为外植体诱导愈伤组织分化再生植株, 只有花丝可以产生大量优质的胚性愈伤组织.本实验以粉红香水百合的花丝、子房和花柱等为外植体进行离体培养,结果发现只有花丝能够诱导出愈伤组织,这与文献报道的情况一致.
有研究发现,生长素picloram在百合属植物愈伤组织诱导和保持方面起重要生理作用[13-14].本实验发现当培养基中含生长素picloram时,粉红香水百合不仅愈伤组织诱导率高,而且增殖速度快,愈伤组织形态没有明显变化,呈疏松颗粒状,多次继代也能维持良好状态,这与张艺萍等人[15]的研究一致.但实验也发现当愈伤组织在含2,4-D的增殖培养基中培养时,增殖速度慢,形态却发生了转变,由疏松颗粒状转变为致密块状,将这些致密块状的愈伤组织转入分化培养基中能很快分化出小鳞茎. 2,4-D在粉红香水百合愈伤组织状态改变上所起的作用有待进一步的探讨.
Ishimori等[16]认为红点百合(Lilium rubellum)在黑暗条件下诱导出的试管鳞茎数量最多.孙红梅等[17]认为亚洲百合(LiliumAsiatichybrid)光培养诱导出试管小鳞茎的数目要多于暗培养,但小鳞茎的直径要小于暗培养. 在本实验中发现光暗培养结合对粉红百合小鳞茎的诱导有促进作用,分化出的小鳞茎数量最多且鳞茎粗壮.本实验也发现较低浓度的生长素有利于百合生根从而有利于获得良好的再生植株[18-19].
参考文献:
[1] 高敏. 香水百合的组培快繁[J]. 广西农业科学, 2002(3):120-121.
[2] 刘丽敏. 百合组织培养快繁研究[D]. 广西大学, 2004.
[3] 苏琛. 香水百合再生体系的建立[J]. 安徽农业科学, 2012,40 (7):3906-3907, 3911.
[4] 李冰华, 金晓玲, 刘雪梅. 香水百合鳞片组织培养再生体系的建立[J]. 江苏农业科学, 2008(4): 51.
[5] 潘佑找,陈香丽, 胡琼,等. 香水百合的组织培养技术研究[J]. 安徽农学通报, 2009, 15 (17): 46,95.
[6] 何家涛, 王会. 百合离体培养与植株再生体系的建立[J]. 江西农业学报, 2007, 19 (4): 30-32.
[7] 阮少宁,杨华, 梁一池, 等. 香水百合组织培养的试验研究[J]. 福建林学院学报, 2001, 21(2): 142- 145.
[8] 张 立, 王日明. 香水百合花瓣组织培养[J]. 现代农业科技, 2011(11):191,194.
[9] 万容, 李群. 香水百合组织培养中外植体和培养基配方的选取[J]. 南方农业, 2012, 6 (9):46-48.
[10]ARZATEFA.Efficientcallusinductionandplantregenerationfromfilamentswithantherinlily(Lilium longiflorumThunb)[J].PlantCellRep, 1997, 16(12): 836-840.
[11]NHUTDT,LEBV,TANAKAM,etal.ShootinductionandplantregenerationfromreceptacletissuesofLilium longiflorum[J].ScientiaHorticulturae, 2001, 87: 131-138.
[12] 柳玉晶, 龚束芳, 樊金萍, 等. 百合愈伤组织的诱导及植株再生[J]. 东北农业大学学报, 2007, 38 (3): 352-355.
[13]HANDS,NIIMIY,NAKANOM.Longtermmaintenanceofananther-derivedhaploidcalluslineoftheAsiatichybridlily‘ConnecticutKing’[J].PlantCell,TissueandOrganCulture,2000, 61: 215-219.
[14]MORIS,ADACHIY,HORIMOTOS,etal.CallusformationandplantregenerationinvariousLiliumspeciesandcultivars[J].InVitroCellularandDevelopmentalBiology.Plant, 2005, 41: 783-788.
[15] 张艺萍,吴丽芳,吴学蔚,等. 东方百合胚性愈伤组织的诱导和植株再生研究[J]. 江西农业学报, 2008, 20 (12) :33-36.
[16]ISHIMORIT,NIIMIYJ,HANDS.InvitrofloweringofLilium rubellumBaker[J].ScientiaHorticulturae, 2009, 120:246-249.
[17] 孙红梅, 张 静, 李雪艳,等.光暗不同培养条件下植物生长调节剂对亚洲百合鳞茎诱导的影响[J].沈阳农业大学学报, 2011, 42(5):549-554.
[18] 赵庆芳, 曾小英, 丁兰,等. 东方百合组织培养和快速繁殖研究[J].西北师范大学学报,2003, 39(1):66-68.
[19] 许洁婷, 王月, 唐克轩, 等. 麝香百合花部组织离体培养与植株再生[J]. 上海交通大学学报(农业科学版), 2008, 26(1): 13-16.
收稿日期:2016-03-11
基金项目:广东省科技计划项目(2015A030302097);广东省创新强校工程省级重大项目(自然科学类,2014KZDXM076);广州市科技计划资助项目(2014J4100151);广东省高等院校学科与专业建设专项资金资助项目(2013KJCX0137)
作者简介:涂红艳,女,江西吉安人,广东第二师范学院生物与食品工程学院讲师.
*通讯作者:肖望,女,湖北潜江人,广东第二师范学院生物与食品工程学院教授,博士.
中图分类号:Q 943.1
文献标识码:A
文章编号:2095-3798(2016)03-0075-05
A Study on in vitro Culture and PlantRegenerationofLiliumcasaBlanca
TUHong-yan,XIAOWang*,HUAXiu-xiang,LIANGShen-juan
(BiologyandFoodEngineeringInstitute,GuangdongUniversityofEducation,Guangzhou,Guangdong, 510303,P.R.China)
Abstract:Using the filaments, styles and ovaries of Lilium casa Blanca as the explants to in vitro culture, the effect of callus induction and plant regeneration of different explants and different plant growth regulators were studied in this paper. The results indicated that in three types of explants, the ability of inducing calli from filaments was the best, the inducing rates of filaments was 40% in light culture and 50% in dark culture. The calli being cultured on MS medium with 2.0 mg/L picloram was helpful for proliferation of calli, the callus proliferation times was 6.29. The optimum medium for bulblets formation was MS+2.0 mg/L 6-BA+0.2 mg/L NAA.The optimum medium for rooting culture was MS+1.5 mg/L NAA+ 0.1% activated carbon. Regenerated plantlets were acclimatized and transplanted outdoors, the survival rate was 90% in a month.
Key words:Lilium casa Blanca; in vitro culture; plant regeneration
